Nrf2通路对日本脑炎病毒感染小鼠神经瘤细胞引起氧化应激反应的影响
2023-02-03刘泽霖郭晓艳李佳欢高明星程国富胡薛英张万坡谷长勤
刘泽霖,郭晓艳,李佳欢,高明星,程国富,胡薛英,张万坡,谷长勤
(华中农业大学动物医学院,武汉 430070)
日本脑炎(Japanese encephalitis,JE)是由日本脑炎病毒(Japanese encephalitis virus,JEV)感染引起一种严重的人畜共患病[1]。临床以神经系统症状为主[2],病死率高达30%,30%~50%的患者存在精神后遗症[3]。氧化应激是指体内活性氧(reactive oxygen species,ROS)产生过多,氧化和抗氧化系统失衡,引起细胞损伤的反应[4]。JEV感染巨噬细胞后通过转录组分析显示氧化应激反应中的多个基因上调,氧化应激诱导细胞死亡或凋亡途径被激活[5]。在体内试验中,病毒感染大鼠也导致脑内的氧化还原失衡,引起氧化应激反应[6-8]。同为黄病毒的登革热病毒(dengue virus,DENV)感染机体后可以通过多种方式诱导的ROS生成[9],寨卡病毒(Zika virus,ZIKV)在体内和体外也能够引起ROS的升高,降低了抗氧化酶的活性,从而引起氧化应激反应[10-11]。
核因子E2相关因子2(Nrf2)是一种涉及细胞和机体防御氧化应激等方面的转录因子,Kelch样ECH相关蛋白1(Keap1)是其主要的抑制因子[12]。机体内许多抗氧化蛋白是由Nrf2-Keap1途径编码的,如血红素加氧酶-1(heme oxygenase-1,HO-1)等。有研究表明JEV感染N2a细胞后使Nrf2蛋白及SOD等抗氧化蛋白表达降低[13]。但Nrf2/HO-1通路在JEV中的致病机制中的作用研究仍不清楚。叔丁基对苯二酚(tert-butylhydroquinone, TBHQ)是一种芳香有机化合物,长期以来一直用作食品防腐剂。另据报道,TBHQ是Nrf2/Keap1/ARE信号通路有效的激活剂之一[14]。TBHQ通过激活Nrf2途径,在酒精性心肌病、急性肝损伤和神经退行性疾病等一些疾病的体外或体内研究中被证明具有抗氧化作用[15-18]。然而,TBHQ是否能抑制由JEV诱导的氧化应激引起的损伤仍然是未知的。因此本研究通过利用Nrf2激动剂TBHQ探讨Nrf2在日本脑炎病毒致神经损伤过程中的作用机制,为临床治疗日本脑炎的药物研究提供理论依据。
1 材料与方法
1.1 材料
日本脑炎病毒P3毒株,由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠。乙脑病毒感染实验在华中农业大学Ⅱ级生物安全实验室(P2实验室)中进行,并在试验结束后按照P2实验室规定进行无害化处理。
DMEM培养基,无支原体胎牛血清均购于Gibco公司;MDA试剂盒,SOD试剂盒,CAT试剂盒均购于南京建成生物公司;活性氧检测试剂盒,购于碧云天生物技术有限公司;TBHQ,购于Sigma公司;抗体JEV-E,由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠;抗体Phospho-Nrf2(S40),抗体Nrf2,抗体Heme Oxygenase 1(HO-1)均购于武汉华安生物科技有限公司;抗体HRP Goat Anti-Rabbit IgG(H+L)均购于Abclonal Technology公司;抗体β-actin,货号GB11001,购于武汉赛维尔生物科技有限公司。
1.2 细胞培养及感染
小鼠神经瘤母细胞(N2a),由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠。N2a细胞培养于含10%胎牛血清和1%青链霉素双抗的DMEM完全培养液中。培养条件为37 ℃,5% CO2及饱和湿度,当细胞长到80%时用于后续试验。
用12孔板培养N2a细胞,每孔2×105个细胞。共设四组,即DMEM对照组、JEV试验组、TBHQ组和JEV+TBHQ组,每组三个孔。病毒感染细胞时,接毒剂量为5个MOI,37 ℃培养箱吸附1.5 h后弃去含有病毒的上清,再用PBS洗3遍,每孔加入1 mL含2% FBS的DMEM维持液;放入37 ℃培养箱继续培养,即完成病毒感染细胞的过程。根据需要在感染不同时间点后将细胞收集。TBHQ组和JEV+TBHQ组在处理细胞前及收样前6 h将细胞培养液换为含TBHQ的维持液。
1.3 ROS染色
通过DCFH-DA法检测细胞内ROS含量。N2a细胞以每孔2×105个细胞接种到12孔板。处理结束后,将培养板内培养液吸出,PBS洗3次;用10 μmol·L-1DCFH-DA 37 ℃孵育20 min;PBS洗3次,使用荧光倒置显微镜观察。
1.4 MDA、SOD、CAT检测
将各组细胞收集,加入蛋白裂解液进行裂解,离心取上清,并用BCA法测定蛋白浓度。参照南京建成公司相关试剂盒说明书进行操作。
1.5 荧光定量PCR
将各组N2a细胞收集,加入Trizol试剂,提取总RNA,并反转录为cDNA进行荧光定量PCR检测。qPCR反应的引物序列如表1。qPCR反应条件如下:预变性95 ℃ 30 s;进入循环,95 ℃ 5 s,60 ℃ 30 s,共40个循环;熔解曲线分析,95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。以β-actin的mRNA水平为基准,采用2-ΔΔCt分析法计算各样本中目的基因的相对表达水平。
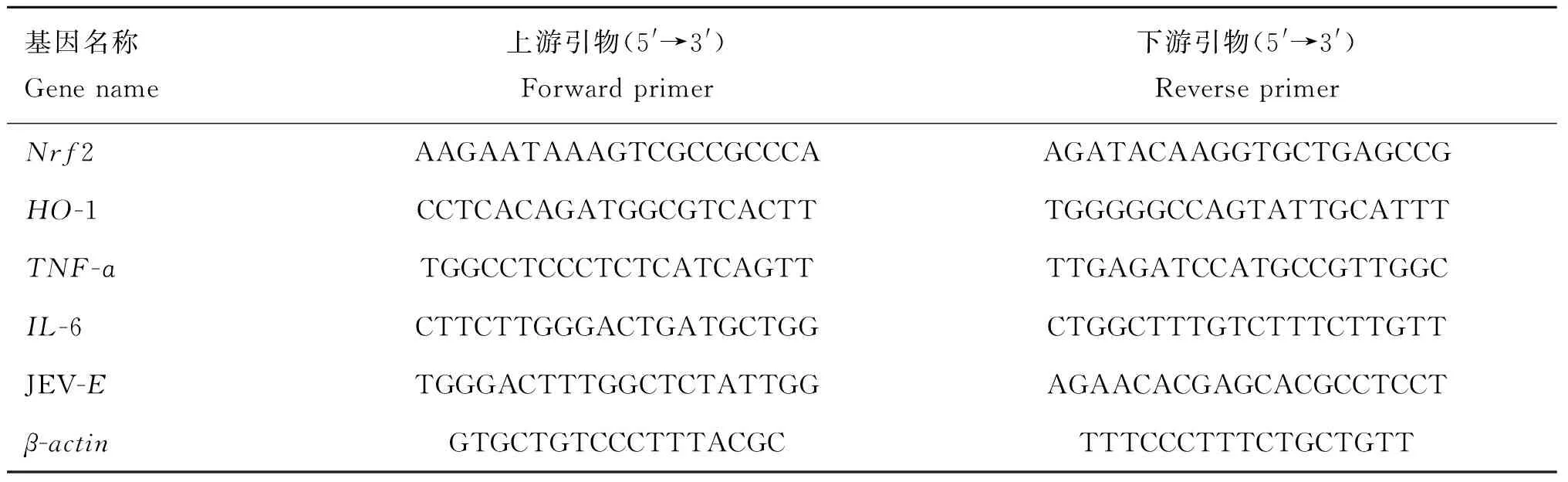
表1 qPCR引物序列Table 1 qPCR primer sequences
1.6 蛋白免疫印迹
将各组N2a细胞收集,加入蛋白裂解液进行裂解,离心取上清,并用BCA法测定蛋白浓度。用SDS-PAGE分离蛋白质,并转移到PVDF膜上。将膜在5%脱脂奶中封闭2 h,加入抗体4 ℃孵育过夜。用TBST缓冲液洗3次,室温孵育二抗1 h。用ECL显色剂显影。
1.7 统计分析
应用统计分析软件Graphpad Prism 6计算各组数据的平均值和标准差,多组间比较使用单因素方差分析(one-way ANOVA),P<0.05为差异显著,标记为*;P<0.01为差异极显著,标记为**;P<0.001为差异极显著,标记为***。
2 结 果
2.1 JEV感染N2a细胞后ROS水平变化
为了研究JEV对N2a细胞产生氧化应激的作用,通过DCFH-DA的方法检测JEV感染N2a细胞后不同时间点细胞ROS水平变化。结果显示,对照组细胞随时间延长,细胞内DCF荧光水平少量增加;JEV感染N2a细胞后,12 h少量细胞内DCF荧光增加,24 h细胞内DCF荧光水平明显升高,并在感染后36 h细胞内DCF荧光水平达到最高(图1)。与对照组相比,JEV感染24 h后DCF荧光强度均显著升高(P<0.05)(图2)。

图1 JEV感染N2a细胞后不同时间点DCF荧光成像(100×)Fig.1 Intracellular DCF fluorescence imaging at different time points after JEV infection of N2a cells (100×)
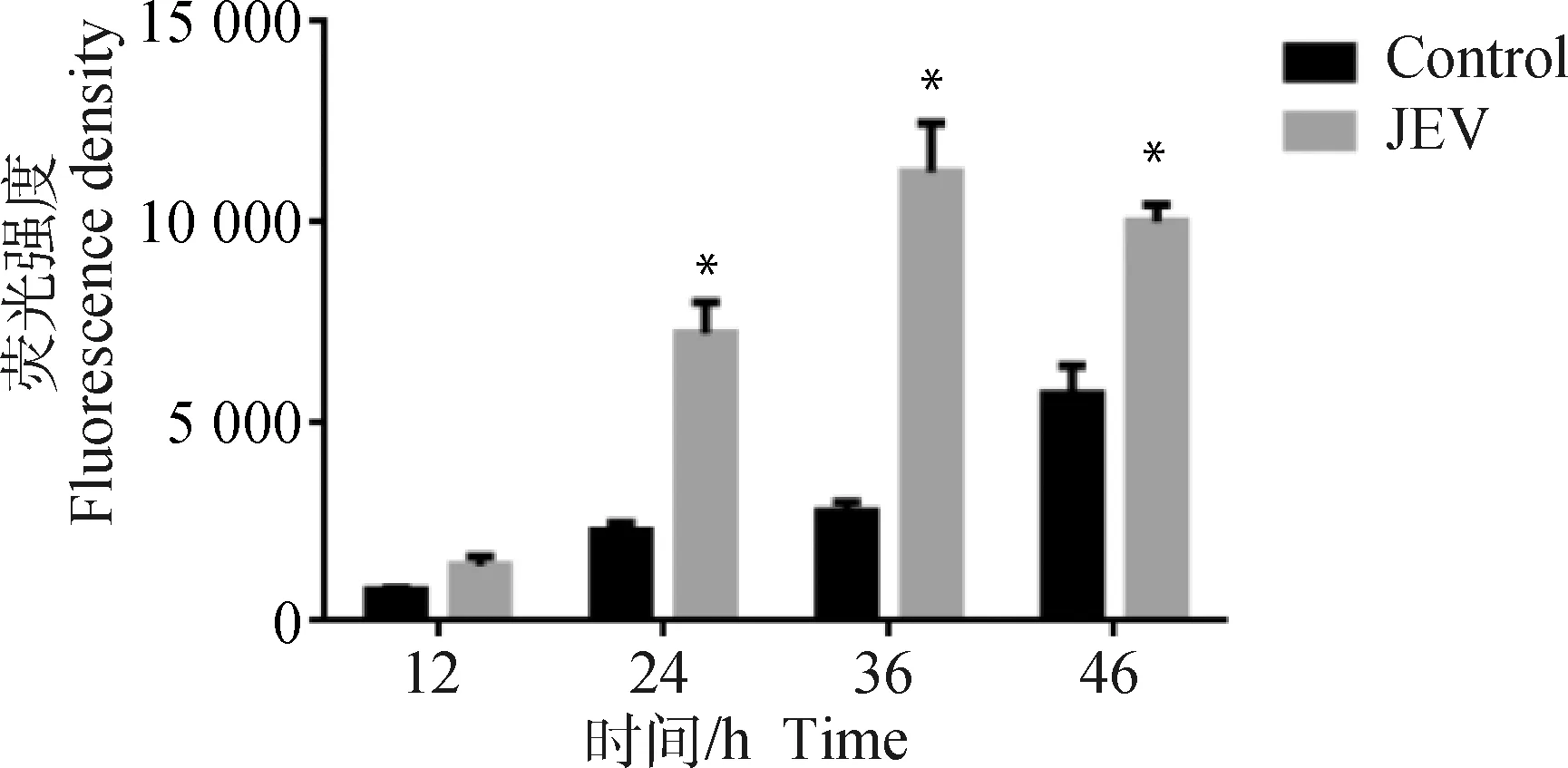
*. P<0.05图2 JEV感染N2a细胞后不同时间点DCF荧光强度Fig.2 Intracellular DCF fluorescence intensity at different time points after JEV infection of N2a cells
2.2 JEV感染后不同时间点Nrf2/HO-1通路相关因子表达
通过qPCR方法检测JEV感染N2a细胞不同时间点Nrf2/HO-1通路及炎性因子的mRNA表达。结果如图3所示,Nrf2 mRNA在感染后12和24 h变化不明显,在感染后36 h mRNA表达明显升高(P<0.05);HO-1 mRNA在24 h略升高,在36和48 h显著上升(P<0.05);TNF-α mRNA也在36 h时有明显增加(P<0.05);IL-6在感染早期变化不明显,在36 h时显著升高(P<0.05),并在48 h有所下降。因此选用JEV感染36 h作为病毒感染时间进行后续细胞感染试验。
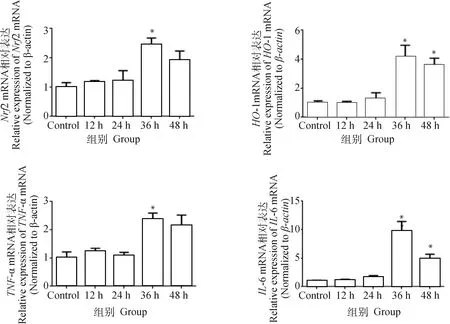
*. P<0.05; n=3图3 JEV感染N2a细胞不同时间点相关因子转录Fig.3 Transcription of factors associated with JEV infection of N2a cells at different time points
2.3 TBHQ对JEV感染N2a细胞病变的观察
根据前期预试验TBHQ浓度及作用时间筛选,选用40 μmol·L-1TBHQ处理6 h作为药物处理条件。如图3所示,对照组(图4A)细胞胞体饱满,形状规则;而JEV组(图4B)细胞出现严重细胞损伤,失去正常细胞形态,细胞皱缩,通透性增强,胞膜破裂,细胞轮廓不清晰,有部分区域仍可看到破损的细胞碎片(如箭头所示);TBHQ组(图4C)细胞状态较好,形状规则,无明显细胞病变;JEV+TBHQ组(图4D)可见少量细胞皱缩,大多细胞形态较好,轮廓清晰。
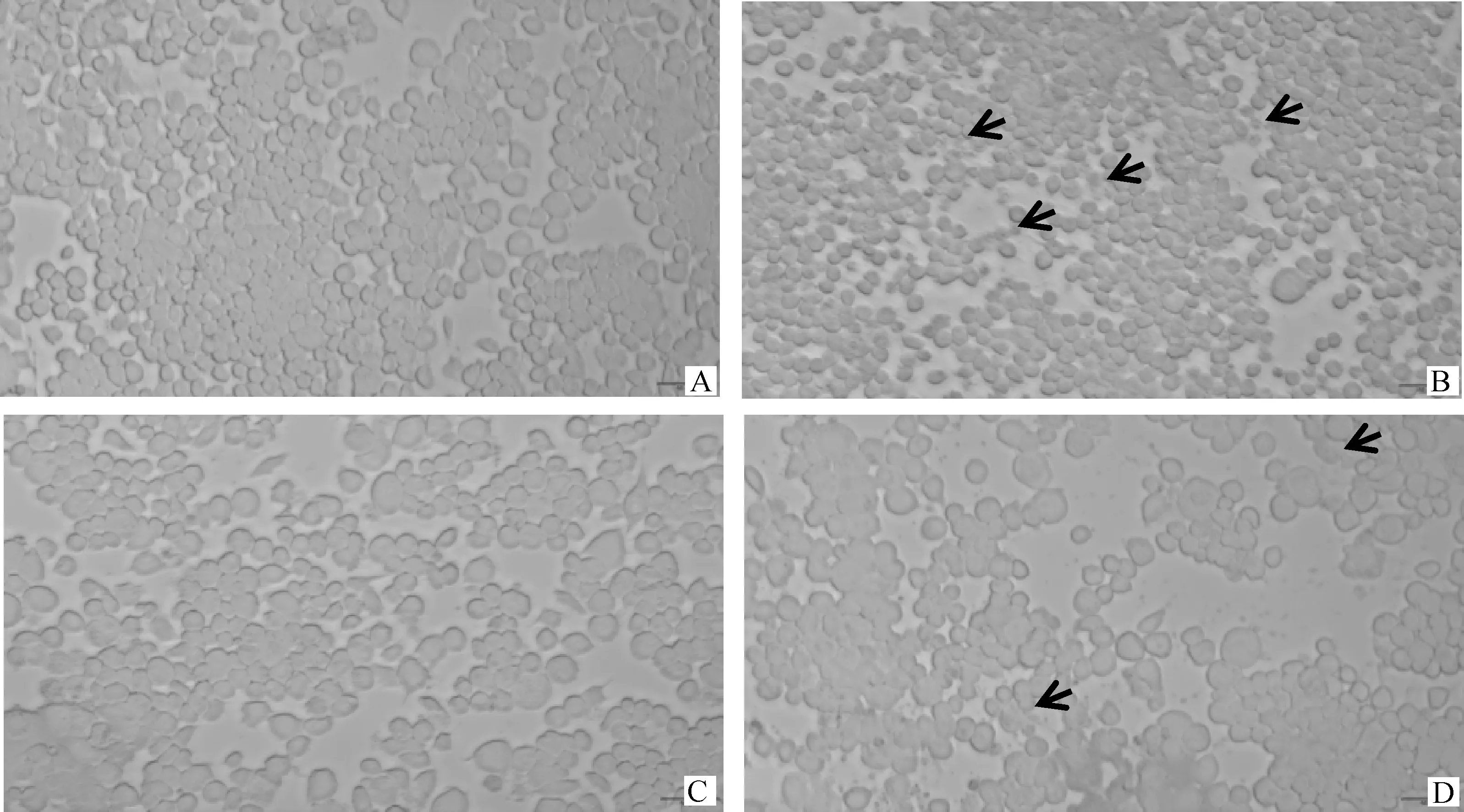
A.对照组;B.JEV组;C.TBHQ组;D.JEV+TBHQ组。箭头.细胞破裂A. Control group; B. JEV group; C. TBHQ group; D. JEV+TBHQ group. Arrow. Cell broken图4 JEV感染36 h后的细胞病变(200×)Fig.4 Cytopathological changes after 36 h of JEV infection (200×)
2.4 TBHQ对JEV感染N2a细胞氧化应激水平的变化
检测TBHQ对JEV引起细胞内ROS水平变化,结果如图5所示,对照组(图5A)和TBHQ组(图5C)只有少量DCF荧光信号,而JEV组(图5B、6)与对照组和TBHQ组相比细胞内DCF荧光强度增强(P<0.05),JEV+TBHQ组(图5D、6)相比于JEV组细胞内DCF荧光强度降低(P<0.05),这表明TBHQ降低了JEV引起的ROS水平。
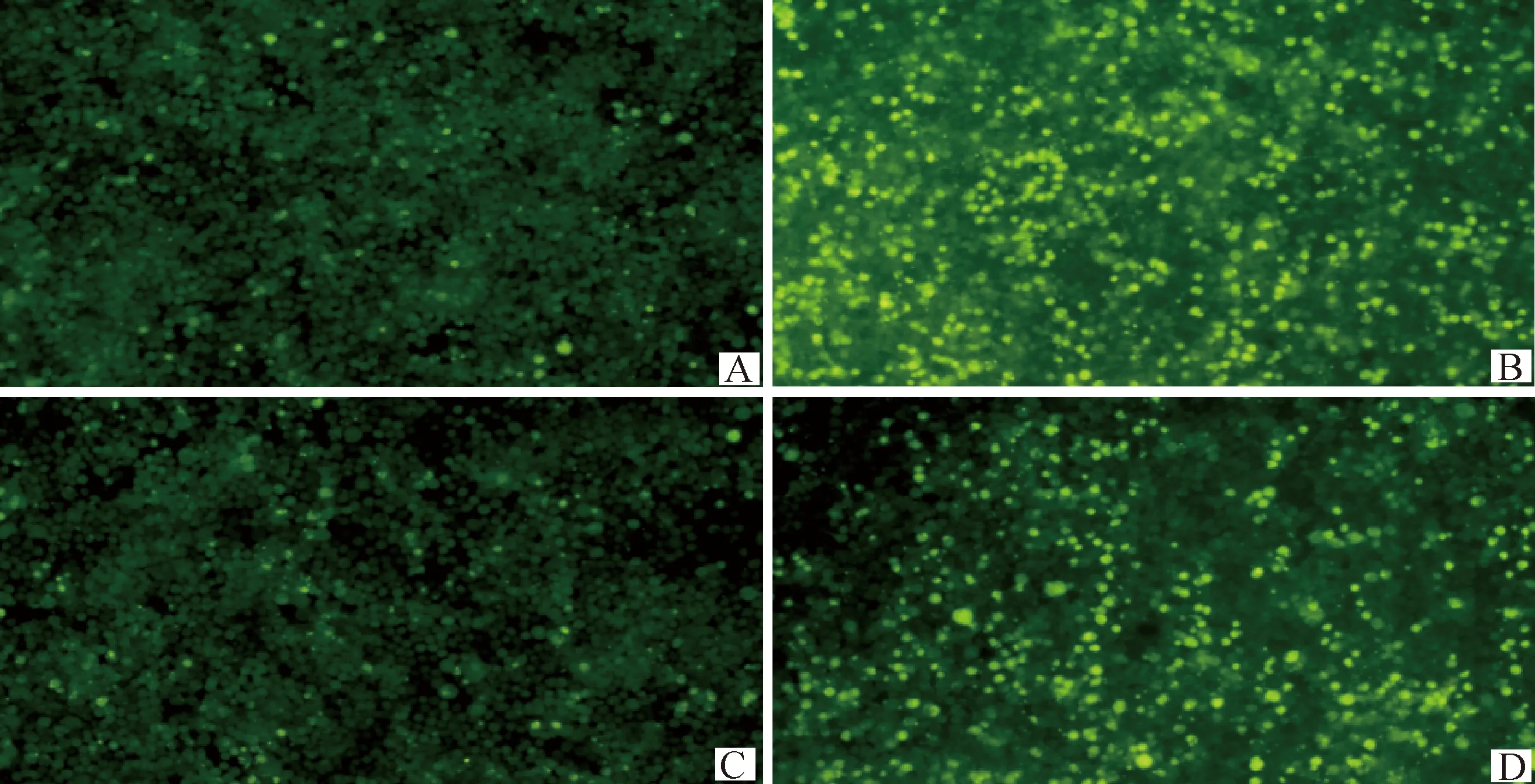
A.对照组;B.JEV组;C.TBHQ组;D.JEV+TBHQ组A. Control group; B. JEV group; C. TBHQ group; D. JEV+TBHQ group图5 JEV感染N2a细胞后36 h细胞内DCF荧光水平变化(100×)Fig.5 Changes in intracellular DCF fluorescence levels 36 h after JEV infection of N2a cells (100×)

*. P<0.05图6 JEV感染N2a细胞后36 h各组细胞DCF荧光强度变化Fig.6 Fluorescence intensity of intracellular DCFs 36 h after JEV infection of N2a cells in each group
对细胞内MDA、SOD、CAT水平进行检测。结果如图7显示,JEV感染细胞后与对照组细胞相比MDA含量升高(P<0.05),SOD、CAT水平均有所降低(P<0.05)。而JEV+TBHQ组与JEV组相比,MDA含量降低,SOD、CAT含量升高,表明TBHQ在一定程度上缓解了JEV引起的氧化应激反应。
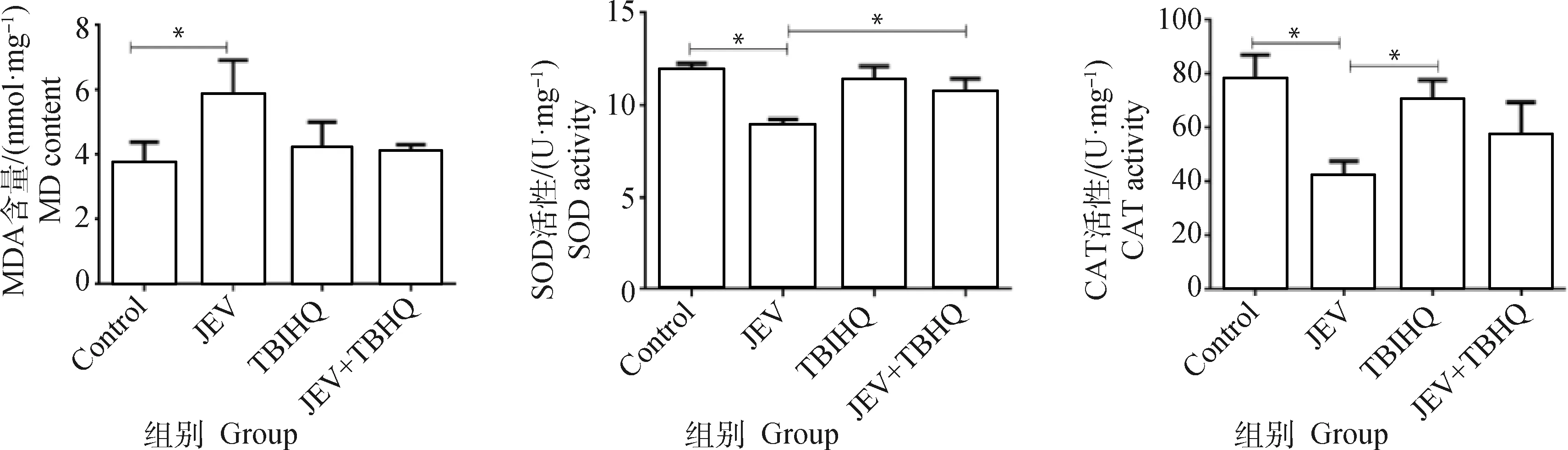
*. P<0.05; n=3图7 JEV感染N2a细胞后MDA、SOD、CAT水平变化Fig.7 Changes in MDA, SOD and CAT levels after JEV infection of N2a cells
2.5 TBHQ对JEV感染N2a细胞内Nrf2/HO-1通路相关因子的检测
为了观察JEV与TBHQ对Nrf2/HO-1信号通路的作用,对Nrf2/HO-1通路主要相关因子进行检测。如图8所示,JEV感染细胞后激活了Nrf2和HO-1 mRNA的表达,JEV+TBHQ组Nrf2和HO-1 mRNA的表达相比于JEV组进一步升高,两组和对照组的转录水平相比,差异显著(P<0.05)。图9显示JEV感染细胞后Nrf2和HO-1蛋白的表达均显著增加(P<0.05),JEV+TBHQ组与JEV组相比HO-1蛋白的表达水平进一步升高但无显著性差异。
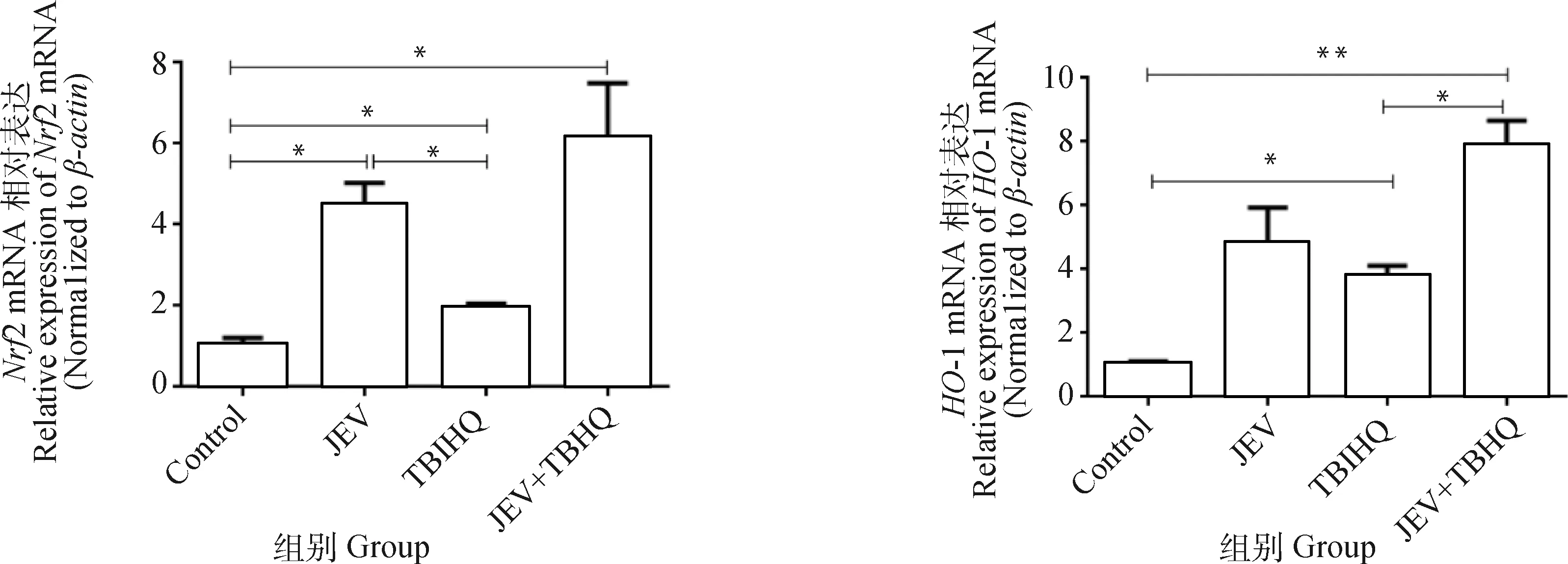
*. P<0.05; **. P<0.01; n=3图8 JEV感染后对Nrf2、HO-1 mRNA的检测Fig.8 Detection of Nrf2, HO-1 mRNA after JEV infection
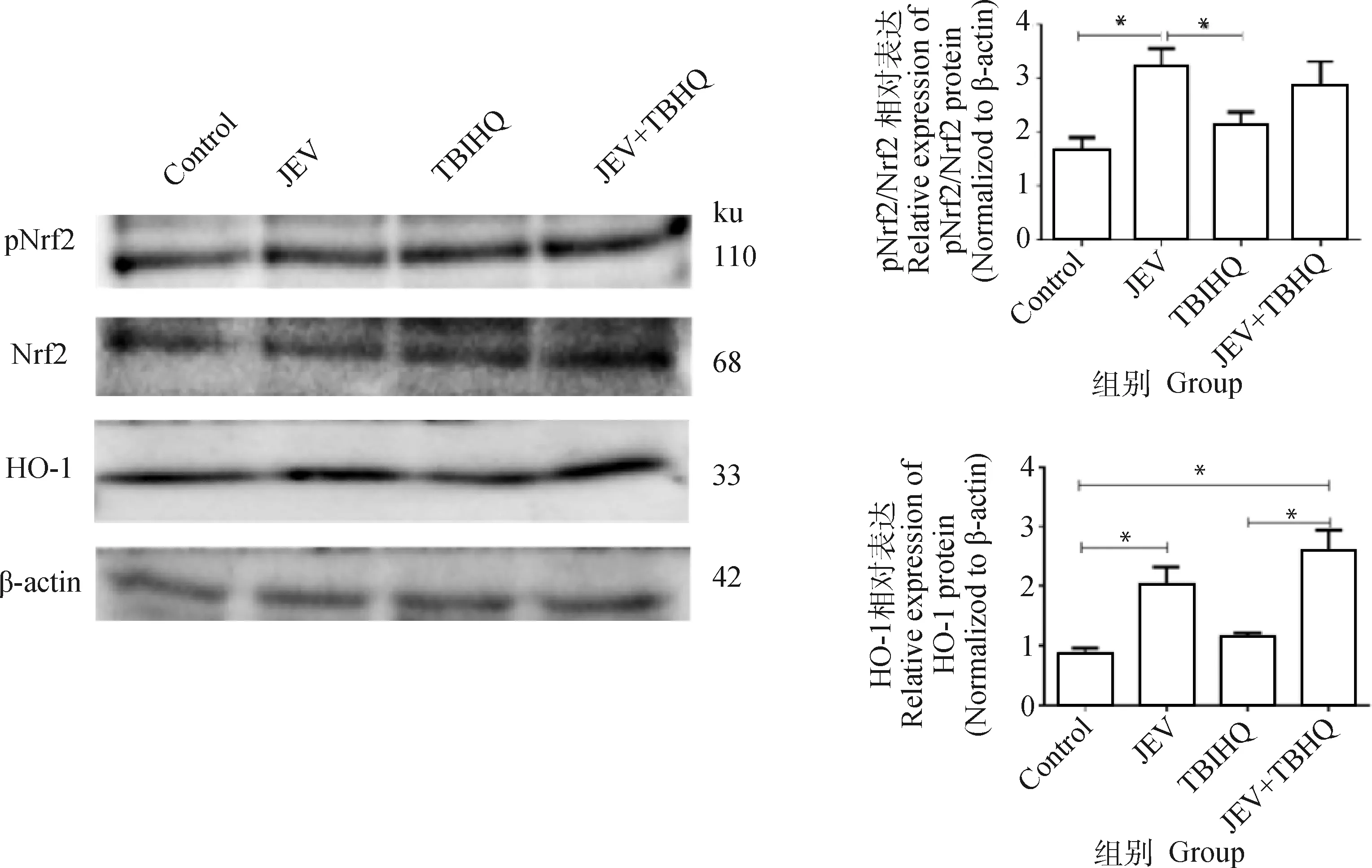
*. P<0.05; n=3图9 JEV感染N2a后对Nrf2、HO-1蛋白的检测Fig.9 Detection of Nrf2, HO-1 protein after JEV infection
并通过免疫荧光染色法检测细胞内Nrf2表达水平。结果显示,JEV组(图10B、11)、TBHQ组(图10C、11)和JEV+TBHQ组(图10D、11)与对照组(图10A、11)相比,均能引起细胞Nrf2蛋白荧光水平升高(P<0.05,P<0.001)。并且JEV组(图10B、11)、TBHQ组(图10C、11)和JEV+TBHQ组(图10D、11)与对照组(图10A、11)相比,Nrf2蛋白由胞质向胞核转移明显,表明JEV感染和TBHQ作用于N2a都能引起Nrf2通路的激活。
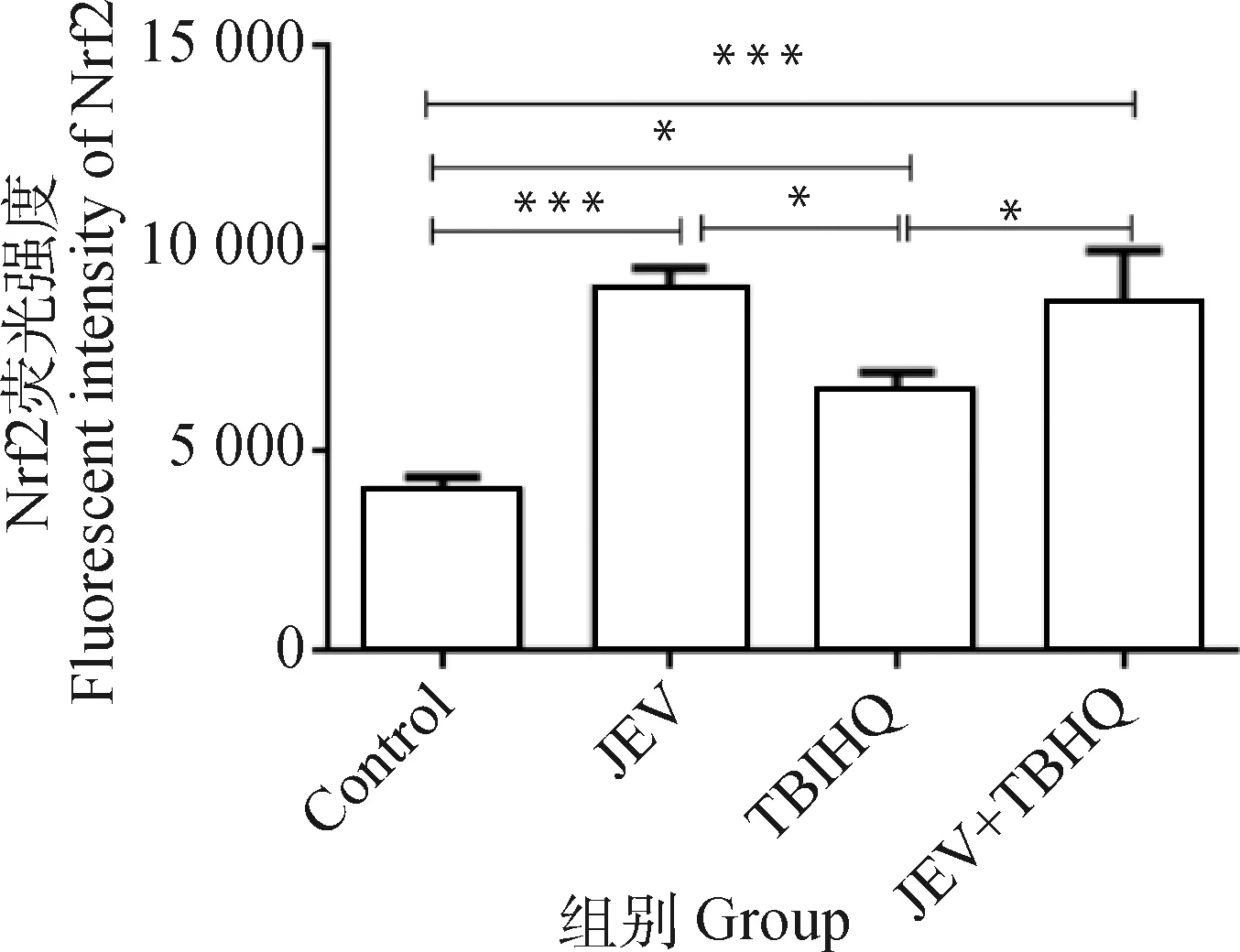
*. P<0.05; ***. P<0.001图11 JEV感染N2a细胞后Nrf2蛋白的平均荧光强度Fig.11 Mean fluorescence intensity of Nrf2 protein after JEV infection of N2a cells in each group
2.6 TBHQ对JEV感染N2a炎性因子的检测及病毒含量变化
通过qPCR的方法对JEV感染并用TBHQ干预后细胞的炎性因子进行检测。结果如图12显示,TBHQ组与对照组相比炎性因子无明显差异;JEV组与对照组相比,TNF-α和IL-6 mRNA的表达均显著升高(P<0.05,P<0.01);JEV+TBHQ组与JEV组相比,TNF-α mRNA表达降低但无显著差异性,IL-6 mRNA表达显著降低(P<0.01)。通过绝对荧光定量法对病毒含量进行检测,结果显示,JEV+TBHQ组与JEV组相比,病毒含量显著降低(P<0.05)。
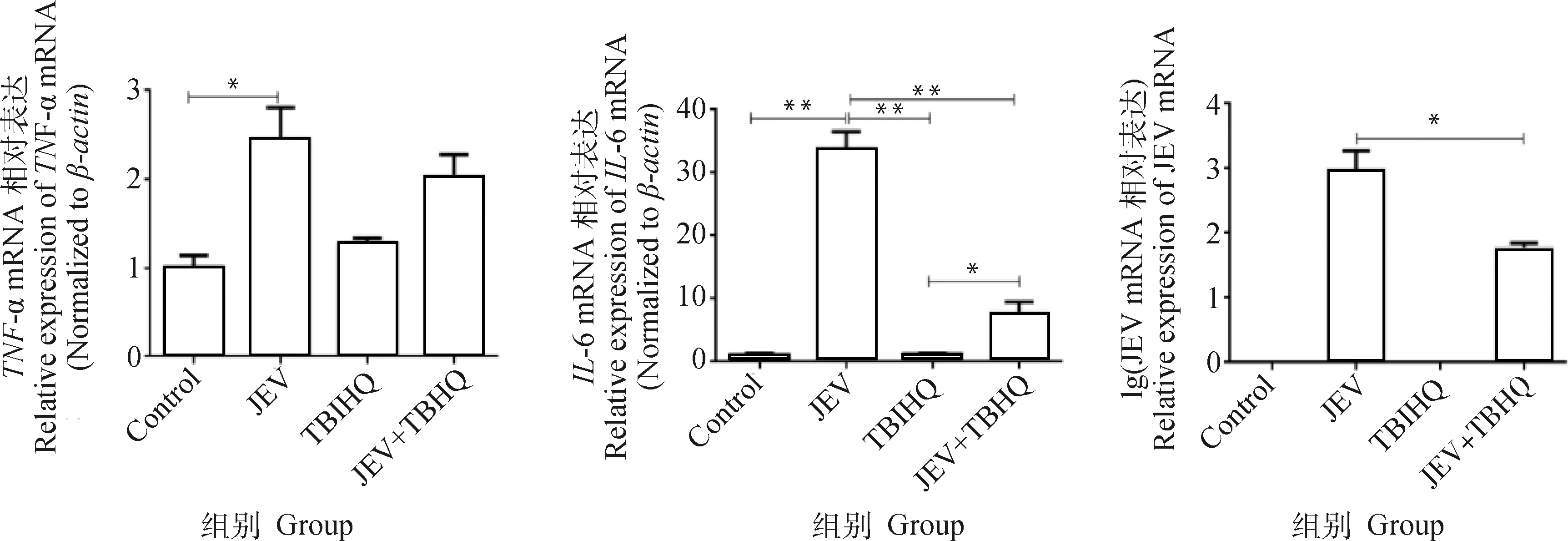
*. P<0.05; **. P<0.01; n=3图12 JEV感染后对炎性因子的检测及病毒含量变化Fig.12 Detection of inflammatory factors and changes in viral content following JEV infection
3 讨 论
日本脑炎病毒作为一种嗜神经病毒,能够靶向中枢神经系统,引起神经细胞损伤,导致神经症状的产生[19]。氧化应激反应是机体在各种因素刺激下,氧化物产生与消除失衡,导致体内氧化物积累过多,对细胞及分子产生损伤的过程[20]。本研究结果显示病毒感染后引起ROS水平升高,MDA含量增加,SOD、CAT水平降低,表明病毒感染后引起氧化应激反应,这也与前人的研究结果一致[8]。
Nrf2作为抗氧化通路的关键转录因子,已被证明在多种疾病中发挥作用。HO-1作为抗炎抗氧化剂在神经和心血管疾病中被广泛研究[21]。本研究也证实JEV感染后会激活Nrf2及其下游HO-1基因的表达。TBHQ是Nrf2/Keap1/ARE信号通路有效的激活剂之一[14]。本研究通过用TBHQ作用于JEV感染的N2a细胞,使JEV感染后引起的ROS高水平有所降低,同时也在一定程度上缓解了JEV引起的MDA、SOD等变化,表明TBHQ减弱了JEV引起的氧化应激反应。在ROS生成酶中,NADPH氧化酶是产生ROS的主要来源[22]。有研究表明,JEV感染细胞后激活了NADPH氧化酶[23]。Nrf2可以通过抑制NADPH的两个亚型NOX2、NOX4来减少ROS的产生[24-25],这也可能是TBHQ减少JEV引起的氧化应激反应的主要原因。研究表明,DENV感染后晚期ROS水平升高是由于病毒的NS2B3蛋白酶复合物靶向Nrf2,使其以蛋白水解的方式降解,抑制了抗氧化基因的表达,从而加强了氧化应激反应[26]。灵西酮、(E)-古格固酮等药物可以通过激活Nrf2/HO-1通路表现出显著的抗DENV活性,增加抗病毒干扰素反应和下游抗病毒基因表达[27-29],激活Nrf2及下游的HO-1能够减少ZIKV在细胞中的复制及氧化应激反应[30-32]。
TBHQ作为抗氧化剂在神经系统疾病中的保护作用也有较多研究。TBHQ能够缓解神经退行性疾病中神经元的损伤[33-34]。TBHQ可以减轻神经胶质细胞的激活及炎性因子的释放,抑制了缺血缺氧引起神经元变性[35]。TBHQ还可以减轻甲基苯丙胺、铊等引起的神经元损伤,抑制神经元凋亡和氧化应激反应[36-38]。本研究也表明TBHQ的使用减轻了JEV感染N2a细胞引起的细胞损伤。JEV感染能够引起神经细胞炎性反应;TBHQ作用后,细胞炎性因子水平降低,表明TBHQ激活Nrf2/HO-1通路减轻了JEV引起的细胞炎性反应。TBHQ诱导的Nrf2活性显著降低了脑部氧化应激水平,可以进一步抑制NF-κB活化和炎症细胞因子产生[39-40]。也有报道TBHQ能够通过抑制p38 MAPK磷酸化来抑制胶质细胞的过度活化[41]。这也表明TBHQ在炎症调控中有重要作用。
本研究通过建立乙脑病毒的体外感染模型,研究JEV感染后引起细胞ROS水平升高,并进一步激活了Nrf2/HO-1抗氧化通路。用Nrf2因子的激动剂TBHQ作用于细胞,发现TBHQ的使用降低了氧化应激水平及炎症水平,缓解了JEV引起了细胞损伤。这表明Nrf2/HO-1抗氧化通路对JEV感染引起的损伤有一定的缓解作用,这也为治疗日本脑炎临床药物的研究开发提供新的策略。
4 结 论
通过建立Nrf2激动剂TBHQ处理JEV感染的N2a细胞的体外感染模型,发现TBHQ通过激活Nrf2/HO-1通路,降低了JEV感染引起的氧化应激反应及炎症水平,缓解了细胞损伤。
