多房棘球蚴感染对小鼠肝脂质代谢的影响
2023-02-03李艳萍刘婷丽陈国梁王立群郭小腊骆学农
李 红,李艳萍,刘婷丽,陈国梁,王立群,郭小腊,骆学农,2*
(1.中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室/甘肃省动物寄生虫病重点实验室,兰州 730046;2.扬州大学 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
多房棘球蚴病(echinococcosis multilocularis)是由多房棘球绦虫的幼虫——多房棘球蚴(Echinococcusmultilocularis)寄生于人和动物的肝、肺等器官所引起的一种严重危害人和动物健康的寄生虫病[1]。多房棘球蚴病多发于牧区,我国西北地区和青藏高原东部地区为此病的重灾区[2]。多房棘球蚴在宿主肝组织内以出芽的方式浸润性增殖,不断产生新的囊泡,并侵蚀邻近组织[3],当包囊直径超过10 cm或肝等器官被包囊占据70%以上时,可引发门静脉高压、黄疽、肝功能异常等症状,继续发展可能导致肝功能障碍[4]。肝纤维化是由多房棘球蚴持续刺激引发的保护性病理过程。早期肝纤维化可逆转,胶原蛋白可限制虫体的扩张及修复受损的肝组织。肝纤维化在中晚期开始恶化,达到不可逆的程度,进而发展为肝硬化和肝癌[5]。
肝是生物体内脂质生物合成和代谢的器官之一。肝包含多种细胞类型,包括肝实质细胞、肝星状细胞(hepatic stellate cell,HSC)、Kupffer细胞(KC)和肝内皮细胞等。目前,多房棘球蚴病肝损伤的发病机制主要集中于其免疫细胞和HSC的功能研究[6-8]。而肝实质细胞是肝最主要的细胞,约占肝细胞总数的60%,在肝行使代谢和合成功能过程中发挥着重要作用。肝损伤和病变往往会累及肝实质细胞的功能[9]。此外,肝实质细胞在肝纤维化的发展过程中也发挥着重要的作用[10-11]。脂代谢水平紊乱可导致肝脂肪变性、脂肪性肝炎甚至肝硬化[12]。大量研究表明,肝脂代谢与肝纤维化和炎症反应密切相关,且脂质代谢紊乱与HSC激活相关。肝组织内异常增加的脂质,特别是过氧化脂质、游离脂肪酸(free fatty acid,FFA)等可通过影响脂质代谢平衡和增强脂质过氧化反应促进肝纤维化[13-14]。多房棘球蚴感染会导致肝损伤和纤维化,可能影响到肝或肝实质细胞的脂质代谢。因此,本研究从组织和分子水平上分析了多房棘球蚴感染对小鼠肝脂质代谢的影响,为进一步揭示多房棘球蚴的致病机制奠定基础。
1 材料与方法
1.1 虫种与试验动物
多房棘球蚴采自本实验室饲养的保种宿主长爪沙鼠。60只6周龄的BALB/c雄性小鼠购自中国农业科学院兰州兽医研究所实验动物中心。本研究由中国农业科学院兰州兽医研究所动物伦理委员会批准(批准号:LVRIAEC-2018009),所有动物试验严格按照动物福利指南进行。
1.2 主要试剂
小鼠麻醉剂购自南京有晴生物科技有限公司;胶原酶Ⅳ、DNase购自Sigma公司;PBS缓冲液、胎牛血清(FBS)、DMEM/High Glucose培养基购自Gibco公司;RNA提取试剂盒、RevertAid First Strand cDNA合成试剂盒购自宝生物工程有限公司;实时定量PCR引物由上海生工生物技术有限公司合成。
1.3 多房棘球蚴原头蚴感染小鼠
颈椎脱臼处死腹腔接种过多房棘球蚴原头蚴的腹围明显增大的长爪沙鼠,将其固定在专用解剖台上,于超净工作台中剖解,无菌分离原头蚴。将60只清洁级BALB/c小鼠(6周龄,雄性)随机分为试验组和对照组,每组30只。试验组小鼠每只腹腔接种600个原头蚴,对照组小鼠腹腔注射等体积的PBS缓冲液。所有小鼠均在标准喂养条件下饲养,可自由获得水和食物。
1.4 肝病理表征观察
在感染2、3和6月时,各组随机选取3只小鼠,颈椎脱位处死,解剖小鼠并迅速剪取少许肝组织,投入4%多聚甲醛溶液中,4 ℃避光过夜固定。肝组织块经乙醇梯度脱水后石蜡包埋,常规制备冰冻切片。将切片浸入60%异丙醇中预处理后,置于油红O染液中浸染。60%异丙醇洗涤切片至背景基本无色,滴染苏木精,PBS洗涤3次,返蓝液返蓝后封片并观察。用Image pro plus软件计算油红染色面积。
1.5 肝实质细胞的分离
分别取感染多房棘球蚴2、3月的BALB/c小鼠各3只,腹腔注射50 μL麻醉剂,5~8 min后固定小鼠,用酒精棉球擦拭消毒,沿腹中线打开腹腔,经肝门静脉缓慢灌注预热的EGTA(乙二醇二乙醚二胺四乙酸)溶液(每只小鼠10 mL,5 mL·min-1)。待肝充盈后,剪断下腔静脉使灌注液流出。用预热的0.04%胶原酶IV原位灌注(每只小鼠30 mL,5 mL·min-1)后,小心取出肝,置于装有20 mL预冷DMEM的培养皿中漂洗。小心剥除胆囊、结缔组织等,将肝置于装有预冷0.08% 胶原酶Ⅳ溶液(含有1% DNA酶)的培养皿中,剪碎,37 ℃水浴消化30 min。消化后的肝组织通过70 μm的细胞过滤器过滤至50 mL的试管中。细胞悬液4 ℃,50×g离心4 min,弃上清,沉淀用PBS悬浮,50×g离心4 min后弃上清。重复操作上述步骤3次。将37 ℃预热的完全培养基(含10% FBS的高糖 DMEM)加入到已纯化的肝实质细胞沉淀中,重悬细胞,并调整细胞密度,每孔1×106个细胞接种于12孔培养板中,在显微镜下观察细胞的形态后,置于37 ℃的CO2培养箱中培养。
1.6 肝实质细胞RNA的提取
向装有肝实质细胞的1.5 mL无RNA酶的离心管中加入0.70 mL的TRIzol,室温静置5 min,待细胞完全裂解后,加入0.2 mL氯仿,震荡15 s,室温静置5 min。12 000×g离心15 min,分离上层水相,加入DNA酶(0.1 mg·mL-1)去除基因组DNA。加入异丙醇,混匀后置-20 ℃冰箱过夜沉淀。12 000×g离心15 min,弃上清。用75%乙醇洗涤沉淀,离心收集RNA,室温干燥5 min,用适量无RNA酶水溶解,Nanodrop2000测定RNA的浓度,1.5%甲醛变性琼脂糖电泳检测RNA的完整性。提取的RNA置-80 ℃保存。
1.7 肝实质细胞的转录组测序分析
将制备好的RNA样品送华大公司进行高通量测序。采用FPKM标准化方法计算mRNA的表达水平。以差异倍数FC>2且校正后的P值Padj<0.05为条件,筛选差异表达基因,并对其进行KEGG和GO分析。
1.8 脂质代谢相关基因的qPCR分析
合成Acox1、Pparγ、Fasn等脂质代谢相关基因的特异性引物(见表1),利用RevertAid First Strand cDNA合成试剂盒反转录后,qPCR分析与脂质代谢相关8个基因的相对表达量。qPCR反应体系如下:2 × All-in-one mix 10 μL,上、下游引物各2 μL,cDNA模板2 μL,ROX 0.1 μL,ddH2O 3.9 μL。qPCR反应条件如下:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火延伸1 min,40个循环。以Gapdh为内参基因,用2-ΔΔCt公式计算基因的相对表达水平。
1.9 数据的统计分析
应用GraphPad Prism 6.0分析数据,Student’st检验进行差异分析(*.P<0.05;**.P<0.01;***.P<0.001)。
2 结 果
2.1 原代肝实质细胞的形态特征
在显微镜下观察,刚分离的肝实质细胞呈圆形、透明,胞膜完整而清晰(图1A)。培养4 d后由贴壁前的圆形转变为多边形,出现脱落,死亡(图1B)。上述结果表明所分离到的肝实质细胞形态与其他文献报道的基本一致。
图1 肝实质细胞的形态(200×)Fig.1 Morphology of hepatocytes
2.2 肝实质细胞的转录组分析
从感染多房棘球蚴3月的肝实质细胞测序文库中筛选出1 111个上调表达基因和119个下调表达基因。KEGG分析表明,这些差异表达的基因主要富集于MAPK、PI3 K-Akt、Rap1、细胞因子-细胞因子受体相互作用,以及类固醇生物合成、磷脂酶D和脂肪细胞脂质分解等与脂质代谢相关的信号通路(图2)。GO富集分析表明,在生物过程(biological process, BP)层面,差异基因主要富集于MAPK级联的正向调节、ERK1和ERK2级联的正调节等与脂质代谢相关的过程;在细胞组分(cellular component, CC)层面,差异基因主要富集于细胞表面、胞膜及含胶原细胞外基质等组分;在分子功能(molecular function, MF)层面,差异基因也富集于花生四烯酸环氧酶活性、低密度脂蛋白颗粒结合等相关功能(图3)。

图中每一个圆点表示一个KEGG通路Each dot represents a KEGG pathway图2 差异表达基因KEGG通路富集散点图Fig.2 Scatter plot of KEGG pathway of differentially expressed genes
此外,脂质合成相关的基因Scd1、Fasn、Srebf1和Cd36均上调表达,而脂质分解相关的基因Acox1、Pparγ、Pparα和Cpt1a均呈下调表达(表2)。
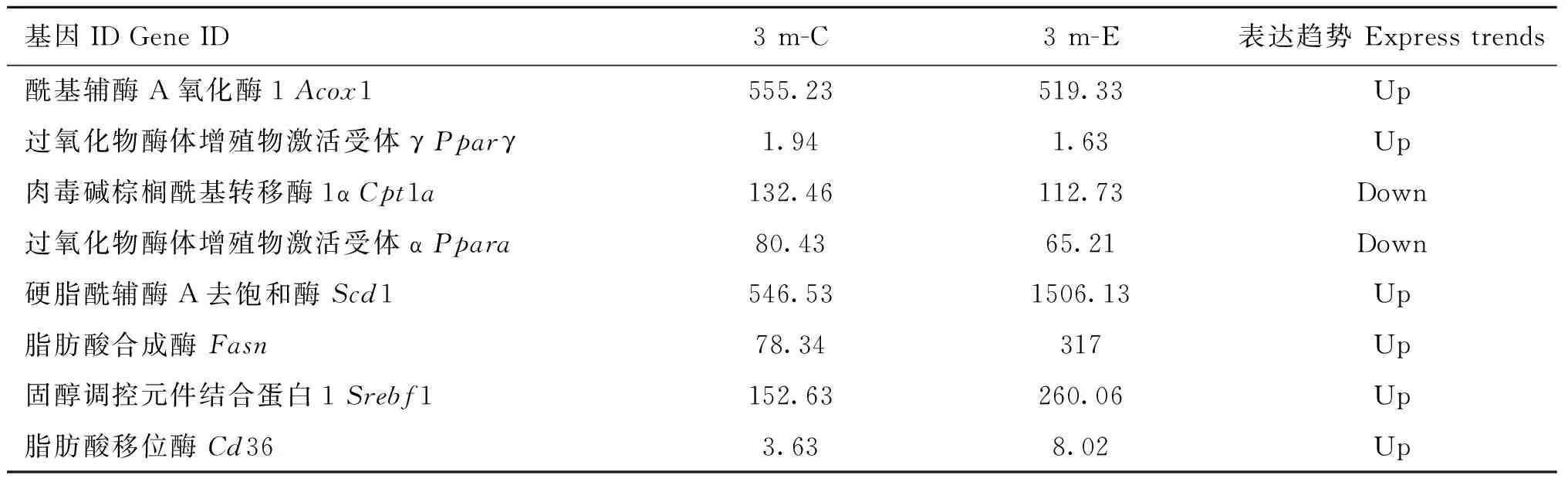
表2 肝实质细胞中脂质代谢相关基因的表达水平Table 2 Expression levels of lipid metabolism-related genes in hepatocytes
2.3 肝油红O染色
如图4所示,感染2月时,试验组(E)小鼠肝油红O染色点和面积较对照组(C)少;但在3月时,感染组小鼠肝细胞质及细胞间隙含有密集的油红O着色点,油红O染色面积由46 523 pixel2(平方像素)显著增加至158 326 pixel2,面积增加率达70%,且细胞质中充满脂质空泡;在6月时,感染组小鼠肝细胞质及细胞间隙较对照组小鼠油红O着色点更加密集,染色面积由86 592 pixel2显著增加至326 252 pixel2,面积增加近73%。说明多房棘球蚴感染可促进小鼠肝的脂质沉积。
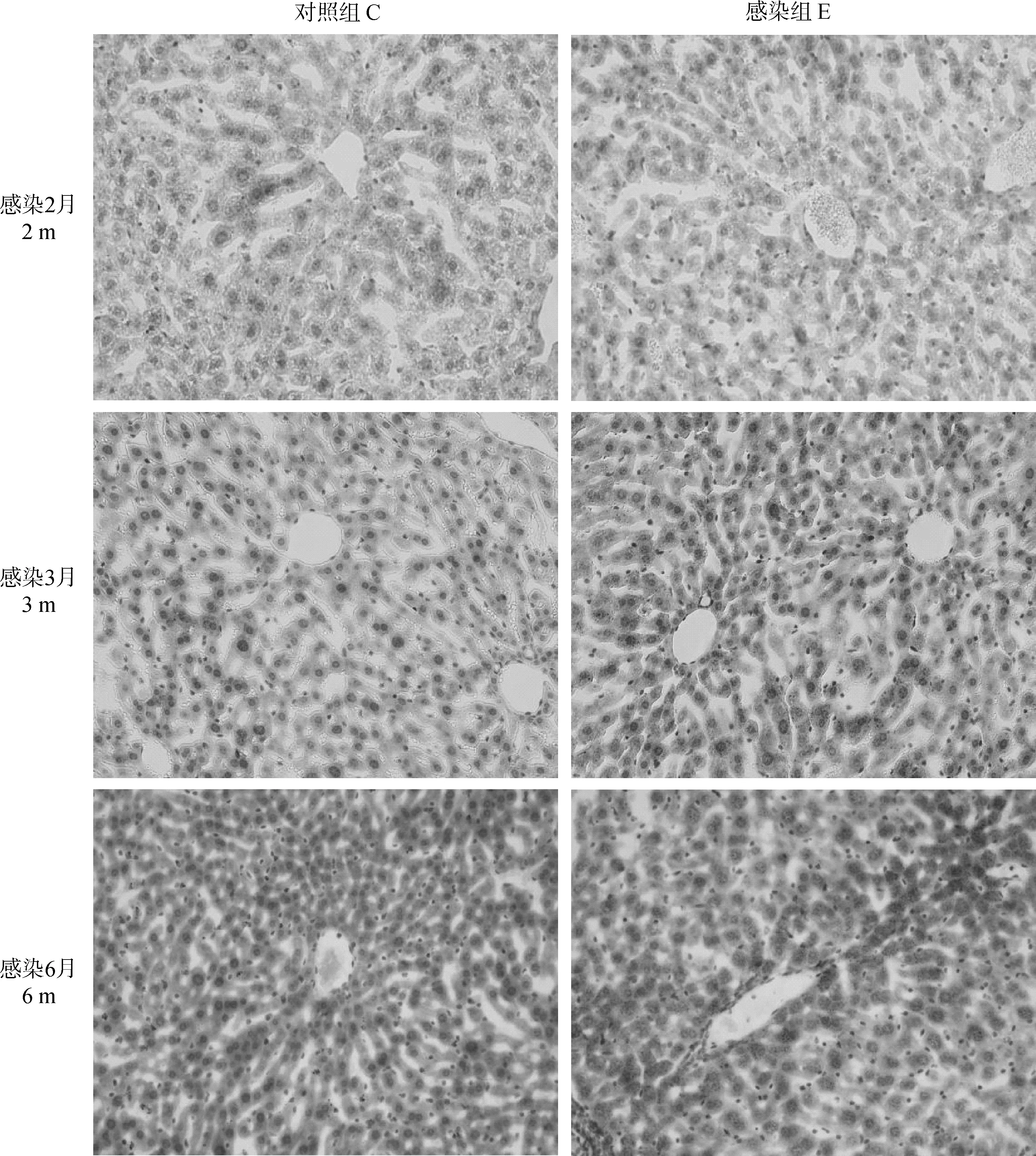
图4 多房棘球蚴感染小鼠肝油红O染色(200×)Fig.4 Oil red O staining of livers of E multilocularis infected mice
2.4 肝实质细胞脂质代谢相关基因的表达水平
与未感染对照组相比,多房棘球蚴感染小鼠2月时,Scd1、Fasn、Srebf1 mRNA水平明显上调(P<0.001,P<0.001,P<0.05),Cd36的水平明显降低(P<0.001),而Acox1和Cpt1a的mRNA水平明显上调(P<0.01,P<0.05),Pparγ和Pparα的mRNA水平无明显变化(图5);感染3月时,Scd1、Fasn、Srebf1和Cd36的表达水平均明显升高(P<0.001,P<0.001,P<0.001,P<0.05),而Acox1、Cpt1α、Pparγ和Pparα的表达水平明显降低(P<0.01,P<0.01,P<0.001,P<0.01)(图5)。
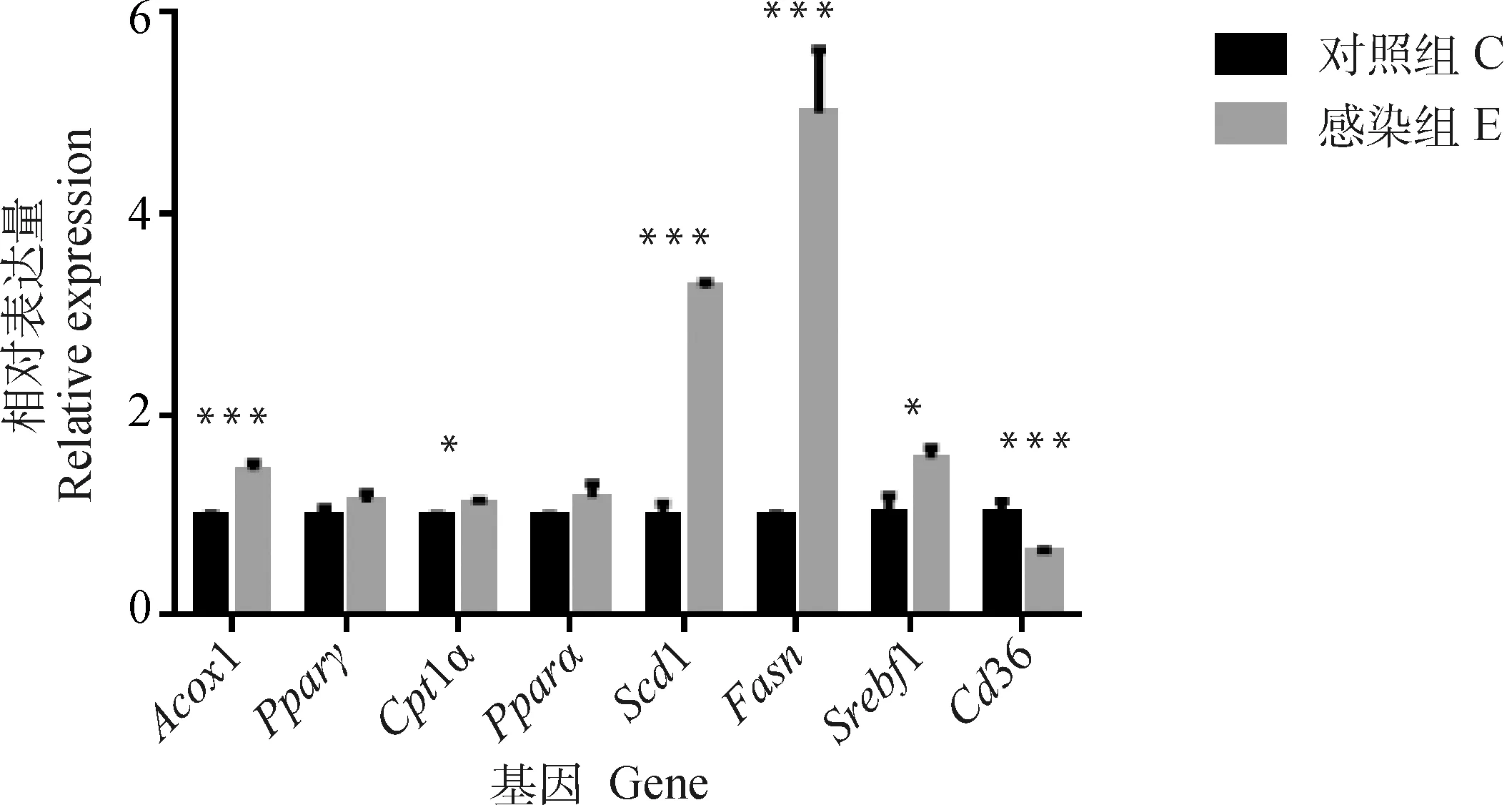
图5 多房棘球蚴感染2月小鼠肝实质细胞脂质代谢相关基因的表达水平Fig.5 Expression levels of lipid metabolism related genes in hepatic parenchyma cells of mice infected with E. multilocularis for 2 months
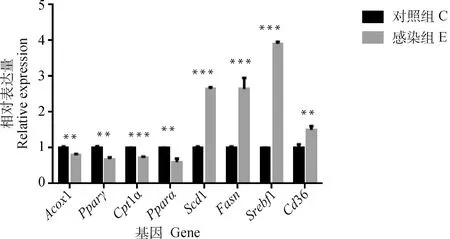
图6 多房棘球蚴感染3月小鼠肝实质细胞脂质代谢相关基因的表达水平Fig.6 Expression levels of lipid metabolism related genes in hepatic parenchyma cells of mice infected with E. multilocularis for 3 months
3 讨 论
肝脂代谢与肝纤维化和炎症反应密切相关,肝细胞是脂代谢发生的重要场所。但至今尚没有多房棘球蚴感染引起的宿主肝细胞脂质代谢功能改变的相关研究。为此,本研究初步探讨了多房棘球蚴感染后,肝和肝细胞脂质代谢变化情况。研究结果显示,多房棘球蚴感染时间越长,肝脂质沉积越明显。而肝的主要细胞——肝实质细胞,其脂质合成逐渐增多,而脂质分解氧化逐渐减少。因此,多房棘球蚴感染可促进肝细胞脂质合成能力,抑制脂质氧化分解能力,从而使肝的脂质发生沉积。上述研究结果将为从肝细胞代谢角度揭示多房棘球蚴致病机制奠定基础。
作为肝中最多的细胞,肝实质细胞不仅在维持肝正常生理功能中发挥重要作用,而且还参与肝纤维化的发生、发展。在非酒精性脂肪性肝病中,肝细胞中脂质过度积累,产生大量反应氧物质,激活PI-3k激酶等信号通路,TGFβ等信号分子的产生增加,进而导致肝星状细胞的活化和纤维化的发生[15-16]。另外,肝细胞中大量的脂质可作为生物活性物质,作用于Pparγ、TLR4、胰岛素和P53介导的信号通路,促进肝炎症和纤维化发展[17-18]。此外,大量的研究已经证明,多房棘球蚴感染会导致肝纤维化[8,19]。本研究表明,多房棘球蚴感染可以促进小鼠肝脂质沉积。多房棘球蚴感染是否可以通过促进肝实质细胞脂质沉积,进而导致肝纤维化,需要进一步的深入研究。
本研究证实多房棘球蚴感染可促进肝实质细胞的脂质合成,降低脂质氧化水平,从而导致肝脂质沉积。但多房棘球蚴感染能否引起宿主机体的脂肪沉积,尚需进一步研究。已有研究表明,细粒棘球蚴感染可导致羊肉的蛋白质、脂肪、钙和能量值大大降低,尤其是肌肉中的脂肪较健康羊下降了37%,并且单不饱和脂肪酸和多不饱和脂肪酸的水平显著降低[20]。Corbin等[21]采用核磁共振(NMR)技术研究了感染肥头绦虫(Taeniacrassiceps)对小鼠肝脂质谱的影响。感染小鼠肝的氯仿/甲醇提取物显示,与对照组相比,磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰肌醇、总甘油磷脂、三酰甘油、总脂肪酸(FA)和所有测定的FA成分的浓度较低。此外,用脂肪酸浓度除以总脂肪酸浓度得到的比值表明,感染引起的不饱和脂肪酸(FAs)浓度下降比其他脂肪酸要小。Lu等[22]的研究表明,与对照组相比,细粒棘球蚴感染小鼠的脂肪组织的质量减少,脂肪细胞变小。间接量热法揭示,细粒棘球蚴感染后小鼠的能量代谢发生了变化,其特征是CO2的产生和O2的消耗减少,碳水化合物氧化急剧下降,脂肪氧化略有增加。KEGG和GO分析表明,寄生虫的感染重构了一个复杂的代谢网络。脂氧合酶、精氨酸和脯氨酸代谢途径显著上调,而糖酵解、三羧酸循环、脂肪新生和脂滴形成途径显著下调,提示细粒棘球绦虫感染可促进肝的脂肪分解。上述结果虽然与本研究多房棘球蚴感染引起肝脂肪沉积的结论相矛盾,但究竟是细粒棘球蚴与多房棘球蚴对宿主脂肪代谢的影响差异,还是不同宿主、不同组织之间的差异,还需进一步研究。但可以确定的是,棘球蚴或绦虫蚴感染对宿主脂肪代谢确实产生了很大影响。基因组测序表明,绦虫缺乏从头合成脂肪酸和胆固醇的编码基因,而存在6个高水平表达的脂肪酸结合蛋白(fatty acid binding proteins,FABPs)。棘球蚴等绦虫蚴生长发育所需的脂类物质可通过其FABPs从宿主组织获取,从而可能影响到宿主的脂质代谢[23]。此外,由于多房棘球蚴感染可引起肝炎症反应和肝纤维化,使肝微环境发生巨大变化。所以,肝脂质沉积增多除与多房棘球蚴的直接作用有关外,还可能与肝微环境改变造成的间接影响有关。后续的研究将进一步探索肝实质细胞脂质沉积与多房棘球蚴感染引起的肝炎症反应及HSC活化之间的关系,从脂代谢角度深入探究多房棘球蚴的致病机制。
4 结 论
多房棘球蚴感染小鼠后3、6月肝脂肪沉积明显增多,且感染3月肝实质细胞脂质合成相关基因表达水平明显升高,而脂质氧化分解相关基因表达水平明显降低。多房棘球蚴感染早期可能通过促进肝实质细胞的脂质合成,抑制脂质氧化分解,从而导致肝脂质沉积。本研究结果为深入研究多房棘球蚴感染与肝脂肪代谢紊乱提供了有益线索。
