KRT16在长毛兔毛囊发育过程中的表达规律及功能探究
2023-02-03张希宇戴莹莹赵博昊吴信生
张希宇,翟 频,王 璠,戴莹莹,赵博昊,陈 阳,吴信生*
(1.扬州大学动物科学与技术学院,扬州 225009; 2.江苏省农业科学院畜牧研究所,南京 210014)
毛囊的形态发生和生长发育受到多种信号通路的共调控,并在多种细胞的调控下,经历生长期(anagen)、退行期(catagen)和休止期(telogen)[1]。在此过程中,角蛋白(keratin,KRT)在毛囊生长发育中扮演重要角色。角蛋白属于中间丝蛋白,是上皮细胞重要组成部分,对上皮细胞具有重要保护作用[2]。除了保护作用,角蛋白家族还参与调节细胞内多种信号传导途径及生物反应,如细胞生长、迁移、凋亡、增殖等[3]。其中,KRT17能够调节TNFα信号,从而影响毛囊生长周期[4];而KRT81、KRT83、KRT85、KRT86和KRT2-25的缺失导致SD大鼠出现无毛表型,这体现了角蛋白基因对毛发生长的重要性[5]。此外,KRT1和KRT4基因突变会引起皮毛颜色变化,表明角蛋白还能调节皮肤色素沉着[6-8]。
角蛋白16(keratin 16,KRT16)属于一大类酸性Ⅰ型角蛋白,已有研究表明,KRT16是皮肤的重要保护屏障,与一些皮肤疾病有着紧密联系[9]。如银屑病、先天性厚甲症和掌跖脚皮症。在银屑病的研究中,过表达KRT16后,角质形成细胞过度增殖,从而导致银屑病的发生[10]。另外,KRT16表达的沉默能够抑制VEGF分泌,而VEGF通过影响血液生成进而影响毛囊循环和生长[11]。本研究克隆得到兔KRT16基因的编码序列,对KRT16编码序列(CDS)的生物学特性初步进行生物信息学分析。在毛乳头细胞(dermal papilla cell,DPC)中过表达和敲低KRT16,探究KRT16对毛囊生长发育相关基因的调控作用,以及对DPC细胞增殖的影响。该研究有助于我们进一步了解KRT16在兔毛囊生长发育中的作用。
1 材料与方法
1.1 材料
1.1.1 试验动物 皖系长毛兔由安徽省农业科学院提供,共12只。饲养在相同环境下,给予充足的水和饲料。耳缘静脉注射Zoteil-50麻醉,采集毛囊不同时期的长毛兔背部皮肤,每组一式三份,对伤口进行碘伏消毒[12]。
1.1.2 试验试剂 Zoteil-50购自法国维克宠物保健公司;HiScript II Q Select RT SuperMix for qPCR、ChamQTM SYBR®qPCR、ClonExpress®II One Step Cloning Kit、HiScript III 1 st Strand cDNA Synthesis Kit (+gDNA wiper)和CCK-8 Cell Counting Kit购自南京诺维赞;Trizol试剂和无内毒素质粒大量提取试剂盒购于天根;限制性内切酶Hind III和EcoR I、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit胶回收试剂盒、DH5α感受态细胞购自TaKaRa;PBS购于HyClone;MSCM培养基购于Sciencell;LipofecctamineTM3000购自赛默飞。
1.2 长毛兔皮肤组织总RNA的提取与反转录
Trizol法提取兔皮肤组织总RNA,并用NanoDrop 2000检测RNA浓度和纯度,再经1%琼脂糖凝胶电泳检测其完整性。通过HiScript III 1 st Strand cDNA Synthesis Kit (+gDNA wiper)合成第一链cDNA。
1.3 引物设计
根据GenBank数据库提供的KRT16基因的CDS序列(XM_002719157.3),使用Primer 5.0设计扩增引物,同时设计实时荧光定量PCR(qRT-PCR)引物,并送至擎科生物公司进行合成(表1)。

表1 引物信息Table 1 Primers information
1.4 KRT16过表达载体和干扰载体构建
提取兔背部皮肤总RNA,进行长链第一链cDNA合成,根据NCBI数据库中编码序列(XM_002719157.3)设计KRT16 CDS引物,构建pcDNA3.1(+)过表达载体,引物序列如表1所示。pcDNA3.1载体经Hind III和EcoR I双酶切后,切胶回收,利用ClonExpress®II One Step Cloning Kit进行一步克隆试验,将连接产物转化至感受态细胞,培养过夜后挑选阳性克隆进行鉴定。小干扰RNA(small interference RNA, siRNA)和siRNA-NC购自上海吉玛制药有限公司,siRNA序列见表2。

表2 siRNA序列信息Table 2 Sequences of the siRNAs
1.5 细胞培养和转染
DPC在MSCM培养基中生长,并在37 ℃含有5% CO2细胞培养箱中培养。转染前,将DPC接种于24孔板中,待细胞的汇合度达80%时,使用LipofecctamineTM3000转染试剂转染,具体操作根据试剂盒说明书进行。
1.6 细胞增殖试验
细胞计数后,将定量的细胞接种于96孔板中,每孔总体积100 μL,培养24 h后,在每个测定时间向每孔中加入10 μL CCK8 Solution,避光孵育3 h,酶标仪检测450 nm处吸光值。
1.7 生物信息学分析
通过MegAlign软件(https://en.freedownloadmanager.org/Mac-OS/MegAlign.html)进行多序列比对[13];使用ExPASy在线软件(http://au.expasy.org/)预测KRT16的理化性质[14];使用SPOMA(https://npsa-prabi.ibcp.fr/)和SWISS-MODEL软件(http://www.swissmodel.expasy.org)预测蛋白质二级和三级结构[15]。使用UniProt在线软件(https://www.uniprot.org/)预测KRT16的亚细胞定位,并通过ProtoScale在线软件(http://expasy.org/tools/protscale.html)分析蛋白质疏水性[16-17]。使用NetPhos 3.1 (http://www.cbs.dtu.dk/services/NetPhos/)、NetOGlyc 4.0 (https://services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)和NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/)预测磷酸化位点和糖基化位点[12,18-19]。使用SignalP-4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)和TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质信号肽和跨膜区预测[19]。STRING数据库(https://string-db.org/cgi/input.pl)对蛋白进行交联分析[20];使用MEGA X软件进行进化树分析[21]。
1.8 实时荧光定量PCR(qRT-PCR)
收集转染后的DPC,用Trizol法提取总RNA,并通过HiScript II Q Select RT SuperMix for qPCR合成cDNA第一链,cDNA反转录产物用于qRT-PCR试验,使用ChamQTM SYBR®qPCR Master Mix配置PCR体系,由QuantStudio®5上机操作,引物序列见表1。
1.9 统计分析
使用Excel 2019整理数据,2-ΔΔCt法计算基因相对表达量。利用SPSS 25.0进行差异分析,P<0.05为差异显著,P<0.01为差异极显著,试验中至少设计3个生物学重复,结果使用“平均值±SD”表示。
2 结 果
2.1 KRT16的克隆和生物信息学分析
由试验结果可知,KRT16基因CDS为1 431 bp,共编码476个氨基酸,其分子式为C2207H3544N652O749S18,分子量为51.77 ku,理论等电位为5.08。不稳定系数为63.48,表明该蛋白为不稳定蛋白。利用ProtoScal在线软件对蛋白进行亲/疏水性分析,结果见图1A。由图1A可知,第93位的苯丙氨酸疏水性最强,第150位的谷氨酰胺亲水性最强,亲水系数均值为-0.545,说明KRT16为亲水蛋白。UniProt预测KRT16蛋白主要定位于细胞骨架。NetPhos 3.1 Server预测结果如图1B所示,KRT16蛋白存在69个磷酸化位点:52个丝氨酸(Ser),12个苏氨酸(Thr),5个酪氨酸(Tyr)。NetOGlyc 4.0预测KRT16蛋白 O-糖基化位点有21个。NetNGlyc 1.0 Server预测KRT16蛋白不存在 N-糖基化位点(图1C)。SignalP 4.0和TMHMM 2.0预测,KRT16蛋白不包含跨膜区(图1D)和信号肽(图1E)。

A. KRT16蛋白的亲水性预测;B. KRT16蛋白的磷酸化位点预测; C. KRT16蛋白的N-糖基化位点预测; D. KRT16蛋白的跨膜结构域预测;E.KRT16蛋白的信号肽预测A. Prediction of hydrophilicity of KRT16 protein; B. Prediction of phosphorylation sites of KRT16 protein; C. Prediction of N-glycosylation sites of KRT16 protein; D. Transmembrane domain prediction of KRT16 protein; E. Signal peptide prediction of KRT16 protein图1 KRT16蛋白的生物信息学分析Fig.1 Bioinformatics analysis of KRT16 protein
2.2 KRT16蛋白的结构预测
KRT16的二级结构预测表明,α-螺旋占61.76%,延伸链占7.77%,β转角占3.15%,无规则卷曲占27.31%(图2A)。KRT16三级结构预测为一条螺旋链(图2B)。KRT16蛋白的交联作用利用STRING数据库进行分析(图2C),结果表明KRT16与KRT1、KRT5、KRT17、DSG1蛋白等存在互作关系。

A. KRT16蛋白的二级结构预测;B. KRT16蛋白的三级结构预测;C. KRT16及其相关蛋白的相互作用网络A. Secondary structure prediction of the KRT16 protein; B. Tertiary structure prediction of KRT16 protein; C. Interaction network of KRT16 and its related proteins图2 KRT16蛋白的结构预测及互作蛋白Fig.2 KRT16 structural prediction and PPI network
2.3 KRT16基因系统发育树分析
利用MEGA X软件,将家兔KRT16基因序列与中国仓鼠(Cricetulusgriseus)、小鼠(Musmusculus)、河狸(Castorcanadensis)、北美鼠兔(Ochotonaprinceps)、人(Homosapiens)、家猫(Feliscatus)、狗(Canislupusfamiliaris)及水牛(Bubalusbubalis)的KRT16基因序列进行系统发育树的构建(图3)。结果显示,兔和北美鼠兔形成一个分支,同源性达到76%。

图3 不同物种间KRT16基因的系统进化树Fig.3 Phylogenetic tree of KRT16 and other homologous sequences
2.4 KRT16在不同毛囊发育周期的表达分析
qRT-PCR结果显示(图4),KRT16在毛囊周期同期化后的生长期表达量最高,显著高于退行期(P<0.05),极显著高于休止期(P<0.01),由此说明KRT16在毛囊生长期高表达。KRT16的表达水平随时间变化而变化,提示其参与毛囊周期性发育。

*.表示差异显著(P<0.05),**.表示差异极显著(P<0.01),下同*.indicates the significant difference (P<0.05), **. indicates the extremely significant difference (P<0.01),the same as below图4 KRT16在长毛兔不同毛囊发育周期中的表达量变化Fig.4 The expression level of KRT16 mRNA during the hair follicle cycle and skin development in Angora rabbits
2.5 KRT16对毛囊发育相关基因表达的影响
将pcDNA3.1-KRT16过表达载体和siRNA-KRT16转染至DPC中,qRT-PCR结果表明pcDNA3.1-KRT16能够极显著上调KRT16基因的表达量(P<0.01,图5A),siRNA-KRT16能够极显著下调KRT16基因的表达量(P<0.01,图5C),提示过表达载体和siRNA转染成功。同时发现(图5B、5D),过表达KRT16后,SFRP2和TGFβ1基因的mRNA表达量极显著下降(P<0.01),BCL2、CCND1、EGF、LEF1和CTNNB1基因的mRNA表达量极显著提高(P<0.01);而敲减KRT16后,SFRP2和TGFβ1基因的表达量极显著提高(P<0.01),BCL2、CCND1、EGF、LEF1和CTNNB1基因的表达量极显著下降(P<0.01)。由此可知,KRT16基因能够调控毛囊生长发育相关基因表达。
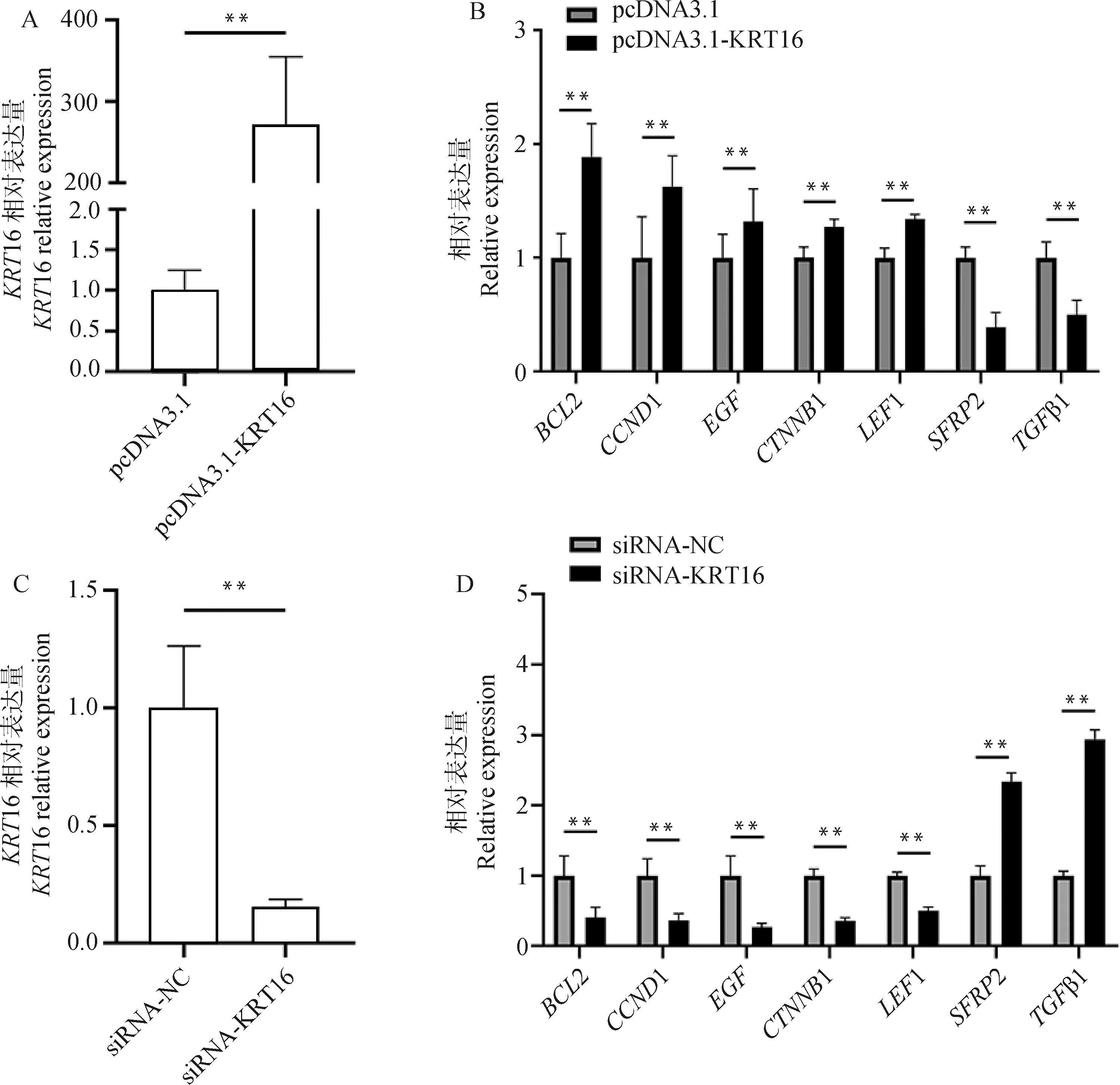
A. pcDNA3.1-KRT16极显著上调DPC中KRT16 mRNA表达水平;B. pcDNA3.1-KRT16对毛囊发育相关基因的影响;C. siRNA-KRT16极显著下调DPC中KRT16 mRNA表达水平;D siRNA-KRT16对毛囊发育相关基因的影响A. pcDNA3.1-KRT16 significantly increased the expression of the KRT16 mRNA level in DPC; B. Effects of pcDNA3.1-KRT16 on the expression levels of hair follicle development related genes; C. siRNA-KRT16 significantly reduced the expression of the KRT16 mRNA level in DPC; D. Effects of siRNA-KRT16 on the expression levels of hair follicle development related genes图5 KRT16对毛囊发育相关基因表达的影响Fig.5 Effects of KRT16 on the expression levels of hair follicle development related genes
2.6 KRT16促进DPC增殖
DPC中过表达和敲减KRT16,通过CCK8法检测细胞增殖情况。结果表明,在细胞处理后的0和24 h,细胞增殖无明显差异。转染48 h后,与对照组相比,过表达KRT16极显著促进DPC增殖(P<0.01),而敲低KRT16显著抑制DPC的增殖(P<0.05)(图6)。

A. pcDNA3.1-KRT16对DPC细胞增殖的影响;B. siRNA-KRT16对DPC细胞增殖的影响A. Effects of pcDNA3.1-KRT16 on DPC proliferation; B. Effects of siRNA-KRT16 on DPC proliferation图6 KRT16对DPC增殖的影响Fig.6 Effects of KRT16 on DPC proliferation
3 讨 论
角蛋白作为上皮细胞骨架的主要成分,最初仅被认为参与维持细胞的结构,而随着对角蛋白研究的深入,越来越多的研究表明角蛋白参与细胞增殖、迁移、凋亡等多种生命活动[22]。KRT16在疾病中的研究较为广泛,与银屑病、先天性厚甲症和掌跖角化症有着密切联系[23-24]。已有研究表明,KRT16受到miR-31的靶向调控,调节皮肤和毛囊基因的表达与毛囊周期变化[25];EGF可以通过转录因子Sp1和c-Jun诱导KRT16表达,而EGF可以促进DPC增殖,并通过调控细胞信号途径改变细胞周期,进而影响毛发的生长[26];Hox13与KRT16互相作用,有研究表明Hoxc13通过调节角蛋白分化影响毛囊生长[27]。
本研究中,KRT16的表达量在生长期最高,由此说明KRT16在生长期处于高表达水平。获取完整的兔KRT16 CDS后,对其进行生物信息学分析显示,KRT16 CDS包含一个1 431 bp的ORF,编码476个氨基酸。KRT16是一种亲水蛋白,主要存在于细胞骨架中,且由α螺旋结构构成。通过预测发现,KRT16蛋白磷酸化和糖基化位点丰富,说明KRT16可能参与细胞增殖,细胞凋亡,化学信号传导等重要过程。此外,系统发育树分析表明,兔KRT16在进化树上最接近于北美鼠兔。另外,KRT16与KRT17、KRT1和KRT5等蛋白存在互作关系。已有研究表明,KRT1和KRT5在毛囊生长期表达量最高,可能促进毛囊生长发育[28]。KRT17同样对毛囊生长有着重要作用,在小鼠中敲除KRT17出现脱毛现象[29]。在本研究中,过表达KRT16能够显著上调BCL2、CCND1、CTNNB1、LEF1、和EGF表达,敲减KRT16能够显著下调它们表达;过表达KRT16显著下调TGFβ1和SFRP2表达,敲减KRT16显著上调它们的表达。其中,SFRP2作为Wnt调节剂,在毛囊发育中有着重要作用,并且可以通过抑制Wnt活性来抑制角质形成细胞的增殖[30]。TGFβ1是一种多功能因子,对大多数细胞的生长起到抑制作用,并且已有研究发现TGFβ1在毛囊退行期高表达[31-32]。Wnt/CTNNB1信号通路是经典的信号通路,主要参与毛囊生长调节,CTNNB1还是细胞膜标志蛋白质,可以调节细胞生长和细胞间黏附[33]。LEF1被认为是毛囊正常发育以及促进毛母质细胞分化所必需的转录因子[33-34]。EGF因子大量分布在表皮、真皮与表皮结合处,是一种外源性调节因子,具有调控毛囊生长的作用,促进上皮细胞繁殖,并且有研究表明EGF可以诱导KRT16表达[34-35]。CCND1是细胞周期调节因子,同时也是抑凋亡基因,对细胞增殖起到促进作用。BCL2也同样是抑凋亡基因,有研究表明BCL2能够在毛囊各个时期皆有表达,并能调节毛囊细胞的凋亡[36-40]。KRT16能够上调CCND1与BCL2的表达,提示KRT16能够促进细胞增殖。另外,KRT16的敲低能够降低肺腺癌癌胞的体外迁移、侵袭和增殖能力,并能降低角质形成细胞的存活率[41]。本研究中,KRT16能够促进DPC增殖,说明KRT16能够调控DPC的细胞活动,从而影响毛囊周期性再生。
4 结 论
本试验成功克隆得到了兔KRT16基因,KRT16基因的编码序列全长1 431 bp,可编码476个氨基酸,预测KRT16蛋白为亲水蛋白,存在69个磷酸位点和21个O-糖基化位点。在毛囊发育周期中,KRT16在毛囊生长期高表达,并能调控毛囊生长发育相关基因,促进毛乳头细胞增殖。本研究通过对KRT16基因功能的初步研究,为毛囊发育的基础研究提供参考,同时为长毛兔毛囊发育相关基因的功能研究提供依据。
