牦牛FHL2基因的克隆、组织表达与蛋白定位分析
2023-02-03龚三你蒋旭东卢建远字向东
龚三你,蒋旭东,马 瑶,卢建远,字向东
(西南民族大学 动物科学国家民委重点试验室,成都 610041)
四个半LIM结构域蛋白(four and a half LIM domains protein, FHL)家族包含5个成员:FHL1、FHL2、FHL3、FHL4和ACT[1],它们均含有4个半 LIM结构域,不同的结构域间有24%~39%的氨基酸序列相似性,但组织表达有特异性[2-3]。FHL2是其家族研究最广泛的基因,它除了在心上高表达外,在很多组织中都有表达[3]。FHL2由279个氨基酸残基组成,是一种完全由 LIM 结构域组成的蛋白质[2],因为其完全单一的LIM 结构域特性,目前已经发现其参与90多种不同的蛋白相互作用过程,这些蛋白参与不同的信号通路从而参与多种生理功能的调控[4]。FHL2有很多的生物学功能,参与细胞的增殖、凋亡和转化过程[5-6]。小鼠缺失FHL2会导致皮肤、肠、血管、心或缺血性肌肉组织的伤口愈合受损[7-11];FHL2的表达水平与多种肿瘤、肝癌和肺癌有密切的联系[12];非小细胞肺癌中FHL2的高水平表达会增加肿瘤的体积和重量[13];FHL2在骨肉瘤细胞中充当癌基因,并通过 Wnt 信号传导促进肿瘤发生[14]。还有研究发现,FHL2对哺乳动物繁殖有重要影响,有研究者敲除小鼠的FHL2基因,结果发现,敲除型雌鼠卵巢发育滞后,闭锁卵泡数显著增加,且敲除型雌鼠的5个月总产仔数显著低于野生型雌鼠,降低了约43%,窝产仔数约降低22%[15]。在绵羊上的研究发现,FHL2在卵巢中高表达,定位于卵巢颗粒细胞,影响颗粒细胞增殖、凋亡、周期和类固醇激素(雌二醇和孕酮)的分泌及相关基因的表达,可能在绵羊繁殖调控中发挥重要作用[16]。
牦牛(Bosgrunniens)是分布于我国海拔2 500~5 500 m青藏高原及其毗邻国家和地区的重要畜种,在这样高海拔低氧条件下很少有其它畜种能够生产生活。牦牛具有密而长的被毛、汗腺导管少、小肠发达、胸腔大(比普通牛多1~2对肋骨)、毛细血管网发达和肺泡数量多等特征,可以适应寒冷、低氧等恶劣的高原环境条件[17],是青藏高原畜牧业生产中不可替代的重要畜种,对青藏高原经济社会发展具有重要的意义,但其繁殖率低,产肉、乳性能低[18]。在其它物种的研究表明,FHL2具有广泛的生物功能,其与动物的心功能和繁殖能力也密切相关[11-13,15-16],但目前未见有关牦牛FHL2基因的研究报道。
本研究拟采用逆转录PCR(RT-PCR)技术克隆牦牛FHL2基因的CDS区,并利用生物信息学分析和预测所编码蛋白质的结构及功能,利用实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)、免疫组化(immunohistochemistry, IHC) 和免疫荧光(immunofluorescence, IF)技术检测FHL2基因在不同组织的表达特性和雌性生殖器官中的定位以及在颗粒细胞的亚细胞定位,为进一步探讨FHL2基因在牦牛低氧生态适应和繁殖活动中的调控作用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 在四川省成都市青白江唐家寺屠宰场选择无临床病理表现的成年母牦牛,根据屠宰后子宫内有无胎儿判断妊娠与否。空怀:子宫内无胎儿;妊娠2个月左右:子宫内有头颈、躯干及四肢可以清楚辨识的胎儿[19]。采集5头空怀母牦牛的心、肝、脾、肺、肾、卵巢、子宫、输卵管组织和5头妊娠2个月左右的牦牛子宫、输卵管和卵巢组织。采集的组织用生理盐水冲洗干净,迅速放入液氮罐中,带回试验室-80 ℃保存,用于PCR和RT-qPCR检测。颗粒细胞由实验室前期冷冻保存。同时采集牦牛卵巢、子宫、输卵管组织样,用4%多聚甲醛进行固定,待固定完成后用于免疫组化试验。
1.1.2 主要试剂 RTIzol Reagent和琼脂糖(美国Invitrogen), cDNA反转录试剂盒、DNA Marker(GenStAR),PowerUp SYBR Green预混液(美国Thermo Scientific),胶回收试剂盒(成都擎科梓熙生物),FHL2抗体(DF13015, Affinity Biosciences),RBITC二抗(上海生工生物)。
1.1.3 主要仪器 凝胶成像系统(美国Invitrogen),PCR仪(ETC811,苏州东盛兴业),荧光定量PCR仪(CFX96, 美国Bio Rad),激光共聚焦显微镜(LSM880, 德国ZISS)。
1.2 方法
1.2.1 总RNA的提取和cDNA合成 根据RTIzol RNA提取试剂盒的说明书提取RNA,利用紫外分光光度计检测RNA(OD260 nm/OD280 nm)的浓度和纯度,1.5%的琼脂糖凝胶电泳检测RNA完整性。根据反转录试剂盒说明书合成的cDNA于-20 ℃保存备用。
1.2.2 引物的设计及合成 由于未见牦牛FHL2基因序列报道,所以根据NCBI中普通牛(Bostaurus)的FHL2基因序列(NM_001046046.2),使用PrimerPrimer 5.0软件设计克隆引物;再根据克隆获得的序列设计FHL2基因的荧光定量PCR引物(表1),荧光定量内参基因DAPDH引物参照刘宇等[20]设计的引物。引物由成都擎科生物公司合成。
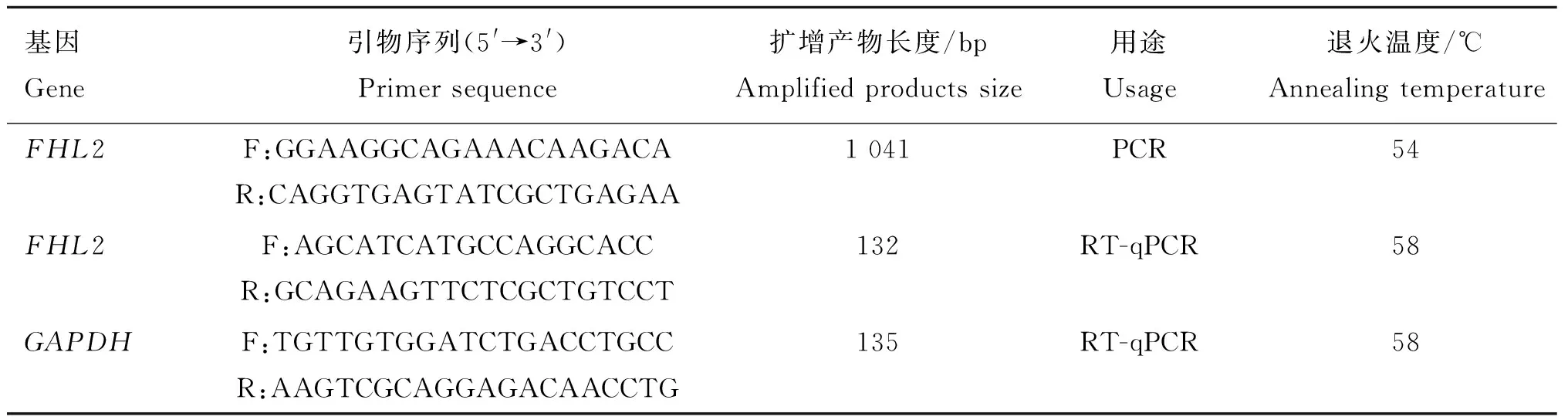
表1 基因克隆与定量PCR引物Table 1 Primer pairs for gene cloning and RT-qPCR
1.2.3 牦牛FHL2基因克隆与测序 以牦牛卵巢合成的cDNA为模板,根据刘宇等[20]的方法克隆FHL2基因,但是本研究采用的退火温度为54 ℃,循环数为30个,PCR产物用1.5%琼脂糖凝胶电泳检测。
1.2.4 牦牛FHL2基因生物信息学分析 使用ORF Finder、BLAST、ExPASy ProtParam、Signal P 5.0、PSIPRED、SWISS-MODEL、TMHMM、NetPhos3.1 Server、STRING和MEGA11.0等在线生物信息学软件[20]分析牦牛FHL2基因及其编码蛋白质特性。
1.2.5 牦牛FHL2基因的RT-qPCR 采用RT-qPCR技术测定FHL2基因在母牦牛各组织中的mRNA表达水平。PCR体系为15 μL:cDNA 1.0 μL,上、下游引物各1.0 μL,PowerUp SYBR Green预混液 7.5 μL,ddH2O 4.5 μL。反应条件为:95 ℃预变性2 min,95 ℃变性15 s,58 ℃退火15 s,40个循环;读取熔解曲线。
1.2.6 免疫组化分析 参照邬建飞等[21]的免疫组化方法进行牦牛卵巢、输卵管和子宫组织的FHL2蛋白定位分析,最后采用共聚焦显微镜采集图片。
1.2.7 细胞免疫荧光染色 培养48 h的牦牛原代颗粒细胞(融合率为80%),取出细胞爬片,4%多聚甲醛固定细胞, PBS轻洗3次,每次5 min;然后用0.5% TritonX-100透化处理细胞20 min;随后以5% BSA封闭30 min;在爬片上滴加一抗(1∶250稀释),4 ℃过夜孵育;二抗(1∶1 000稀释)避光孵育2 h;最后用DAPI (1∶1 000 PBS稀释)染核,室温避光15 min;清洗后封片,共聚焦显微镜采集荧光图片。
1.2.8 统计分析 每个样品重复检测3次,以GAPDH为内参基因,采用2-ΔΔCt法计算FHL2基因的相对表达量。使用SPSS26.0软件对空怀母牦牛不同组织中FHL2基因表达量进行单因子方差分析。采用t检验对空怀期与妊娠期的基因表达差异进行显著性分析。
2 结 果
2.1 牦牛FHL2基因克隆
以牦牛卵巢cDNA为模板,经PCR扩增后获得的产物片段与目的基因大小相符(图1),表明成功扩增了牦牛FHL2基因。测序表明,FHL2基因全长1 041 bp,其中CDS区长840 bp,共编码279个氨基酸。NCBI的基因序列登录号为ON456866。

M. DNA相对分子质量标准;1~2. FHL2引物PCR扩增产物M. DL2000 DNA marker;1-2. PCR amplification products of FHL2 primer图1 牦牛FHL2基因PCR产物的电泳结果Fig.1 Electrophoresis results of yak FHL2 PCR products
2.2 牦牛与黄牛FHL2基因的核苷酸序列比较
使用DNAMAN6.0软件将所扩增FHL2基因的CDS区与黄牛FHL2基因的CDS区进行比较,发现了2个碱基突变,其中第98位点碱基差异(G>C)导致了氨基酸的改变(E>D),但第641位点碱基差异(C>T)没有导致氨基酸的改变。牦牛与黄牛FHL2基因的CDS区同源性为99.76%。
2.3 FHL2基因编码氨基酸序列的同源性
使用DNAMAN6.0软件分析不同物种FHL2基因编码氨基酸序列的同源性,结果显示,牦牛与黄牛(NP_001039511.1)、绵羊(XP_004006164.1)、猪(XP_013851352.2)、马(XP_005599839.1)、人(NP_001305824.1)、鼠(NP_034342.1)和倭蛙(XP_018418626.1)的氨基酸序列相似性分别为99.64%、98.57%、94.27%、93.55%、90.32%、88.17%和79.57%,说明FHL2基因在进化过程中的保守性较高(图2)。
2.4 牦牛FHL2蛋白的理化性质
使用ExPASY-ProtParam在线工具分析牦牛FHL2蛋白,发现FHL2蛋白的分子式为C1386H2118N390O414S38,分子质量为32 086.71,FHL2蛋白是弱碱性蛋白,理论等电点为7.59;FHL2蛋白的氨基酸组成中半胱氨酸(Cys)、赖氨酸(Lys)和谷氨酸(Glu)的所占比例较高,分别为12.5%、7.9%和7.2%;FHL2蛋白属于亲水不稳定蛋白,其脂肪族指数为50.36;平均亲水性为-0.509,不稳定指数为50.99。FHL2蛋白带正电荷,其带负电荷(Asp+Glu)和带正电荷(Arg+Lys)的氨基酸残基总数分别为37和39个。根据TMHMM 2.0在线工具分析,FHL2蛋白没有跨膜结构;使用Signal P 5.0预测,FHL2蛋白不存在信号肽。使用NetPhos3.1在线工具分析显示FHL2蛋白有33个磷酸化位点,其中丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)磷酸化位点分别有16、10和7个。
2.5 FHL2蛋白二、三级结构预测
使用SOPMA在线工具预测FHL2蛋白的二级结构,结果显示无规则卷曲、α-螺旋、延伸链和β-转角占比分别为55.91%、20.07%、19.35%和 4.66% (图3)。使用SWISS-MODEL在线工具预测的FHL2蛋白三级结构与二级结构预测结果一致(图4)。

c. 无规则卷曲;h. α-螺旋;t. β-转角;e. 延伸链c. Random coil; h. α-helix; t. β-turn; e. Extension chain图3 牦牛FHL2蛋白二级结构预测Fig.3 The predicted secondary structure of yak FHL2 protein
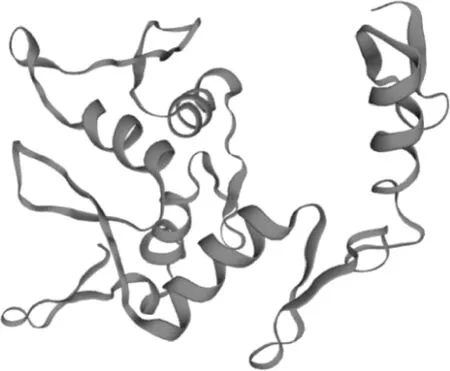
图4 牦牛FHL2蛋白三级结构预测Fig.4 The predicted tertiary structure of yak FHL2 protein
2.6 蛋白相互作用分析
使用STRING11.0在线工具对牦牛FHL2蛋白进行网络互作分析,结果显示,FHL2蛋白与雌激素受体基因1(ESR1)、雄激素受体(AR)、叉头转录因子1(FOXO1)、乳腺癌易感基因1(BRCA1)、肿瘤坏死因子受体相关因子2(TRAF2)、S100钙结合蛋白A10(S100A10)和小窝相关蛋白1(CAVIN1)等蛋白互作紧密 (图5)。

图5 FHL2蛋白网络互作分析图Fig.5 FHL2 protein interaction networks
2.7 牦牛FHL2基因系统进化树分析
从NCBI下载黄牛(NM_001046046.2)、绵羊(XM_004006115.4)、山羊(XM_018054971.1)、小鼠(NM_001289533.1)、大鼠(NM_031677.1)、兔(XM002709708.3)、马(XM_005599782.3)、鲫鱼(XM_027743867.2)、原鸡(XM_040657379.1)、线虫(XM_034758044.1)和猪(XM_013995898.2)11个物种的FHL2基因序列,利用Mega11.0构建基因进化树。结果表明,牦牛与黄牛的亲缘关系最近,其次是与山羊和绵羊,与原鸡的亲缘关系最远,说明该基因在动物进化过程中比较保守(图6)。

图6 用NJ法构建的FHL2基因系统进化树Fig.6 Phylogenetic tree of FHL2 gene constructed by NJ method
2.8 牦牛FHL2基因表达差异分析
2.8.1FHL2基因组织表达分析 RT-qPCR检测结果显示,FHL2基因在牦牛心、肝、脾、肺、肾、卵巢、子宫和输卵管中均有表达(图7),其在心中的表达量最高,极显著高于其他组织(P<0.01);肺、卵巢、输卵管和子宫中的表达量极显著高于肝、脾和肾(P<0.01)。
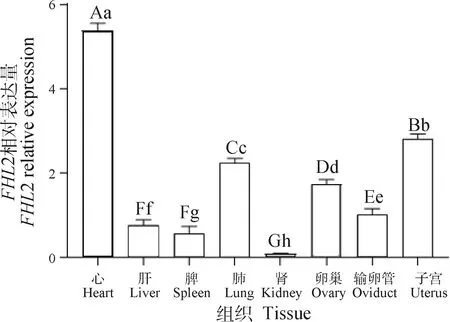
柱上大写字母不同表示差异极显著(P<0.01),小写字母不同表示差异显著(P<0.05),下同Columns with different capital letters denote difference at P<0.01, with different lowercase letters denote difference at P<0.05. The same as below图7 空怀母牦牛不同组织中FHL2基因的相对表达水平Fig.7 Expression levels of FHL2 gene in different tissues of non-pregnant female yak
2.8.2 空怀期与妊娠期牦牛生殖器官中FHL2基因的表达分析 以空怀期生殖器官的表达量为参照,检测FHL2基因mRNA在牦牛空怀期与妊娠期卵巢、子宫和输卵管组织的表达情况,发现FHL2基因在空怀期卵巢中的表达量极显著高于妊娠期(P<0.01)(图8A),妊娠期子宫中的表达量极显著高于空怀期(P<0.01)(图8B),空怀期和妊娠期输卵管中的表达量差异不显著(P>0.05)(图8C)。

A.卵巢;B.子宫;C.输卵管A. Ovary; B. Uterus; C. Oviduct图8 牦牛生殖器官中FHL2基因的相对表达水平Fig.8 Relative expression level of FHL2 gene in reproductive organs of yaks
2.9 母牦牛FHL2蛋白在生殖器官及颗粒细胞的定位
IF结果显示,FHL2蛋白在细胞质和细胞核均有表达(图9),且主要存在于细胞核并从细胞核向细胞质弥散。IHC结果显示,FHL2蛋白在牦牛的卵巢、输卵管、子宫均有分布。在卵巢中主要表达于卵泡颗粒细胞,在输卵管上主要表达于黏膜上皮细胞,在子宫中主要表达部位为子宫腺和子宫内膜细胞(图10)。

图9 FHL2 在牦牛卵巢颗粒细胞中的亚细胞定位Fig.9 The subcellular localization of FHL2 in yak ovarian granulosa cells
3 讨 论
FHL2蛋白是4个半LIM结构域蛋白家族中的一个成员,它不直接调节基因表达, 而是通过与转录因子及其上游共调节因子相互作用来调节基因表达[2]。通过与其靶蛋白结合,FHL2蛋白调节或微调信号转导途径和随后的基因调控,这对各种组织的功能及其病理很重要,特别是在繁殖相关性状中具有重要的调控作用[15-16,22]。为了探究牦牛FHL2基因、蛋白及其表达特性,本试验克隆获得了牦牛FHL2基因完整的CDS区全长840 bp,编码279个氨基酸,共有33个磷酸化位点。近期的研究发现,c-Abl 激酶通过 FHL2 蛋白磷酸化来调节细胞增殖[23]。牦牛FHL2蛋白定位在颗粒细胞的细胞核和细胞质上,这与在小鼠和绵羊上的研究结果一致[22,24]。牦牛FHL2蛋白氨基酸同源性比对和基因进化树结果显示,FHL2基因与黄牛的同源性最高,相似度为99.64%,在进化树上牦牛与黄牛最先聚为一类,其次与偶蹄目的绵羊和山羊聚为一类,与禽类的关系最远。Zhang等[24]的研究也发现,FHL2基因与有蹄动物的同源性最高,与家禽的同源性较低,与本研究结果一致,说明FHL2基因在进化过程中比较保守。本试验发现,牦牛FHL2基因的CDS区与黄牛的CDS区相比有两个碱基发生突变,且第98位点碱基的改变导致谷氨酸突变为天冬氨酸,这种突变是否影响FHL2蛋白的功能尚待研究。
根据蛋白互作网络图显示,FHL2蛋白可能与AR、FOXO1、BRCA1、ESR1、HMCN1、CAVIN1、S100A102和TRAF2等蛋白相互作用。FHL2蛋白是 BRCA1的转录共激活因子,Rajan等[25]研究阐明,BRCA1可与雌激素受体 (ER) 结合,抑制雌激素受体(ER-α)的信号传导,并阻断ER-α的转录激活功能。Zhang等[26]的研究表明,BRCA1可与雄激素受体(AR)结合,并通过激活SIRT1来抑制AR表达。雄激素通过AR在雌性的生殖系统中起着重要的作用[27],且FHL2过表达抑制排卵相关基因,部分是通过FHL2作为AR的共阻遏物调节KGN细胞中C/EBPβ的表达实现[28]。FHL2是FOXO1转录的共抑制子,FOXO1是氧化应激诱导颗粒细胞凋亡关键性的调控因子,FOXO1在卵泡颗粒细胞中的表达会诱导下游与细胞凋亡相关基因的表达,导致颗粒细胞的凋亡与卵泡的闭锁[29-30];还有研究发现,FOXO1与子宫内膜蜕膜化、胚胎植入与胚胎发育都有紧密的联系[31]。有研究表明, FHL2通过诱导FOXO1与组蛋白去乙酰酶SIRT1相互作用,使FOXO1蛋白去乙酰化,从而抑制FOXO1蛋白的转录活性[29]。蛋白互作结果表明,FHL2蛋白可通过互作蛋白参与卵巢排卵、颗粒细胞的增殖、子宫内膜蜕膜化、胚胎植入和胚胎发育的调控,推测FHL2与雌性动物的繁殖性能有重要联系。
RT-qPCR的结果显示,FHL2基因在牦牛的各个组织中广泛表达,这与在小鼠[15,22]、绵羊[16]、鸡[32]和人[33]上的研究结果一致,说明FHL2基因具有广泛的生物学功能。本研究发现,FHL2基因在心组织的表达量极高,与前人[16]在绵羊上的研究结果一致。FHL2基因对各种类型的心脏损伤恢复至关重要[2,11]。FHL2基因对心脏肥大相关的选择性信号通路起保护作用,通过抑制MAPK/ERK信号抑制心肌细胞肥大,是 calcineurin/NFAT 信号的抑制因子[34]。FHL2已被确定为肺癌的重要生物标志物,在肺部组织纤维化和肺癌的诊断与治疗中有重要作用[13,35]。本试验结果显示,牦牛FHL2基因在肺有显著表达,推测FHL2在牦牛心、肺的表达量高可能与其高原低氧环境的适应性相关。RT-qPCR结果显示,牦牛FHL2基因在卵巢、子宫和输卵管上高表达。IHC进一步证明,FHL2蛋白主要定位在卵巢有腔卵泡的颗粒细胞、子宫内膜和输卵管黏膜。有学者研究表明,敲除FHL2基因可抑制小鼠卵巢生长和卵泡发育,降低排卵质量和繁殖力[15];FHL2参与调控绵羊颗粒细胞增殖、凋亡、细胞周期和类固醇激素(雌二醇和孕酮)的分泌及相关基因的表达[16];FHL2提高胶质母细胞瘤中表皮生长因子受体(EGFR)的表达,从而促进细胞增生[36]。可以推测,FHL2可能与牦牛卵巢卵泡发育及输卵管黏膜和子宫内膜增生密切相关。IF结果显示,FHL2在卵巢颗粒细胞的细胞核和细胞质表达,与前人的研究结果一致[16,22]。本研究还发现,空怀期母牦牛卵巢FHL2基因表达量极显著高于妊娠期(P<0.01),而妊娠期子宫FHL2基因表达量极显著高于空怀期(P<0.01),进一步说明在空怀期FHL2可能促进卵巢卵泡生长发育,而在妊娠期促进子宫内膜增生,维持妊娠。
4 结 论
本试验克隆得到牦牛FHL2基因CDS区全长为840 bp,编码279个氨基酸,物种间具有较高保守性。其在牦牛各组织中广泛表达,在心、肺、卵巢、输卵管和子宫中高表达。FHL2蛋白主要定位在卵巢的颗粒细胞、输卵管的黏膜上皮、子宫内膜。空怀期卵巢中FHL2表达量显著高于妊娠期,而妊娠期子宫中的表达量显著高于空怀期。说明FHL2可能参与牦牛低氧适应性、卵泡生长发育和妊娠维持等生理功能的调控。
