青海云杉林凋落物分解早期微生物生物量时空动态变化
2023-02-03顾继雄周碧莲赵传燕
顾继雄,周碧莲,韩 昊,赵传燕
1 兰州大学草地农业科技学院,兰州大学草地农业生态系统国家重点实验室,兰州 730020 2 中国地质调查局西宁自然资源综合调查中心,西宁 810000
伴随着全球气候变暖、氮沉降等环境变化的加剧,森林生态、植被群落、物种构成以及植物本身的化学计量发生明显变化,导致凋落物输入的数量及质量亦相应发生改变,其细微变化带动地上与地下微生物的快速响应[1—2]。森林作为最大的营养物质和能量储存库,在陆地生态系统功能上具有重要地位。我国森林占地面积约2.1亿公顷,占国土面积的22%[3]。相对其他植被类型,森林产生的凋落物量巨大,其主要以叶凋落物为主(约占51.4%—65.1%)[4—5],能够为生态系统内的分解者以及部分消费者提供物质和能量来源[6]。另一方面,森林凋落物分解是植被-土壤系统相互联系的主要通道之一,能够将植物中积累的各种元素和化合物返还于环境中,这些物质进入土壤或渗入到地下水中,被植物吸收,再次参与生物地球化学循环过程[4]。此外,据研究者估算,全球因凋落物分解释放的CO2量高达68 Gt C/a,约占全球年碳总通量的70%[7]。有报道,凋落物分解与植物的生长发育、土壤养分的供给、森林植被群落更替和生态服务功能等密切相关[8—9],也与气候变化关系紧密,因为气候在较大程度上影响着凋落物的分解速率,凋落物分解又贡献给大气温室气体导致气温升高[10—12]。可见,凋落物在生物地球化学循环过程和气候变化中具有举足轻重的作用[13—15]。近年来,大量研究发现,微生物作为森林生态系统凋落物的重要分解者,其分解贡献可以是正的,也可以是负的[16—18]。微生物生物量(MB)在一定程度上可以指示参与凋落物分解过程的微生物群落数量和活性,而且是活性有机碳和有效养分库的重要组分[19]。但迄今为止,从时空尺度来研究凋落物分解过程中微生物生物量动态变化,在祁连山区鲜见报道[20—21]。
祁连山作为我国西北地区高大山脉,在区域气候调节、水源涵养以及生物多样性保育等方面具有十分重要且不可替代的作用和地位[22]。青海云杉(Piceacrassifolia)是祁连山地区的乔木建群种与优势种[22],形成了稳定的顶级群落,其叶凋落物分解是祁连山森林生态系统物质循环和能量流动的重要过程。青海云杉叶凋落物组成、土壤理化性质以及生态环境变化对其分解的影响已受到研究者的关注[22—23]。但微生物与凋落物分解关系的研究较为缺乏。为此,以青海云杉林叶凋落物为研究对象,采用凋落物袋野外原位分解的方法,研究了不同时空尺度上叶凋落物分解过程中的微生物生物量动态变化,以期揭示植被、凋落物和微生物互作机制,推进祁连山青海云杉林生物地球化学研究进程。
1 材料与方法
1.1 研究区概况
研究地点位于祁连山国家公园寺大隆自然保护区内的天涝池小流域,地理位置处于95°45′—101°03 E,36°20′—38°26′N,面积约12.8 km2,海拔2600—4450 m。年平均气温0.6℃,极端最高气温12.1℃,一般发生在当年7月;极端最低气温-13.1℃,一般出现在当年1月。年平均降水量326—539 mm,雨量季节分配不均,主要集中于当年5—9月,其占全年降水量的84.2%。该研究区温度随海拔的升高而降低,海拔每升高100 m,气温下降约0.58℃;降水随海拔的升高而增加,年平均潜在蒸发量1066 mm,年平均日照时数1892.6 h,年平均相对湿度59%,属于典型的大陆性高寒半湿润山地气候,气候特征表现为夏季短而湿润温凉(5—9月),冬季长而干燥寒冷(10月—翌年5月)[24]。该区域内土壤类型主要有山地灰褐土、山地灰钙土及亚高山草甸土等。森林主要为天然次生林,灌木生长茂密,为野生动物生活提供了良好的栖息地。森林覆盖率约65%,主要乔木有青海云杉和祁连圆柏(Sabinaprzewalskii),灌木主要有金露梅(Potentillafruticosa)、鬼箭锦鸡儿(Caraganajubata)和吉拉柳(Salixgilashanica)等,草本主要有垂穗披肩草(Elymusnutans)、葛缕子(Carumcarvi)、早熟禾(Poapratensis)等[23]。青海云杉林占研究区土地面积的25.39%,分布在海拔2600—3540 m的北坡上,其主要为藓类青海云杉林群落,林下发育苔藓层,苔藓层与凋落物组成厚度较厚的地被物层,是祁连山青海云杉林生态系统的典型特征[22]。在研究区青海云杉林内沿海拔布设5个样地,样地具体信息见表1和图1。
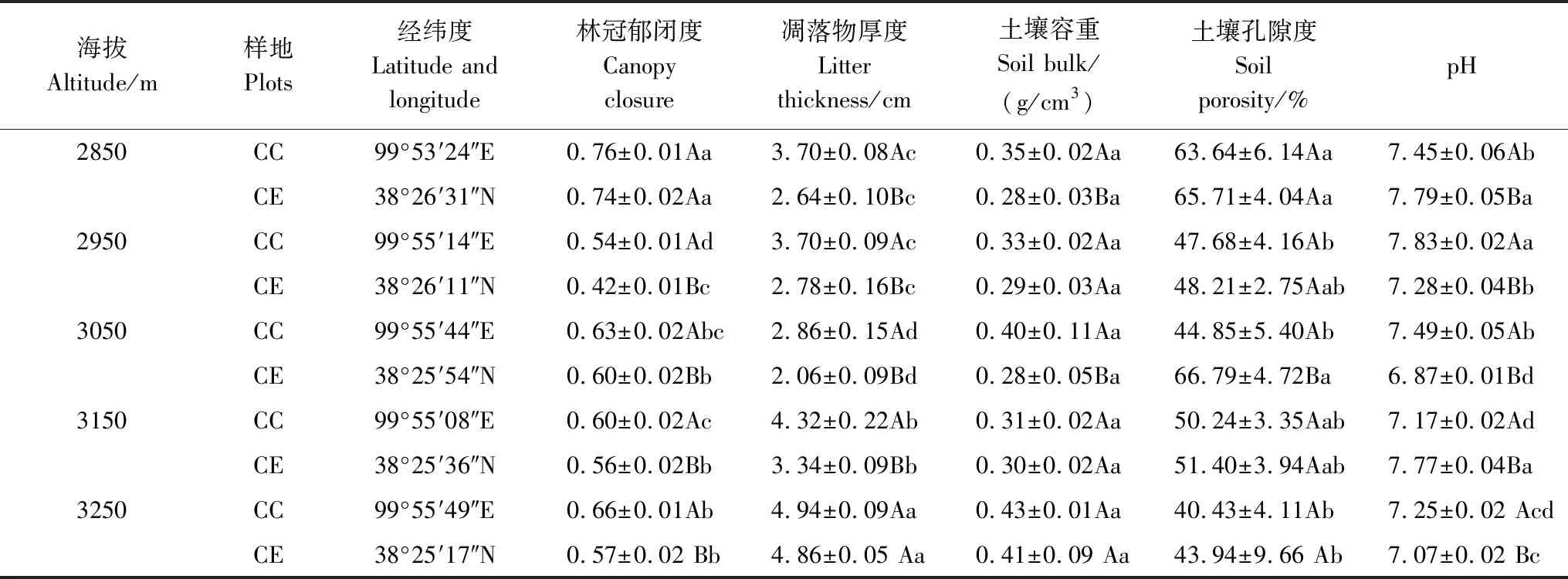
表1 样地概况(平均值±标准误)Table 1 Summary of study sites(Mean±SE)
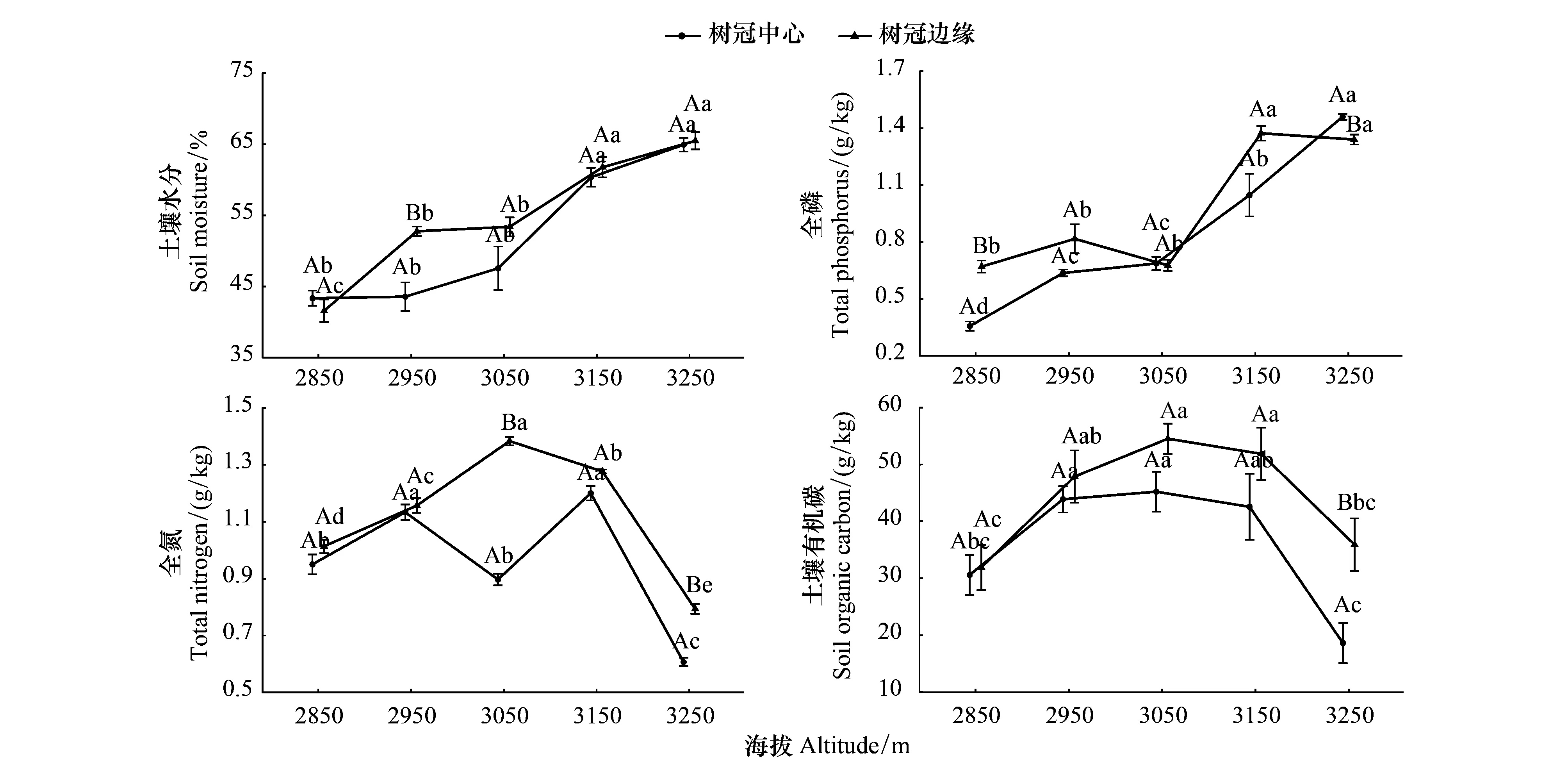
图1 研究样地的土壤理化性质Fig.1 Soil physical and chemical properties of each study plot 图中不同大写字母代表树冠中心与树冠边缘之间的差异显著,不同小写字母代表不同海拔梯度之间的差异显著(T检验,P<0.05,n=3)
1.2 实验设计与样品采集
在设定的5个海拔样地内分别随机设置6个1 m×1 m样方,为本实验采样区。在每个海拔研究样地内按照林冠位置再次分为树冠边缘(CE)和树冠中心(CC)样区。于2021年5月初收集样地内当年掉落的新鲜青海云杉叶,室内烘箱(85℃)烘干至恒重后称取15 g装入孔径为1 mm,大小为15 cm×15 cm的凋落物袋内,共设计有120个凋落物袋(5个海拔×2个林冠位置×3个重复×4次采样)。其中,1 mm网袋能排除绝大部分中小型土壤动物进入,可视为凋落物袋中凋落物分解主要是由微生物以及其它环境因素影响导致的[25]。将制备好的凋落物袋平铺于去除地被物的各样方中,使用牙签将其固定。凋落物初始特征如表2所示。

表2 凋落物基本初始特征(平均值±标准误)Table 2 Initial chemical properties of leaf litter of Qinghai spruce tree(Mean±SE)
2021年6月中旬第一次采样,之后,每月采集样品一次,至2021年9月中旬,共计采样4次(6—9月代表生长季),每次取3份凋落物袋样品。收取凋落物袋后,利用土钻采集下方0—10 cm土壤样品(尽量避免破坏周围凋落物袋下方的土壤结构),采集的凋落物袋与土壤样品放入已被高温杀菌过的无菌聚乙烯自封袋,置于冷藏箱暂时保存,返回实验室后立即放入-80℃冰箱保存。采集的3份凋落物袋样品用于微生物生物量的测定。将每份土样分为2份,一份土样于室内过2 mm孔径的筛,除去土壤中可见的植物残体(如根、茎和叶)、可见的碎石以及土壤动物残体(如蚂蚁、蚯蚓等)后存于4℃冰箱中,用于微生物生物量碳、氮和磷的测定;另一份土样除去动植物残体和碎石后置于室温环境下自然风干后供土壤理化性质分析的测定。
1.3 测定方法
称取4℃下保存的凋落物、土壤样品各1 g分析其微生物生物量。凋落物、土壤微生物生物量碳(MBC)和氮(MBN)采用氯仿熏蒸-K2SO4浸提法制取待测液[26],将待测组与空白对照组同时放入真空干燥箱中,用去乙醇氯仿于25℃熏蒸24 h后,抽掉残留氯仿,加入40 mL 0.5 mol/L K2SO4,振荡20 min后过滤,分别采用K2Cr2O7氧化-FeSO4滴定法和半微量凯氏定氮法测定MBC和MBN含量,MBC和MBN的转换系数分别为EC(0.38)[27],EN(0.45)[28]。凋落物、土壤微生物生物量磷(MBP)采用氯仿熏蒸-NaHCO3浸提法测定[29]。用外加无机磷(P)来确定P的提取回收率,以熏蒸与不熏蒸样品提取的P差值来校正提取回收率,最后乘以转换系数EP(0.4)[30]计算MBP。分析结果以凋落物、土壤每单位干重的含量表示。
1.4 数据处理
所有数据均采用Excel 2019进行存储和整理,利用R 4.1.0软件对数据进行参数检验,对不符合正态分布和方差齐性检验的数据进行转换。所有作图均采用R 4.1.0完成,所有表和图中数据均采用均值±标准误表示,显著性差异用不同大、小写字母表示(P<0.05)。然后采用单因素方差分析和新复极差法(Duncan)进行多重比较,分析海拔、树冠中心和边缘以及取样时间的微生物生物量的差异。
2 结果与分析
2.1 青海云杉叶凋落物分解过程中微生物生物量碳动态
2.1.1微生物生物量碳的空间变异
从空间上看(图2),凋落物中的MBC含量均高于土壤中的MBC含量,树冠边缘MBC含量均显著(P<0.05)高于树冠中心MBC含量(3250 m凋落物和3150 m土壤不显著除外)。在树冠中心,凋落物中的MBC含量在3150 m显著最高(P<0.05),其次为海拔2950 m(P<0.05),在3250 m显著最低(P<0.05),总体而言,呈现出:3150 m>2950 m>2850 m>3050 m>3250 m;土壤中的MBC含量表现出相似的变化规律。在树冠边缘,凋落物中的MBC含量在3050 m显著最高(P<0.05),其次为海拔2950 m,在3250 m显著最低(P<0.05),总体而言,呈现出:3050 m>2950 m>2850 m>3150 m>3250 m;土壤中的MBC含量表现出相似的变化规律。
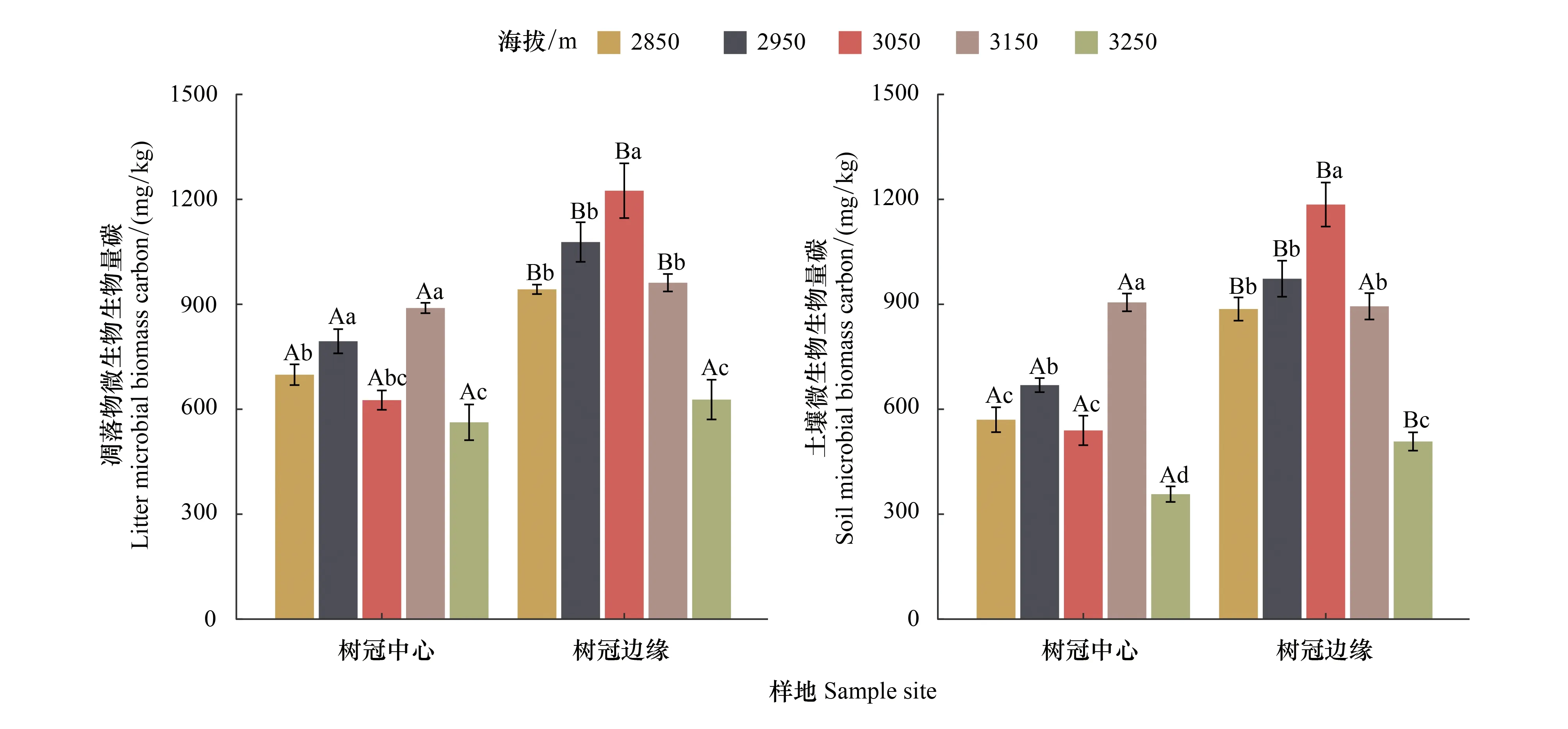
图2 青海云杉(Picea crassifolia)叶凋落物和土壤微生物生物量碳(MBC)的空间变化Fig.2 Spatial changes of microbial biomass carbon (MBC) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表树冠中心与树冠边缘之间的差异显著,不同小写字母代表不同海拔梯度之间的差异显著(T检验,P<0.05,n=12)
2.1.2微生物生物量碳的时间变异
从时间上看(图3),5个海拔梯度树冠中心和树冠边缘凋落物中的MBC含量均表现出明显的时间变化规律。总体而言,在生长季,7月和8月凋落物中的MBC含量均显著(P<0.05)高于6月和9月。各海拔树冠中心和树冠边缘凋落物中的MBC含量随时间呈“先上升-后下降”非线性变化,并于7月达到峰值。然而,5个海拔梯度树冠中心和树冠边缘土壤中的MBC含量却表现出截然相反的时间变化规律。在生长季,7月和8月土壤中的MBC含量均显著(P<0.05)低于6月和9月。各海拔土壤中的MBC含量随时间呈“先下降-后上升”非线性变化,并于7月(2850 m和3150 m树冠边缘除外)达到谷值。
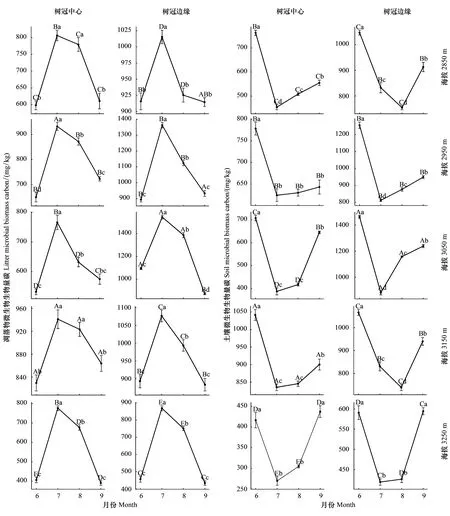
图3 青海云杉林下凋落物与土壤微生物生物量碳(MBC)的时间动态Fig.3 Temporal changes of microbial biomass carbon (MBC) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表不同海拔梯度之间的差异显著,不同小写字母代表不同取样时间之间的差异显著(T检验,P<0.05,n=3)
2.2 青海云杉叶凋落物分解过程中微生物生物量氮动态
2.2.1微生物生物量氮的空间变异
从空间上看(图4),凋落物中的MBN含量均高于土壤中的MBN含量(3050 m树冠边缘和3250 m树冠中心除外),树冠边缘MBN含量均显著(P<0.05)高于树冠中心MBN含量(3150 m凋落物和3150 m、3250 m土壤不显著除外)。在树冠中心,凋落物中的MBN含量在3150 m最高(P<0.05),其次为2950 m,在3250 m最低(P<0.05),总体而言,呈现出:3150 m>2950 m>2850 m>3050 m>3250 m;土壤中的MBN含量表现出相似的变化规律。在树冠边缘,凋落物中的MBN含量在3050 m最高(P<0.05),其次在2950 m,在3250 m最低(P<0.05),总体而言,呈现出:3050 m>2950 m>2850 m>3150 m>3250 m;土壤中的MBN含量表现出相似的变化规律。
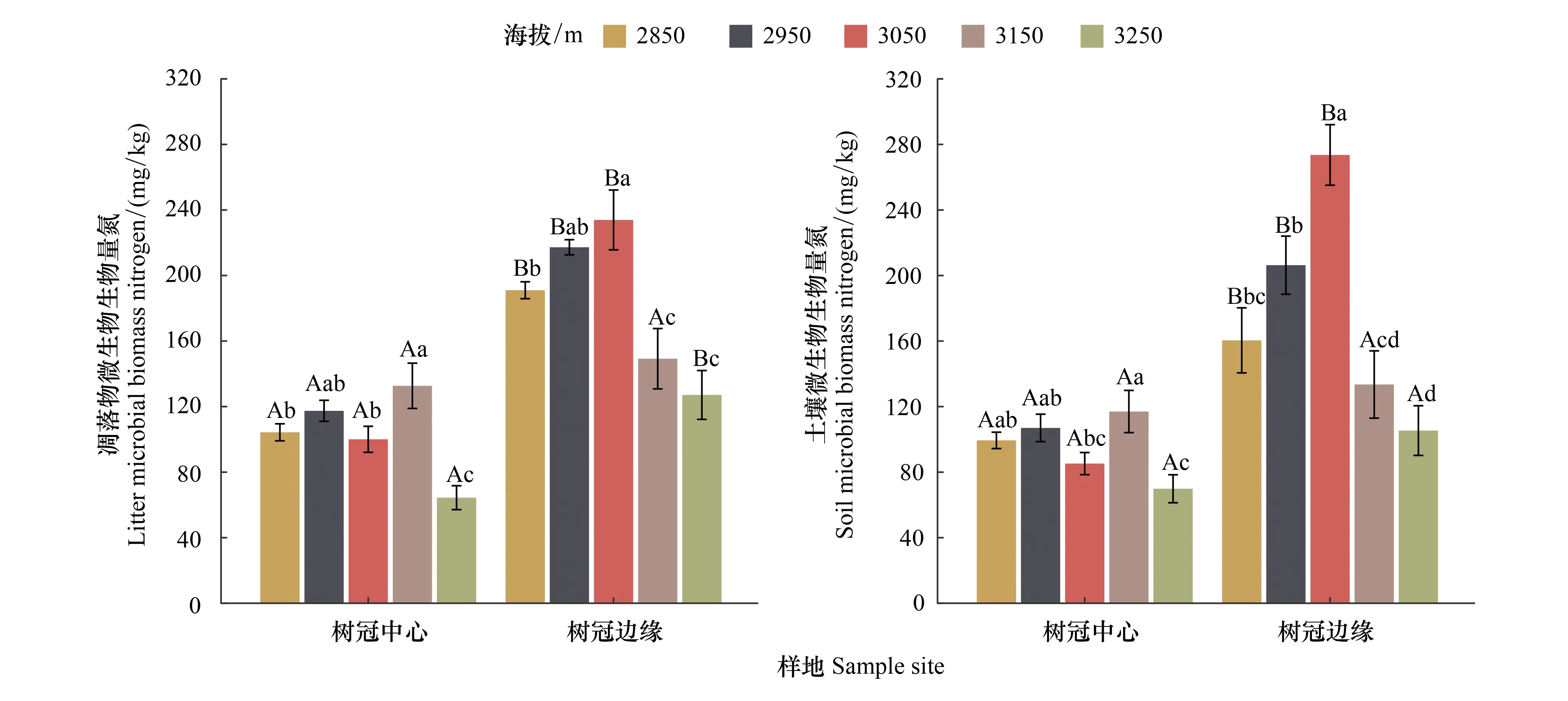
图4 青海云杉(Picea crassifolia)叶凋落物和土壤微生物生物量氮(MBN)的空间变化Fig.4 Spatial change of microbial biomass nitrogen (MBN) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表树冠中心与树冠边缘之间的差异显著,不同小写字母代表不同海拔梯度之间的差异显著(T检验,P<0.05,n=12)
2.2.2微生物生物量氮的时间变异
从时间上看(图5),5个海拔梯度树冠中心和树冠边缘凋落物中的MBN含量均表现出明显的时间变化规律。在生长季,7月和8月凋落物中的MBN含量均显著(P<0.05)高于6月和9月。各海拔树冠中心和树冠边缘凋落物中的MBN含量随时间呈“先上升-后下降”非线性变化,并于7月达到峰值。然而,5个海拔梯度树冠中心和树冠边缘土壤中的MBN含量却表现出截然相反的时间变化规律。总体而言,在生长季,7月和8月土壤中的MBN含量均显著(P<0.05)低于6月和9月。各海拔土壤中的MBN含量随时间呈“先下降-后上升”非线性变化,并于7月(3050 m树冠边缘和3250 m除外)达到谷值。
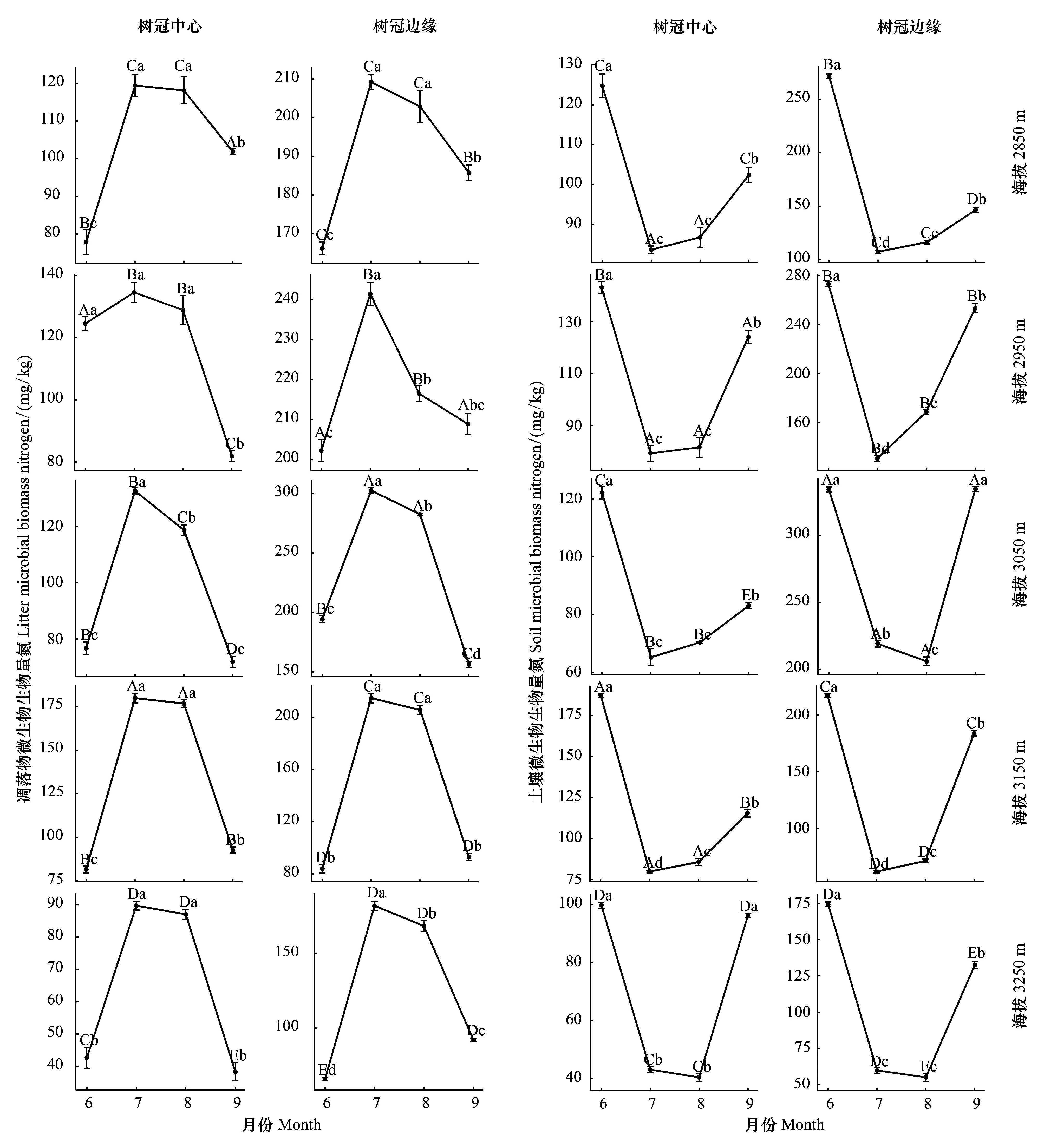
图5 青海云杉林下凋落物与土壤微生物生物量氮(MBN)的时间动态Fig.5 Temporal changes of microbial biomass nitrogen (MBN) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表不同海拔梯度之间的差异显著,不同小写字母代表不同取样时间之间的差异显著(T检验,P<0.05,n=3)
2.3 青海云杉叶凋落物分解过程中微生物生物量磷动态
2.3.1微生物生物量磷的空间变异
从空间上看(图6),凋落物中的MBP含量均低于土壤中的MBP含量(2850 m、3150 m树冠中心和2950 m除外),树冠边缘MBP含量均显著(P<0.05)高于树冠中心MBP含量(3150 m、3250 m凋落物和2950 m、3150 m土壤不显著除外)。在树冠中心,凋落物中的MBP含量以3150 m显著最高(P<0.05),其次为2950 m,然后以3250 m显著最低(P<0.05),总体而言,呈现出:3150 m>2950 m>2850 m>3050 m>3250 m;土壤中的MBP含量表现出相似的变化规律。在树冠边缘,凋落物中的MBP含量以3050 m显著最高(P<0.05),其次为2950 m,然后以3250 m显著最低(P<0.05),总体而言,呈现出:3050 m>2950 m>2850 m>3150 m>3250 m;土壤中的MBP含量以3050 m显著最高(P<0.05),其次为2850 m,然后以3250 m最低,总体而言,呈现出:3050 m>2850 m>3150 m>2950 m>3250 m的变化规律。
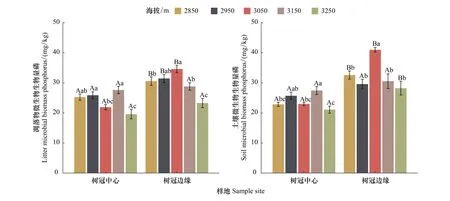
图6 青海云杉(Picea crassifolia)叶凋落物和土壤中微生物生物量磷(MBP)的空间变化Fig.6 Spatial change of microbial biomass phosphorus (MBP) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表树冠中心与树冠边缘之间的差异显著,不同小写字母代表不同海拔梯度之间的差异显著(T检验,P<0.05,n=12)
2.3.2微生物生物量磷的时间变异
从时间上看(图7),5个海拔梯度树冠中心和树冠边缘凋落物中的MBP含量均表现出明显的时间变化规律。总体而言,在生长季节,7月和8月凋落物中的MBP含量均显著(P<0.05)高于6月和9月。各海拔树冠中心和树冠边缘凋落物中的MBP含量随时间呈“先上升-后下降”非线性变化,并于8月达到峰值(3050 m、3250 m除外)。然而,5个海拔梯度树冠中心和树冠边缘土壤中的MBP含量却表现出截然相反的时间变化规律。总体而言,在生长季节,7月和8月土壤中的MBP含量均显著(P<0.05)低于6月和9月。在2850 m、2950 m、3150 m和3050 m树冠中心土壤中的MBP随时间呈“先下降-后上升”非线性变化,在3250 m和3050 m处树冠边缘土壤中的MBP随时间呈“先下降-后上升-再下降”的倒“N”型变化格局,并于7或8月达到谷值。
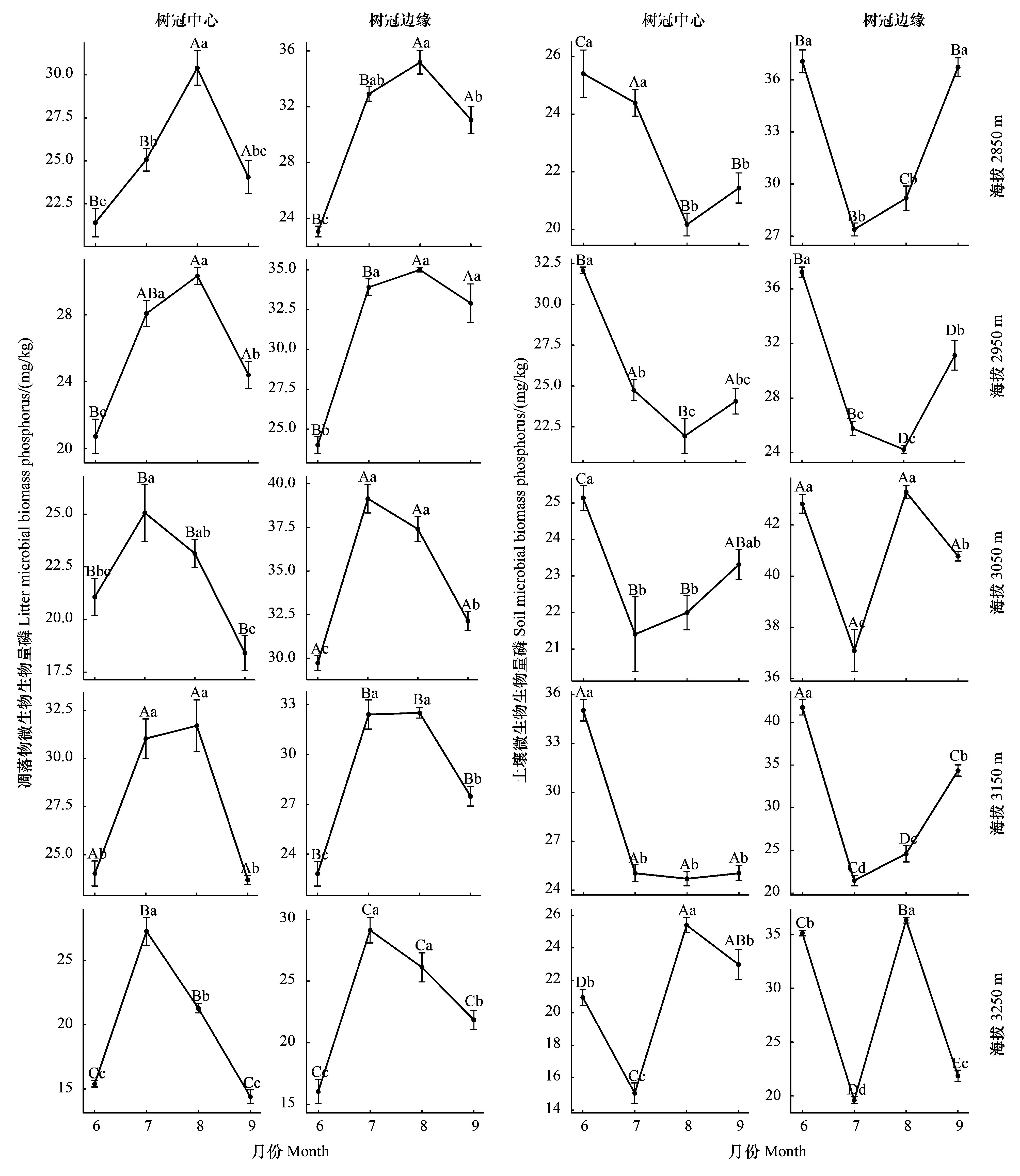
图7 青海云杉林下凋落物与土壤微生物生物量磷(MBP)的时间动态Fig.7 Temporal changes of microbial biomass phosphorus (MBP) in the leaf litter and the soil under Qinghai spruce forest图中不同大写字母代表不同海拔梯度之间的差异显著,不同小写字母代表不同取样时间之间的差异显著(T检验,P<0.05,n=3)
3 讨论
3.1 青海云杉叶凋落物分解过程中微生物生物量空间变异
微生物生物量在一定程度上可以指示凋落物分解过程中微生物群落数量和活性,对于描述微生物在凋落物分解过程中所发挥的作用具有重要意义[29]。以往研究发现,不同空间维度微生物生物量的变化较大[19,31]。本研究在对不同海拔CC与CE凋落物和土壤微生物生物量测定中同样发现了类似变化规律(图2、图4、图6)。其差异性可能由于生长季节不同海拔CC与CE的环境因素(温度、湿度、光照和土壤理化性质等)不同所造成的(图1)[22]。
有研究指出微生物生物量的空间变异是生态系统特性和环境因素综合作用的结果[31—32],其中,凋落物质量是重要影响因素之一[32—33]。研究发现,中、低海拔的MBC、MBN和MBP含量总体上高于高海拔,其中以中海拔的值最大(图2、图4、图6)。这个结果与不同海拔青海云杉叶凋落物性质(表2)及其水热、营养组合有关(图1),由于本研究原收集的新鲜青海云杉林叶凋落物均来源于各自原位分解处。相对于低海拔青海云杉林叶凋落物,高海拔青海云杉林叶要面临更加恶劣的环境条件,导致其叶物理性质(表面蜡质化、角质化、硬度)和化学性质(碳/氮(C/N)、木质素/氮以及酚类物质含量较高)发生变化(表2),以来提高其自身的抗逆性,微生物底物有效性变差,所能支持的微生物类群及数量相对较少[34—35],因而生长季节高海拔青海云杉林叶凋落物分解过程中MBC、MBN和MBP含量也就相对较低。这可能是中、低海拔叶凋落物与高海拔叶凋落物分解过程中微生物生物量出现差异的重要原因。以往研究表明,凋落物的质量会通过影响微生物的分解底物及其分解难以程度,进而影响微生物生长和繁衍活动[33]。
除此之外,水热条件差异也会对微生物生物量产生一定的影响[31]。本研究中凋落物中的MBC和MBN含量总体高于土壤中的,而MBP含量却出现相反情况;中、低海拔的MBC、MBN和MBP含量总体上高于高海拔;树冠边缘MBC、MBN和MBP含量显著(P<0.05)高于树冠中心(图2、图4、图6)。其可能原因主要是由于生长季节中、低海拔水热、营养条件有益于微生物的生长和繁衍活动所导致的,中海拔的水热、营养条件组合更好。相反,高海拔温度低水热、营养条件组合较差,可能限制了微生物活动(图1)。CC和CE的差别在于光照,CC处的光照条件差,再加上冠层的降雨截留导致林下湿度降低(图1),导致树冠边缘MBC、MBN和MBP含量显著(P<0.05)高于树冠中心,还可能与土壤中具有较高的有机质(图1)、较好的通气透水性能(即较低土壤容重、较大土壤孔隙度)、较密集的细根分布以及较多的凋落物输入有关(表1),使微生物在该空间下更加活跃。
3.2 青海云杉叶凋落物分解过程中微生物生物量时间变异
MBC含量表征着凋落物分解过程中活体微生物的生物量,是活体微生物数量的直接体现形式[36]。在本研究,凋落物分解过程中凋落物中的MBC含量在6月表现为低值,而在7—8月,随着生长季节气温升高、降雨增多、根系生长活跃以及植物对养分需求的竞争升高而急剧上升。生长季节易分解物质的大量流失,很大程度上改变了凋落物化学计量比[37],使得微生物底物有效性下降,表现为凋落物中MBC含量在生长季节后期(8月)出现缓慢下降,而进入9月(非生长季来临),地表气温下降,微生物逐渐转为休眠状态,凋落物中MBC含量出现快速下降。反其然,土壤中MBC含量出现与凋落物中相反结果,可能正是土壤中环境和底物发生相对转化所导致的。
MBN和MBP含量是凋落物分解过程中微生物利用氮(N)和磷(P)元素的重要指标[32]。以往研究发现,在凋落物分解初期N元素含量是一个主要影响分解因素,而到后期分解阶段则受木质素主导[38];其实与P相关的各种质量参数(如P浓度、C/P比等)同样影响着凋落物的分解过程[39—40]。近些年来,由于人类活动造成大气氮沉降的显著增加,N元素已显得不再是生态系统各种过程的制约因素,而P元素变得愈发重要。Aerts等[41]研究发现,P及与P有关的各种质量参数在凋落物分解初期扮演着重要角色。因此,7—8月青海云杉林叶凋落物分解过程中凋落物中的MBP含量显著升高。由于N和P的元素特征以及微生物对其利用机理不同[37,42],导致MBN和MBP在凋落物分解过程中的变化规律并不一致。不同海拔CC与CE凋落物分解过程中MBN的动态变化规律与MBC基本保持一致,这主要与微生物底物有效性的动态变化以及凋落物性质密切相关。然而,3050 m海拔CE和3250 m海拔土壤中的MBP含量呈“先下降-后上升-再下降”的倒“N”型变化格局,可能原因为P是制约青海云杉林叶凋落物分解的重要元素。从前面的分析可获悉,低温限制了凋落物分解过程中微生物的生长代谢活动,从而其数量相对减少,由于P元素可以被微生物固定再吸收[43],有限的P在较少微生物利用条件下表现出相对较高的MBP含量。相反,在生长季节前期或后期,由于相对较高的微生物丰度可能出现P元素竞争利用的现象,表现出MBP含量也不会太高。除此之外,不同海拔青海云杉林CC与CE凋落物中的和土壤中的MBC、MBN和MBP含量动态变化存在明显的格局差异,造成其原因可能是微生物底物有效性的动态变化及其与环境变化的综合作用,使得微生物对地上与地下有限元素采取选择性利用。
4 结论
祁连山不同海拔青海云杉林叶凋落物和土壤中MBC、MBN和MBP含量均表现出明显的空间差异和时间差异。总体而言,凋落物中的MBC、MBN和MBP含量在生长季节初期上升,后期下降;土壤中的MBC、MBN和MBP含量在生长季节初期开始下降,后期反而上升。相对于高海拔凋落物,中、低海拔凋落物在分解过程中具有相对较高的MBC、MBN和MBP含量,且对冠层结构的空间异质性(CC与CE)响应更加明显。尽管本项研究所发现的凋落物分解过程中微生物生物量变化的具体作用机制还存在很大的不确定性,亟待进一步深入的研究,但这些研究结果在一定程度上为了解凋落物分解过程以及微生物对森林生态系统物质循环和能量流动的影响奠定了基础。
