曲霉来源果胶裂解酶PnlF的克隆表达及酶学性质分析
2023-02-03宋晓慧李悝悝赵秒李唐尹恒
宋晓慧,李悝悝,赵秒,李唐*,尹恒
1(大连工业大学 纺织与材料工程学院,辽宁 大连,116023)2(中科院大连化学物理研究所 辽宁省碳水化合物重点实验室 大连市糖类农用制剂工程研究中心,辽宁 大连,116023)
果胶是一种形成植物初生细胞壁和胞间层的结构多糖[1],因其结构灵活且具有刚性,能够保护植物免受植物病原体的侵害[2]。在食品加工行业中,原材料中的果胶成分会在过滤过程中出现结垢的现象[3],且不溶性的果胶与细胞碎片中的蛋白质、多糖等成分是导致鲜榨果汁立即变浑浊的主要原因[4-5]。利用生物酶制剂代替膨润土等化学澄清剂进行果汁澄清[6],不仅可以有效节约成本,而且可以减少对环境的污染和能源的消耗[7]。其中,果胶酶广泛用于饮料行业,用于提高提取的收率、果汁澄清及增香等过程。
果胶酶是具有果胶降解能力的一类酶的总称,其中,果胶裂解酶通过β-消除机理催化果胶底物裂解,主要降解产物为4,5-不饱和寡聚半乳糖醛酸[8],同时不产生剧毒副产物甲醇[9]。果胶裂解酶可以直接作用于高酯化的果胶底物,有效降低溶液黏度[10],而且不会干扰为果汁带来特定香气的酯含量[11]。基于这些优点,近年来关于果胶裂解酶的深入挖掘和工业应用研究,受到研究者的广泛关注。
果胶裂解酶根据其对果胶底物的偏好性分为果胶裂解酶(pectin lyase,Pnl,EC 4.2.2.10)和果胶酸裂解酶(pectate lyase,Pel,EC 4.2.2.2、EC 4.2.2.9):果胶裂解酶倾向于裂解甲酯化程度高的果胶底物,又称多聚甲基半乳糖醛酸裂解酶(polymethylgalacturonate lyase,PMGL);果胶酸裂解酶则对酯化程度低的多聚半乳糖醛酸的偏好性更强,因此又叫做多聚半乳糖醛酸裂解酶(polygalacturonate lyase,PGL)[12]。
果胶裂解酶来源广泛,大多数报道的PGL和PMGL来自于细菌和真菌等微生物,只有少数来自于植物和动物[2]。天然微生物来源的果胶裂解酶作为各种工业过程的潜在生物催化剂引起了越来越多的关注。WU等[13]对果胶裂解酶的广泛应用进行了介绍,指出除了酸性果胶裂解酶在饮料工业中的应用外,碱性且耐高温的果胶裂解酶可以应用于纺织工业中的棉花的精炼工艺和苎麻脱胶工艺,并且在纸浆加工、果胶废水预处理和橄榄油提取方面也有潜在的应用价值。
尽管,近年来针对果胶裂解酶的报道很多[14-17],但面对全球食品加工行业规模不断扩大、需求量不断增加[5],目前已知的果胶裂解酶仍不能满足生产需求,因此需要深入挖掘,以获得兼具成本效益和高度活性的果胶酶制剂。曲霉属真菌作为重要的果胶酶来源菌株,其基因组中编码的6个果胶裂解酶也受到了广泛关注[18],在比较转录组中各种果胶裂解酶的表达时,发现PelF表达水平仅次于PelA[19],具有巨大的应用潜力。
本研究中利用毕赤酵母表达系统,克隆表达了来自曲霉属菌株Aspergilluscostaricensis的酸性果胶裂解酶PnlF,粗酶经亲和层析和凝胶过滤色谱进行了纯化,并测定了其果胶降解酶活力以及酶学性质,用高效阴离子交换色谱(high performance anion exchange chromatography,HPAEC)分析了其降解产物,为后续拓展其工业应用奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
曲霉属菌株(Aspergilluscostaricensis),大连化学物理研究所1805课题组。大肠杆菌(Escherichiacoli)TOP10菌株,北京庄盟国际生物基因科技有限公司;毕赤酵母(Pichiapastoris)X-33及表达质粒pPICZαA,Invitrogen公司。
1.1.2 化学试剂
转化及诱导表达培养基低盐LB(low salt LB,LLB)、YPD、含山梨醇的YPD(YPD with 1 mol/L sorbitol, YPDS)、BMGY、BMMY均按照Invitrogen公司提供毕赤酵母表达系统说明书制备。无氨基酸酵母氮源(yeast nitrogen base,YNB),BD Biosciences公司;生物素,Amresco公司;博莱霉素(Zeocin),Invitrogen公司;限制性内切酶EcoRⅠ、NotⅠ、PmeⅠ,美国赛默飞世尔科技公司;质粒小量制备试剂盒,美国Axygen公司;预染蛋白Marker,MBI Fermentas公司;BM 5000+DNA Marker,北京博迈德科技发展有限公司;硫代巴比妥酸(thiobarbituric acid, TBA),国药集团化学试剂有限公司;橘皮果胶,美国Sigma-Aldrich公司;Ni-NTA resin填料,美国GE公司;HiLoad 16/600 Superdex 200 pg分子筛,美国Cytiva公司。其余试剂均为国产分析纯。
1.1.3 仪器与设备
PL2002电子天平,梅特勒-托利多仪器上海有限公司;CR-22E高速冷冻离心机,日本HITACHI公司;GenePulserXcellTM电转仪、PowerPac 300蛋白电泳仪,美国BIO-RAD公司;DYY-6C琼脂糖凝胶电泳仪,北京市六一仪器厂;GelDoc-ItTM310紫外凝胶-显微成像仪,UVP公司;Eon酶标仪,美国伯腾BioTek仪器有限公司;ICS 3000高效液相色谱系统,戴安(中国)有限公司;AKTA prime蛋白质纯化系统,美国GE公司。
1.2 试验方法
1.2.1 PnlF序列分析及结构模拟
黑曲霉PnlF是一种分泌蛋白,首先利用在线信号肽预测网站(https://services.healthtech.dtu.dk/service.php?SignalP)对PnlF的氨基酸序列(GenBank accession No.XP_025536336.1)进行了分析,确定了PnlF信号肽序列的C末端氨基酸残基,然后将去除信号肽的蛋白质序列利用SWISS-MODEL网站(https://swissmodel.expasy.org/)进行同源建模,获得的三维结构模型依据全局模型质量评估(global model quality estimate, GMQE)值和全局定性模型能量分析(QMEANDisCo Global)值进行可靠性评价。此外,利用CLUSTALW软件和ESPript在线比对工具(https://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)对PnlF与已知晶体结构的高度同源的PnlF(PDB ID:1QCX、1IDJ)进行基于蛋白结构的多序列比对分析。
1.2.2 重组PnlF表达载体构建
重组PnlF采用毕赤酵母表达系统进行分泌表达。首先对PnlF的编码序列(不含信号肽)进行了密码子优化,以利于其在彼此酵母中表达。优化后的基因序列的N末端添加了限制性内切酶位点EcoRⅠ和6×His蛋白纯化标签的编码序列,在C末端添加了限制性内切酶位点NotⅠ。通过苏州金唯智生物科技有限公司对优化后的PnlF编码基因进行了合成,然后通过双酶切连接的方法插入到pPICZαA质粒的EcoRI-NotI位置上。将构建的重组质粒pPICZαA-AcPnlF转化至EscherichiacoliTOP10感受态细胞,经含有100 μg/mL博莱霉素的LLB平板进行筛选,最后通过测序的方法对阳性菌株进行验证。
1.2.3 重组表达载体电转化酵母细胞
挑取活化平板酵母单菌落,接种到100 mL YPD液体培养基中,28 ℃、180 r/min培养16~18 h,使OD600值达到1.3,冰上孵育15 min,于4 ℃、2 200 r/min离心5 min,弃上清液,50 mL预冷的无菌水,振荡重悬。重复洗涤2次,2 200 r/min离心5 min,弃上清液,用20 mL预冷的1 mol/L的无菌山梨醇溶液,重悬菌体,4 ℃、2 200 r/min离心5 min,弃上清液,加入少量1 mol/L的无菌山梨醇溶液重悬。
取80 μL新鲜制备的酵母感受态,加入10 μL经过PmeⅠ线性化、脱盐、重悬等处理的重组质粒,轻弹混匀,移入电转杯,冰浴5 min。调节电转仪参数:电压2 000 V;电阻200 Ω;电容25 μF;脉冲时间约5 ms,1次电击。电击后,马上在电转杯中加入400 μL经4 ℃预冷的1 mol/L的山梨醇溶液, 轻微混匀,转移至无菌1.5 mL离心管,28 ℃静置培养2 h,涂布含有100 μg/mL博莱霉素的YPDS平板(YPDSZ)平板,28 ℃培养3~5 d检测单菌落生长情况。
1.2.4 表达菌株的筛选与鉴定
YPDSZ平板筛选出的阳性转化子,经过高浓度博莱霉素抗性(8 mg/mL)平板复筛。复筛的阳性转化子利用改良的微波法提取基因组,利用载体通用引物AOX进行菌落PCR验证。
1.2.5 重组PnlF在毕赤酵母中的异源表达
高抗性平板上生长的验证正确的阳性转化子,接种到装有100 mL BMGY培养基的500 mL三角瓶中,28 ℃,180 r/min培养至OD600约1.3时,2 500 r/min离心5 min收集上述菌体,去除上清液,用BMMY液体培养基重悬后转入200 mL该培养基中,进行诱导表达。每隔24 h,向200 mL BMMY培养基中补充1 mL无水甲醇,连续诱导表达120 h后,12 000 r/min离心30 min收集上清液。12%SDS-PAGE检测重组蛋白表达情况。
1.2.6 重组PnlF的Ni-NTA亲和纯化
经过超滤浓缩的发酵上清液,用平衡缓冲液A(包含50 mmol/L Na2HPO4、100 mmol/L NaCl、pH 7.8)稀释4倍后,用于亲和纯化。50 mL稀释过的粗酶液,加入缓冲液A平衡过的Ni-NTA层析柱中,通过不断提高平衡缓冲液中咪唑浓度(20、40、200 mmol/L)进行洗脱,收集各步洗脱组分,经过12% SDS-PAGE验证纯化效果,同时测定蛋白浓度,检测PnlF活性。
1.2.7 重组PnlF的分子筛纯化
将Ni-NTA亲和纯化获得的样品利用10 kDa截留的超滤管浓缩至约1.5 mL,将浓缩的蛋白样品用0.22 μm滤膜过滤,然后加载到已经用平衡缓冲液A平衡好的分子筛上,流速1 mL/min,收集洗脱峰并用SDS-PAGE检测纯度,同时测定蛋白浓度,检测PnlF活性。
1.2.8 蛋白质浓度测定
蛋白质浓度测定的方法,采用Bradford法,以牛血清白蛋白作为标准蛋白制作标准曲线。
1.2.9 TBA法测定重组PnlF活性
参考NEDJMA等[20]提出的TBA检测法稍加改良。30 μL 10 g/L果胶溶液50 ℃孵育5 min后,加入2 μL待测酶液,50 ℃恒温反应15 min,加入30 μL 1 mol/L NaOH溶液终止反应,80 ℃孵育10 min,冷却至室温后加入36 μL 1 mol/L HCl酸化反应体系,混匀后加入30 μL 0.04 mol/L TBA溶液,80 ℃反应10 min显色,在550 nm波长下测定其吸光值。酶活力单位定义为:1 min使550 nm紫外吸光值增加0.01所需要的酶量。
1.2.10 重组PnlF的酶学性质表征
在最适pH 5.0条件下,以10 g/L果胶为底物,在不同温度(20~80 ℃)进行酶活力测定,将50 ℃的PnlF活性定义为100%,计算相对酶活性,确定酶的最适反应温度;将酶液在上述温度中孵育30 min,在最适条件下进行酶活力测定,并和未处理的酶活力进行比较,计算相对酶活性。
在最适反应温度50 ℃条件下,以10 g/L果胶为底物,在pH值为2.0~11.0的不同缓冲液(pH 2.0~3.0:50 mmol/L甘氨酸-HCl;pH 4.0~5.0:50 mmol/L NaAc-HAc;pH 6.0~8.0:50 mmol/L Na2HPO4-NaH2PO4;pH 9.0~11.0:50 mmol/L甘氨酸-NaOH)条件下进行酶活力测定,将pH 5.0条件下的PnlF活性定义为100%,计算相对酶活性,确定酶的最适反应pH值;将酶液在上述pH的缓冲液中稀释,4 ℃孵育60 h,在最适条件下进行酶活力测定,并和未处理的酶活力进行比较,计算相对酶活性。
在最适反应条件下测定了终浓度1 mmol/L、10 g/L或0.1%(体积分数)的金属离子或化学试剂对PnlF酶活性的影响,Na+浓度则分别采用50、100、200 mmol/L,并和未处理的酶活力进行比较,计算相对酶活性。
1.2.11 重组PnlF的降解产物分析
以1 mL 10 g/L果胶底物与200 μL酶液的反应混合物在37 ℃、180 r/min条件下反应24 h。PnlF样品除去蛋白质后经0.22 μm滤膜过滤,50 μL反应混合物上样至PA-100色谱柱,流速0.3 mL/min,检测器在30 ℃稳定。流动相A:超纯水;流动相B:8 mol/L NaOH溶液,流动相C:2 mol/L NaAc溶液。洗脱梯度描述如下:1~60 min,V(A)∶V(B)∶V(C)=30∶50∶20和15∶50∶35;60~120 min,V(A)∶V(B)∶V(C)=15∶50∶35和10∶50∶40;120~130 min,V(A)∶V(B)∶V(C)=30∶50∶20。用coularray软件对数据进行分析。
2 结果与分析
2.1 PnlF的多序列比对和结构模拟
A.costaricensis来源的PnlF基因(pnlF)共编码475个氨基酸残基,其N末端第1~19个氨基酸经网站预测为信号肽,去除信号肽后的蛋白质序列的理论分子质量(Mw)和等电点(pI)分别为47.3 kDa和5.84。对蛋白质数据库(Protein Data Bank,PDB)的同源序列比对发现PnlF与同样来源于黑曲霉的PelA(PDB ID:1IDJ)和PelB(PDB ID:1QCX)序列相似性最高(图1),分别为41%和43%。因此,以PelB的三维结构为模板对PnlF进行了同源建模,得到该酶蛋白的三维结构模型。该模型的GMQE值和QMEANDisCo Global值分别为0.65和(0.77±0.05),这2个值都是介于0和1之间,越接近1表示模型质量越好,可信度越高。

图1 PnlF与其结构相似的PelA和PelB的序列比对Fig.1 Structure based multiple amino acid sequence alignment of PnlF with PelA and PelB
PnlF的结构与PelB非常相似[21],且同属于PL1家族[22]。PnlF的结构如图2所示,主要由β折叠片构成,其核心包含3个平行的β片层,折叠成一个大的横截面有凹坑的右手螺旋。在N末端(Phe72-Gly125),平行β片层结构向外延伸,盘绕成一个大的右手圆柱体型结构。另外,PnlF在C末端具有一段结构未知的序列(Leu383-Tyr475),在二级结构上属于无规卷曲,这段序列被认为是不同来源的果胶裂解酶F所特有的[19]。

a-侧面示意图;b-顶部示意图图2 同源建模获得的PnlF三维结构模型的示意图Fig.2 Three dimensional structure of PnlF from homology modeling注:蛋白的核心结构域用粉红色表示,参与构成一个大的右手圆柱体型结构的N末端片段(Phe72-Gly125)(用蓝色标记,结构的 N末端和C末端分别用字母进行标记)
2.2 重组果胶裂解酶PnlF真核表达菌株构建
成功构建了果胶裂解酶PnlF酵母表达重组质粒pPICZαA-AcPnlF,质粒图谱如图3-a所示。将目标质粒通过电转化转入毕赤酵母X-33感受态细胞中,挑选阳性转化子提取基因组,然后通过PCR的方法验证转化情况,如图3-b所示,1~5号菌落均在约1 800 bp位置检测到的目的条带,其中1、3、5号菌落条带明亮,表示转化拷贝数较高,可以用于下一步诱导表达。

a-PnlF的表达载体;b-菌落PCR验证(M-DNA Marker;泳道1~5-挑选的阳性转化子)图3 pPICZαA-PnlF的表达载体和菌落PCRFig.3 Expression vector and Colony PCR of pPICZαA-PnlF
SDS-PAGE分析重组PnlF的表达情况,如图4-a(泳道1)所示,发酵上清液在约50 kDa附近有明显条带,随后对发酵上清液进行PnlF活性检测,发现该粗酶液中PnlF活力高达529.7 U/mg。试验结果表明,重组的PnlF在毕赤酵母中成功表达,并在粗酶液中表现出较高的PnlF活力。
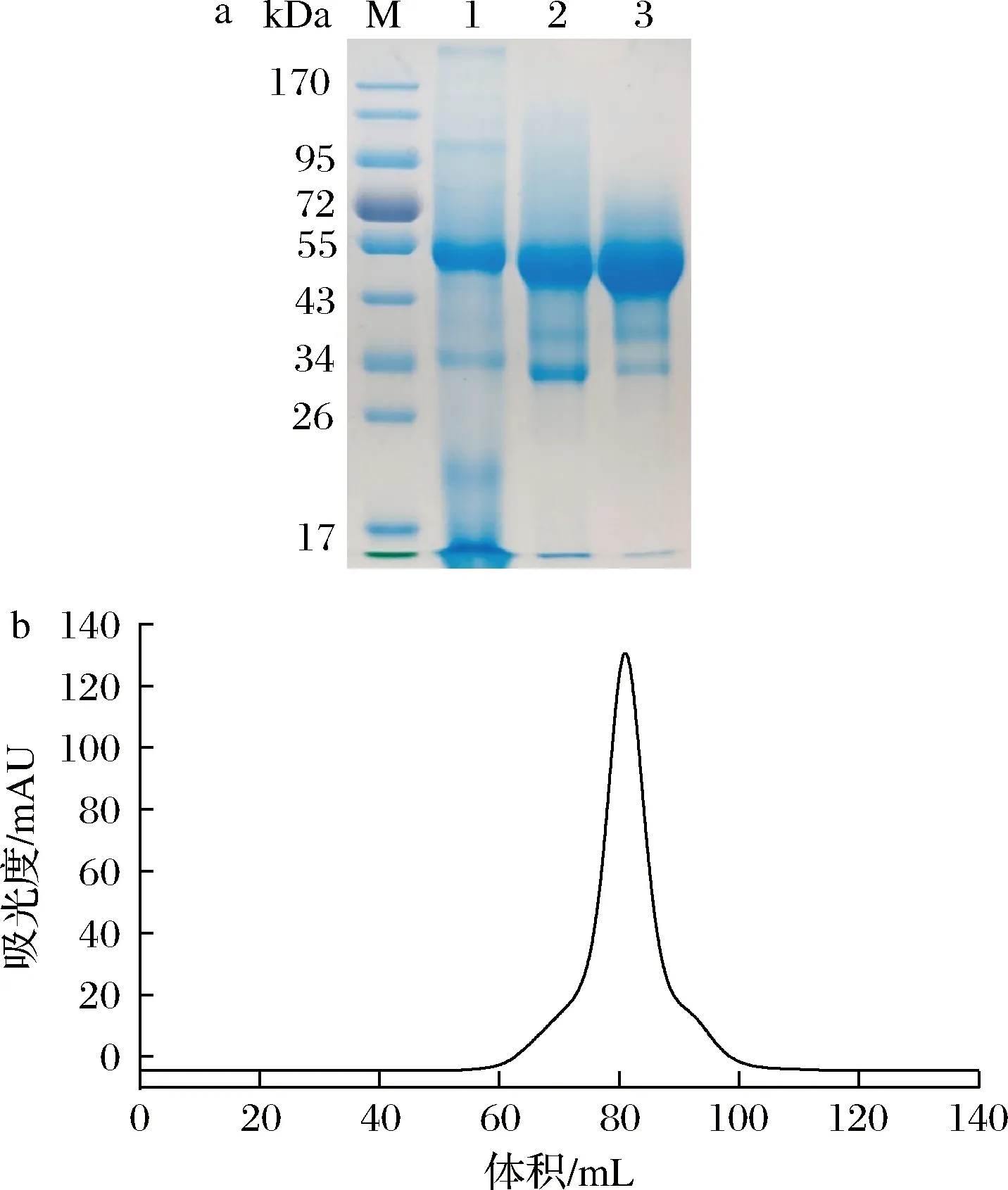
a-PnlF各纯化步骤的样品的SDS-PAGE分析(M-蛋白MARKER;1-粗酶液;2-Ni-NTA亲和层析后样品;3-分子筛纯化后样品);b-PnlF分子筛纯化图谱图4 PnlF的表达与纯化Fig.4 Expression and purification of PnlF
2.3 重组PnlF的纯化与活性分析
由于表达的PnlF在蛋白序列的N末端带有6×His纯化标签,于是利用Ni-NTA亲和凝胶树脂对PnlF表达液进行了亲和层析,SDS-PAGE结果显示纯化后的蛋白样品除目标条带外,在34 kDa处有非特异性条带(图4-a,泳道2)。最后采用分子筛层析的方法对样品进一步纯化,在81 mL处收集到单一洗脱峰,SDS-PAGE结果显示在约50 kDa处有单一条带(图4-a,泳道3),且酶活力达到536.7 U/mg。表观分子质量(50 kDa)与理论分子质量(47.3 kDa)的差异可能是由于N端His纯化标签的存在以及蛋白表面的糖基化修饰所导致。详细的纯化和酶活力回收情况在表1中列出。
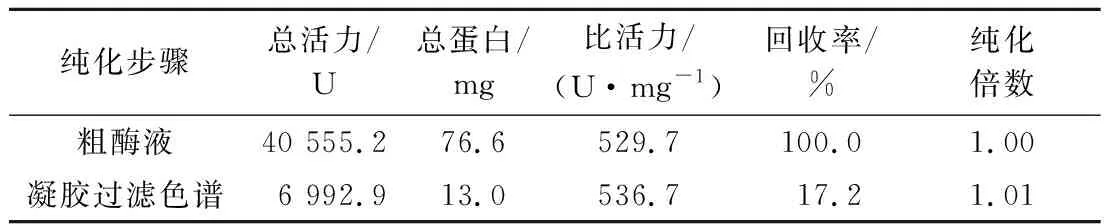
表1 重组果胶裂解酶PnlF的纯化表Table 1 Purification of recombinant pectin lyase PnlF
2.4 重组PnlF的酶学性质研究
2.4.1 温度对PnlF活性的影响
通过测定PnlF在不同温度下的酶活力变化,绘制了变化曲线(图5-a),试验结果表明了PnlF的最适反应温度为50 ℃,并且在40~55 ℃的温度范围内相对活性>60%。图5-b展示了不同温度条件下酶的稳定性,在20 ℃条件下孵育30 min,PnlF的活力下降了20%;当孵育温度提高至30 ℃时,残余酶活力降低至50%;当孵育温度提高至40 ℃及以上时,残余的PnlF活力降低至10%以下。

a-温度对PnlF活性的影响;b-PnlF的热稳定性图5 温度对PnlF活性的影响及该酶的热稳定性Fig.5 Effect of temperature on pectinase activity and its thermal stability
由于天然产生Pnl的微生物存在于各种环境中,Pnl在较宽的温度范围内(30~70 ℃)均有活性[23]。对比文献报道,PnlF较其他天然来源的酸性Pnl温度稳定性低,无花果曲霉来源的酸性Pnl在20~40 ℃范围内稳定[24];黑曲霉来源的Pnl能在43 ℃,60 min内维持80%以上活性,但在50 ℃,20 min就丧失了70%的活性[17]。
2.4.2 pH对PnlF活性的影响
如图6-a所示PnlF的最适反应pH为5.0,是一种酸性Pnl,当pH>6或pH<4时,酶活力明显下降。该酶的pH稳定性如图6-b所示,其在pH 5~6的弱酸性条件下较为稳定,4 ℃孵育60 h仍保持60%以上的裂解酶活力。

a-pH对PnlF活性的影响;b-PnlF的pH稳定性图6 pH值对PnlF活性的影响及pH稳定性Fig.6 Effect of pH on pectinase activity and its pH stability
Pnl的最适反应pH的条件决定了其在工业应用中的适用范围,如纺织和纸浆工业加工一般在碱性条件下运行,而饮料加工则在酸性条件下[13]。黑曲霉来源的PNL-ZJ5处理苹果果汁时,苹果汁黏度比对照降低了38.8%,透光率提高了86.3%[17]。PnlF在酸性条件下较为稳定,表明该酶可能适合用于饮料加工业。
2.4.3 金属离子和化学试剂对PnlF的影响
金属离子和化学试剂对PnlF的影响如表2所示。

表2 金属离子及化学试剂对PnlF活性的影响Table 2 Effects of metal ions and chemical reagents on the enzyme activity of PnlF
PnlF的活性可以被多数金属阳离子激活,包括1 mmol/L Co2+、Ba2+、Mg2+、Ca2+、Ni2+、Zn2+、Fe2+等二价金属阳离子。而Li+、Na+、K+等一价阳离子也可以在一定程度上提高PnlF的活力,而且Na+对PnlF活性的促进作用随离子浓度的提高而增强。相反,Ag+、Cu2+、Mn2+、Fe3+4种过渡态金属离子强烈抑制PnlF的活性,同样抑制PnlF活性的还有离子型去垢剂SDS、聚乙二醇辛基苯基醚(TritonX-100),以及常见的蛋白酶活性抑制剂苯甲磺酰氟(phenyl methane sulfonyl fluoride,PMSF)。有趣的是EDTA作为金属离子螯合剂对PnlF的活性并未产生抑制作用,这表明PnlF的催化活性是非金属依赖的,但是可以被多种金属离子所激活,EDTA的存在有利于清除溶液中抑制PnlF活性的金属离子,对该酶起到保护作用。此外,还原剂二硫苏糖醇(DL-dithiothreitol,DTT)和β-巯基乙醇(2-mercaptoethanol,β-ME)在1 mmol/L的浓度下对PnlF的活性有少量的促进作用,这意味着较低浓度的还原剂并不能破坏该酶结构上的二硫键,反而可以通过还原反应清除溶液中的氧化物金属离子,对PnlF起到保护作用。非离子型去垢剂吐温-20对PnlF的影响较小。
不同的离子对不同来源的Pnl影响存在差异,与PnlF类似,黄曲霉MTCC 7589来源的碱性Pnl受到Co2+和Mn2+的促进,被Ag+和Cu2+完全抑制。而黑曲霉来源的酸性Pnl能够被Mg2+、Ca2+、Fe3+等激活,同时受到Ni2+、Zn2+的抑制[17]。
2.5 重组PnlF的产物分析
此外,PnlF降解果胶得到的产物利用配有脉冲检测器的高效阴离子交换色谱(high performance anion exchange chromatography-pulsed amperometric detector,HPAEC-PAD)进行了检测分析。如图7所示,在pH 5.0时,使用PnlF处理1 mg/mL的商品化果胶12 h,产物在线性洗脱至30 min后,出现规律的降解产物峰,根据文献中对PnlF降解产物偏好性的研究[19],推测32 min洗脱的果胶寡糖聚合度为3,而且产生的降解产物聚合度分布较广(3~9)。

图7 PnlF酶解果胶产物的HPAEC-PAD分析Fig.7 HPAEC-PAD analysis of the pectin hydrolysate
但目前对于PMGL降解产物的分析较少,黑曲霉来源的Pnl在降解橘皮果胶时,含有2个甲酯取代的半乳糖醛酸三聚体(gA3m2)和3个甲酯取代的半乳糖醛酸三聚体(gA3m3),是降解过程中的主要产物,PnlF表现出了对不同乙酰化程度的聚合度为3产物的耐受性,而且在降解过程中高聚合度(6~7)的产物很少[19]。
3 结论
该文实现了黑曲霉来源的PnlF在毕赤酵母X-33细胞中的异源分泌表达,相较于文献报道利用黑曲霉表达系统进行黑曲霉来源的PnlF过表达的研究[18-19],酵母体系下PnlF的表达更加稳定,表达量高。
PnlF的分子质量是黑曲霉编码的5种Pnl中最大的,全长蛋白约50 kDa;相较于对多聚半乳糖醛酸的降解,PnlF更倾向于降解复杂的果胶底物,因此应当属于PMGL。经过纯化的PnlF比活力达到536.7 U/mg。目前已知的活性最高的Pnl(EC 4.2.2.10)的报道,是边缘假单胞菌来源的1株Pnl,纯化后比活力高达1 502 U/mg,该数据是通过检测235 nm紫外吸光值变化测得的[25]。PnlF的反应最适温度为50 ℃,最适反应pH为5.0,属于酸性Pnl,而且pH在5~6的弱酸性范围内稳定。Ca2+和Mg2+可以大幅度提高PnlF的裂解酶活力;而Ag+和Cu2+则会严重抑制其活力;此外SDS、TritonX-100、PMSF等化学试剂对该酶活性的抑制作用较强。酶学性质的研究表明,PnlF具有相对较高的最适反应温度、酸碱稳定性,具有一定的工业应用的潜在价值。PnlF的产物分析表明其降解果胶的产物聚合度分布较广,PMGL作为一类内切酶,在生产具有不同聚合程度的单糖和低聚糖方面具有巨大的潜力[2]。
重组PnlF的温度稳定性较差,限制了其在工业生产中的应用,下一步可以通过提高酶自身的结构稳定性,提高对温度的耐受,有望实现工业应用。
