奥拉帕利在肿瘤专科医院卵巢癌患者中的合理性和安全性研究
2023-02-02徐艳艳郭小红倪美鑫
徐艳艳,郭小红,姚 敏,倪美鑫,梅 丹,杨 阳
0 引言
卵巢癌恶性程度高、复发率高、治疗难度大,目前临床治疗晚期卵巢癌患者的方法主要是手术联合化疗,但是1~2年内的复发率高达70%~80%[1]。奥拉帕利为聚腺苷二磷酸核糖聚合酶(Poly ADP ribose polymerase,PARP)抑制剂,是通过抑制PARP介导的DNA修复通路起到杀死肿瘤细胞作用的靶向治疗药物[2]。PARP抑制剂的不良反应较传统的抗肿瘤药物轻微[3],但目前国内相关文献报道较少。因此,本研究收集我院2020年7月-2021年6月使用奥拉帕利的卵巢癌患者的病历资料,回顾性分析其使用的合理性和安全性。
1 资料与方法
1.1 一般资料 选择我院2020年7月-2021年6月诊断为卵巢癌的患者,入组标准:①≥18岁;②给药前28 d内,器官和骨髓功能均正常者;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)全身功能状态(Physical Statos,PS)评分为0~2分者;④预期寿命≥16周者[4]。排除标准:①患者在研究期间失访或无法积极配合者;②在研究期间更改治疗方案或治疗中断。结果符合入组标准的患者共有43例。
1.2 合理性评价标准 以国内药品说明书(2018版)作为主要评价标准,参考由“中华医学会妇科肿瘤学分会”编写的《卵巢癌PARP抑制剂临床应用指南(2022版)》[5],来评价奥拉帕利的适应证和用法用量的合理性。①适应证:适用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗;②用法用量:奥拉帕利片(Abbvie Deutschland GmbH & Co.KGAbbvie Limited,150 mg),推荐剂量为300 mg,每日2次,相当于每日总剂量为600 mg。应在含铂化疗结束后的8周内开始本品治疗,持续治疗直至疾病进展或发生不可接受的毒性反应。不推荐与强效或中效CYP3A抑制剂合用,必须合用强效CYP3A抑制剂时,剂量减至100 mg,每日2次;必须合用中效CYP3A抑制剂时,剂量减至150 mg,每日2次。轻度肝肾功能损害无需调整剂量,中度肝功能损害无需调整剂量,中度肾功能损害推荐剂量200 mg,每日2次;重度肝肾功能损害者不推荐使用。老年患者(>65岁)无需调整起始剂量。
1.3 安全性评价标准
1.3.1 不良反应分级 按不良事件常用术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)[6]将发生的不良反应(Adverse drug reaction,ADR)进行分级评价。根据国家药品不良反应监测中心“ADR关联性评价标准”进行ADR相关性评价。
1.3.2 血液学不良反应观察指标 收集患者应用奥拉帕利期间的血常规结果,按照表1的血液学不良反应指标进行评价[6-7]。

表1 血液学不良反应指标分级
1.3.3 奥拉帕利剂量调整[6-7]服用奥拉帕利发生血液学方面ADR的具体处理方法详见表2。剂量调整:口服起始剂量为300 mg,2次/d;第1次减量时,给予250 mg,2次/d;第2次减量,推荐200 mg,2次/d;第3次发生ADR时,应当停药。
2 结果
2.1 一般资料 最终入组患者共43例,年龄43~72岁;国际妇产科联盟卵巢癌手术病理分期:Ⅱ期5例,Ⅲ期25例,Ⅳ期4例,其余9例患者具体病理分期不详。其中3例合并糖尿病,1例合并室性早搏。
2.2 用药合理性评价
2.2.1 适应证评价 本次研究对象全部为卵巢癌患者,均符合国内说明书的适应证。
2.2.2 用法用量评价 43例患者均为口服给药,其中9例患者使用奥拉帕利存在不合理情况,均为用法用量问题,表现为初始给药剂量不适宜、剂量调整不适宜和未及时停药。详见表3。
2.3 用药安全性观察 共有36例患者出现ADR,其中30例次表现为血液学ADR(白细胞/中性粒细胞减少、贫血、血小板减少),15例发生胃肠道反应,5例患者在用药后出现疲劳、乏力症状,相关性评价为“很可能”;3例患者有肝肾功能异常,因为此前长期使用含铂类化疗药,相关性评价为“可能”。详见表4。

表2 发生血液学不良反应处理方法

表3 奥拉帕利用法用量不适宜情况
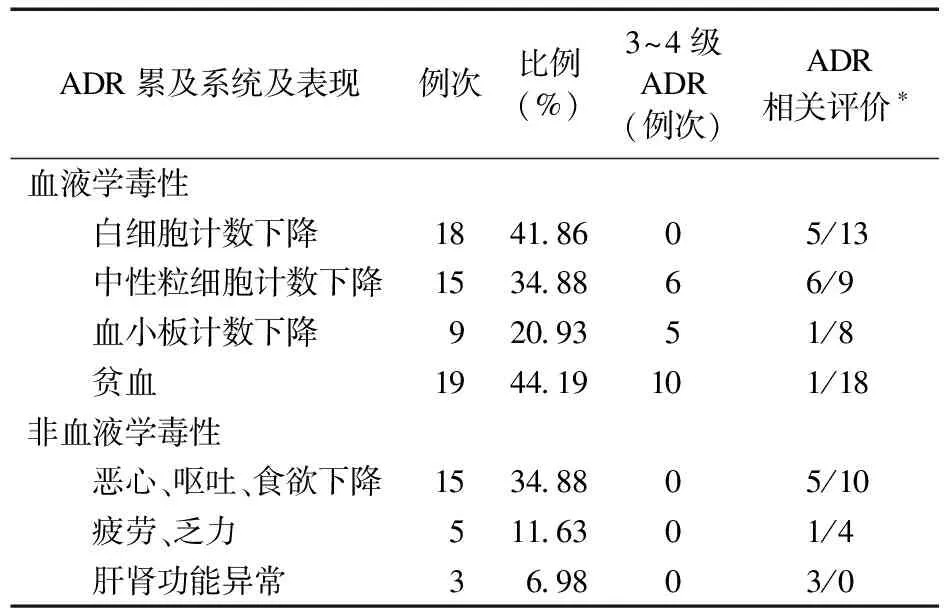
表4 奥拉帕利引起的不良反应表现及分布
3 讨论
奥拉帕利作为我国最早上市的PARP抑制剂,在我院妇科肿瘤患者尤其是卵巢癌患者中广泛使用。本研究中的43例口服奥拉帕利的卵巢癌患者均已使用过含铂类制剂的一线治疗方案,为铂敏感复发的卵巢癌患者,使用奥拉帕利作为维持治疗。但随着临床应用的增加,其合理性和安全性问题也随之增多。
3.1 合理性研究
3.1.1 适应证适宜性分析 奥拉帕利最早于2014年12月由美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市。2018年8月中国国家药品监督管理局(National Medical Products Administration,NMPA)首次批准上市奥拉帕利,适应证为卵巢癌、输卵管癌和原发性腹膜癌。多项研究表明,奥拉帕利可以显著提高铂类敏感复发患者的客观缓解率(Objective response rate,ORR),延长无进展生存时间(Progression-free survival,PFS),降低疾病进展或死亡的风险[8-9]。本研究选取的患者均为卵巢癌确诊患者,符合药品说明书的适应证。
3.1.2 用法用量适应证分析 奥拉帕利的给药剂量和发生ADR后是否进行剂量调整或停药,有规范的给药标准[5,7]。本研究显示,9例(20.93%)患者在口服奥拉帕利时存在给药剂量不合理的现象。其中2例给药频次为1次/d,奥拉帕利多项国外Ⅱ~Ⅲ期临床试验设计[8-10],以及国内说明书的用法用量中均为每日给药2次。2例初始给药剂量偏小(分别为200 mg和150 mg,均为2次/d给药),以上均不符合说明书中的推荐用量,每日给药总剂量偏少,不能达到治疗效果。
另有5例不合理现象为发生血液学ADR时给药剂量调整不合理,表现轻微无需减量,或者需要减量时未及时进行剂量调整。例如,1例患者给予奥拉帕利起始剂量为300 mg,2次/d,服用1周后查血常规:RBC 3.3×109/L,Hb 111 g/L,调整剂量为早300 mg,晚150 mg。临床药师分析:根据表2,患者属于轻度白细胞减少,并无奥拉帕利减量指征,而且该患者的剂量调整无标准可依。与之相反的是另1例患者,按照说明书给予奥拉帕利起始剂量300 mg,2次/d,口服3个月后,发生骨髓抑制,查血常规:WBC 1.7×109/L,NE 0.7×109/L,Hb 59 g/L,PLT 95×109/L,给予升白治疗,并于3 d内2次输悬浮红细胞各1.5 U,第6天血常规各项指标恢复正常后,予患者奥拉帕利450 mg,1次/d。根据表1、表2,临床药师分析该患者口服奥拉帕利后发生4级血液学ADR,应当暂停给药,对症治疗(给予升白、输注红细胞)视为合理;但药物剂量调整不符合指南推荐,应在血常规恢复正常后,按照第1次减量至250 mg,2次/d,口服给药。
奥拉帕利大部分3~4级不良反应为血液学ADR[5],是导致减量、中断和停止用药的最主要原因,终止治疗的患者比例为5.9%~12%[10],但大部分患者可长期用药维持治疗。奥拉帕利作为一种口服靶向药物,已经列入医保范围,患者经济负担减轻,且该药给药方法简单,容易接受,依从性高。但是需要注意的是,其不合理使用率仍然较高,本研究显示,不合理使用现象主要表现为给药剂量、频次、剂量调整等方面,也反映出口服靶向药物使用的随意性,以及临床医生对奥拉帕利的不熟悉。临床医生随意地调整奥拉帕利剂量并不能减轻ADR,反而可能因为剂量不足而导致治疗效果不佳,或者因未能及时停药而发生3级以上ADR,致使患者病情加重或延长住院时间。
3.2 安全性研究 本次研究结果显示,奥拉帕利的ADR主要表现为血液学ADR[5]。在接受奥拉帕利治疗的43例患者中,ADR的发生率为83.72%(36/43),3级及以上的ADR占41.86%(18/43),均为血液学ADR。以上结果与江文静等[4]的研究结果相似,但与国外学者的研究结果(口服奥拉帕利后97.95%的患者发生ADR,3~4级ADR发生率为36.41%)不一致[8,11]。笔者认为,可能与奥拉帕利使用方法便利、患者多为居家口服、未能及时检查血常规且未能及时得到相应处理有关。
本研究结果显示,奥拉帕利的血液学ADR表现为贫血、血小板减少和中性粒细胞减少。其中贫血最为常见,尤其是3级以上的严重贫血,这与Clarke等[12]和Bang等[13]的研究结果一致。血液学ADR常见于口服奥拉帕利的前3个月,随着治疗时间的延长,部分患者会逐渐恢复。但也有文献报道,治疗早期也容易发生3级及以上ADR,极易导致患者用药减量、中断或停药,使得奥拉帕利在临床应用上受限[14-15]。奥拉帕利引起贫血的发生率为21%~46%,3~4级贫血发生率为5.1%~22%[7]。奥拉帕利属于PARP抑制剂,PARP-1/PARP-2酶在细胞增殖、分化和转化过程中发挥重要作用,其中PARP-2在调节红细胞生成中具有重要意义[16]。有研究表明,PARP-2缺失会损伤小鼠红系细胞分化,增加溶血反应,导致贫血[17]。也有学者认为,PARP抑制剂对肿瘤细胞和正常细胞无选择性,会干扰正常细胞的DNA修复途径,阻碍正常细胞的DNA修复,而致药物毒性(如骨髓抑制)增强[18]。以上可能是导致奥拉帕利易致贫血或严重贫血的原因。血液学毒性的处理方法具体见表2,在口服奥拉帕利治疗的第1个月,应每周监测血常规,第1年应每月监测,之后可改为定期监测。
本研究结果显示,胃肠道反应是奥拉帕利最常见的非血液学ADR,主要表现为恶心、呕吐,其症状均较轻微,为1~2级ADR,多发生于开始用药的第1~2个周期,这与国内学者李玲等[19]的研究结果一致。奥拉帕利致恶心的总体发生率为44%~73%,呕吐的总体发生率为34%~40%[7],本研究中恶心、呕吐的发生率为34.88%,与以上结果基本一致。口服奥拉帕利可能会刺激胃肠黏膜,恶心、呕吐多发生在治疗的早期,通常前2个周期比较严重,症状可逐渐消失[7]。对于确实无法耐受胃肠道反应者,可预防性使用止吐药物,避免长期使用类固醇或在急性病例中短期使用[20]。此外,睡前服用PARP抑制剂也有助于减少恶心、呕吐的发生[5]。对于通用不良事件术语标准(CTCAE) 2级以上不良反应经治疗后未能缓解,或出现3级以上不良反应,暂停给药至缓解,再次用药时考虑减量(特别是第2次暂停用药后)。若剂量已减至最低,而恶心呕吐仍持续者需停药[5]。
疲劳、乏力也是奥拉帕利常见的ADR,全部为1~2级,症状出现较早,大部分在用药后1周左右发生。奥拉帕利疲劳的总体发生率为42%~63%[7],疲乏可以随着治疗疗程的进展逐渐耐受或好转。需要注意的是,贫血、血小板减少可能会成为疲乏的诱因,应积极进行治疗。对于疲乏的患者,首选非药物治疗,例如消除诱因、多运动或借助按摩疗法缓解。若仍无改善或无法耐受时,可将奥拉帕利减量或暂停给药,待改善后继续口服。
3例患者服药后发生肝、肾毒性,其中1例表现为天冬氨酸氨基转移酶与丙氨酸氨基转移酶轻度升高,另外2例为血肌酐升高,3例患者此前均经过多疗程的含铂类药物联合化疗,虽然此次口服奥拉帕利前肝肾功能指标均在正常范围,但不能排除长期应用化疗药物对肝肾的毒性累积,也有可能为PARP抑制剂导致的肝肾损害,应引起临床重视。转氨酶的升高多为一过性,有自限性,随着治疗周期的延长,可逐渐恢复至正常水平[19]。发生肾功能损害的患者中,2例ADR为2级,与Pujade-Lauraine等[8]的结果一致(接受奥拉帕利治疗后有10.8%的患者出现1级或2级血肌酐升高,无3~4级升高)。血肌酐升高更可能是肾转运蛋白抑制的结果,而不是真正的肾小球滤过率下降或肾功能损害[19]。在口服奥拉帕利期间,应密切监测肾功能,及时调整或中断治疗方案。
奥拉帕利作为首个在中国获批上市的PARP抑制剂,是卵巢癌治疗的新药,已在临床被广泛使用,其使用的合理性和安全性应当引起临床医务人员的重视,尤其是安全性方面。卵巢癌患者多为中老年女性,其自身的基础疾病较多,在用药前应当严格掌握奥拉帕利适应证,充分评估患者的造血功能、肝肾功能,用药前积极对患者进行用药教育,加强对血液学指标和肝肾功能指标的监测,及时发现并处理相关ADR,规范调整给药剂量,降低临床用药风险。
