转基因抗虫耐除草剂玉米瑞丰125 Cry1Ab/Cry2Aj杀虫蛋白的时空表达分析
2023-02-02李东阳肖冰王晨尧杨现明梁晋刚吴孔明
李东阳 肖冰 王晨尧 杨现明 梁晋刚 吴孔明
(1.农业农村部科技发展中心,北京 100176;2.中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193;3.中国农业科学院棉花研究所 棉花生物学国家重点实验室,安阳 455000;4.中国农业科学院农业资源与农业区划研究所,北京 100081)
玉米(Zea mays)是我国最重要的粮食作物之一,也是畜牧业和饲料工业的主要原料,玉米产业的健康发展是国家粮食安全和农产品有效供给的重要保障[1-2]。在整个生育期内,玉米会受到多种害虫的为害,严重影响其产量和品质[3-5]。其中,亚洲玉米螟(Ostrinia furnacalis)是玉米生产中的主要害虫之一,在我国各玉米产区均有不同程度的发生,常年发生面积2 000 万hm2以上[6-8]。室内生测和田间抗性鉴定结果表明,转基因抗虫玉米对亚洲玉米螟具有很好的杀虫效果和田间抗螟性[9-11]。转基因抗虫玉米新品种不仅是防治农业害虫的有效途径之一,而且有利于保护生态环境、提高农民收入[3-4,12-13]。自1996年转基因抗虫玉米首次商业化种植以来,全球已有超过200 个转基因抗虫玉米转化事件被批准商业化生产。根据国际农业生物技术应用服务组织(International Service for the Acquisition of Agri-biotech Applications,ISAAA)的统计数据,2019年,全球31%的玉米是转基因玉米,其中抗虫玉米和抗虫耐除草剂玉米种植面积5 590 万hm2[1-15]。我国是玉米的主要生产国和消费国,对转基因玉米的研究一直都是研究热点[16]。
转基因作物中外源Bt 杀虫蛋白在特定器官和特定时间的表达具有明显的时空动态变化规律,且地域、环境等因素对外源杀虫蛋白表达有一定的影响[9,17-21]。转Bt基因抗虫玉米的抗虫性强弱与植株体内的外源杀虫蛋白含量密切相关,因此,准确定量出Bt 杀虫蛋白在不同生育期和不同器官中的表达量,对于未来转Bt基因抗虫玉米产业化后的害虫防治和农业转基因生物安全管理具有重要意义[11,22]。
转cry1Ab/cry2Aj和g10evo-epsps基因抗虫耐除草剂玉米瑞丰125,是由杭州瑞丰生物科技有限公司/浙江大学共同研发的转基因玉米转化事件,2020年1月21 号获得了在北方春玉米区的农业转基因生物安全证书(生产应用),是国产转基因玉米的重要代表。瑞丰125 及相关衍生品系如能顺利产业化,将为亚洲玉米螟、黏虫(Mythimna separata)等玉米主要鳞翅目害虫的防治提供可供选择的新途径,降低玉米种植成本,提升我国玉米竞争力。
为了明确瑞丰125 在不同地域、不同环境中的Bt 杀虫蛋白的表达规律,本文以转基因抗虫耐除草剂玉米瑞丰125 和对照非转基因玉米宏硕899 为研究对象,采用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)全面分析了不同地区种植环境下,Cry1Ab/Cry2Aj 杀虫蛋白的表达量及变化规律。
1 材料与方法
1.1 材料
转基因抗虫耐除草剂玉米瑞丰125 及非转基因对照玉米宏硕899 均由浙江大学/杭州瑞丰生物科技有限公司提供。瑞丰125 同时表达Cry1Ab/Cry2Aj和G10evo-EPSPS 蛋白,具有抗虫和耐除草剂两种特性。
1.2 方法
1.2.1 试验设计 两个玉米品种分别在我国玉米种植区的9 个地点按照结构庇护所方式进行种植,种植和栽培方式均采用当地常规耕作管理的模式进行,本试验连续进行两年。9 个地点分别为:黑龙江哈尔滨(45°44'N,126°42'E)、吉林长春(43°48'N,125°24'E)、辽宁沈阳(41°49'N,123°33'E)、河北廊坊(39°51'N,116°60'E)、山东烟台(37°29'N,121°16'E)、河南新乡(35°10'N,113°41'E)、湖北武汉(30°44'N,114°46'E)、贵州贵阳(26°38'N,106°38'E)、新疆库尔勒(41°45'N,86°12'E)。
瑞丰125 和宏硕899 两种玉米材料各设3 次重复,每个小区面积为200 m2(20 m×10 m),行距60 cm,株距25 cm,小区之间的间隔为1-1.5 m。
1.2.2 田间取样 在玉米生长的不同时期,即拔节期(V6-V8)、抽雄期(VT)、吐丝期(R1)、成熟期(R4)等时期取样,小区内50%以上的植株进入相应生育期时,判断为该小区到达相应采样时间。每小区3点取样,每点选取1 株进入相应时期的玉米植株,按不同部位分类采集样品,同一小区同一部位样品剪碎混合。
采集的玉米组织样品放入自封袋中,然后立即放入盛有干冰的泡沫盒内,带回室内转入-80℃冰箱保存。玉米各组织具体采样方法如下:(1)叶片:选取幼嫩叶片,从叶片顶端开始截取20 cm 叶片,随后剪成2.5 cm 小段;(2)雄穗:1 株玉米选取1个雄穗,随后剪成2.5 cm 小段;(3)花丝:雌穗套袋,将雌穗连同套袋一起拿到无花粉的环境中,将花丝从雌穗上剪下,剪成2.5 cm 小段;(4)籽粒:在同一植株上随机采集15 粒大小一致的幼嫩籽粒。
1.2.3 Cry1Ab/Cry2Aj 杀虫蛋白表达量测定 采用Cry1Ab/Cry1Ac 酶联免疫(ELISA)定量检测试剂盒(Envirologix,Portland,USA,货号10433)测定Cry1Ab/Cry2Aj 融合杀虫蛋白的含量,按照说明书操作,具体方法参考Zhang 等[23]的研究,本研究中瑞丰125 中外源杀虫蛋白Cry1Ab/Cry2Aj 含量以Cry1Ab 杀虫蛋白含量为代表计为μg/g 鲜重。
首先使用Retsch MM400 组织破碎仪(Retsch GmbH,Haan,Germany)将所有样本在低温下粉碎为粉末,然后保存在-80℃冰箱中。称取0.4 g 组织粉末加入4 mL 提取液PBST(pH 为7.4、浓度为0.01 mol/L 的PBS+0.55% Tween 20),置于摇床上4℃过夜;12 000 r/min 离心15 min,取上清液,用提取液适量稀释;将Cry1Ab 标准品梯度稀释,在96 孔酶标板每孔加入50 μL enzyme-conjugate Cry1Ab 后,分别加入50 μL 样品、阴性对照和标准品,用封口膜将酶标板封闭,轻摇混匀20-30 s,置于摇床上(200 r/min)1-2 h;用力弃去液体后,每孔加入200 μL 洗涤液,反复洗涤3 次后用吸水纸吸干;每孔加入100 μL 显色底物,用封口膜将酶标板密封,外覆锡箔纸避光,轻摇混匀20-30 s,室温放置15-30 min;每孔加入100 μL 终止液终止反应,用Infinite M200 Pro 酶标仪(Tecan,Männedorf,Switzerland)在450 nm 波长下测定OD 值。
1.2.4 数据分析 根据试验数据,采用SPSS 25.0 统计软件(SPSS Inc.,Chicago,USA)进行方差分析,分析方法采用One-way ANOVA,多重比较方法采用LSD 法。
2 结果
2.1 瑞丰125不同器官中Cry1Ab/Cry2Aj杀虫蛋白表达量
ELISA 测定结果表明,对照玉米宏硕899 中未检出Cry1Ab/Cry2Aj 杀虫蛋白;瑞丰125 在2019年各处理试验中Cry1Ab/Cry2Aj 杀虫蛋白含量为0.590-6.716 μg/g 鲜重(表1),在2020年各处理试验中Cry1Ab/Cry2Aj 杀虫蛋白含量为0.326-11.133 μg/g 鲜重(表2)。
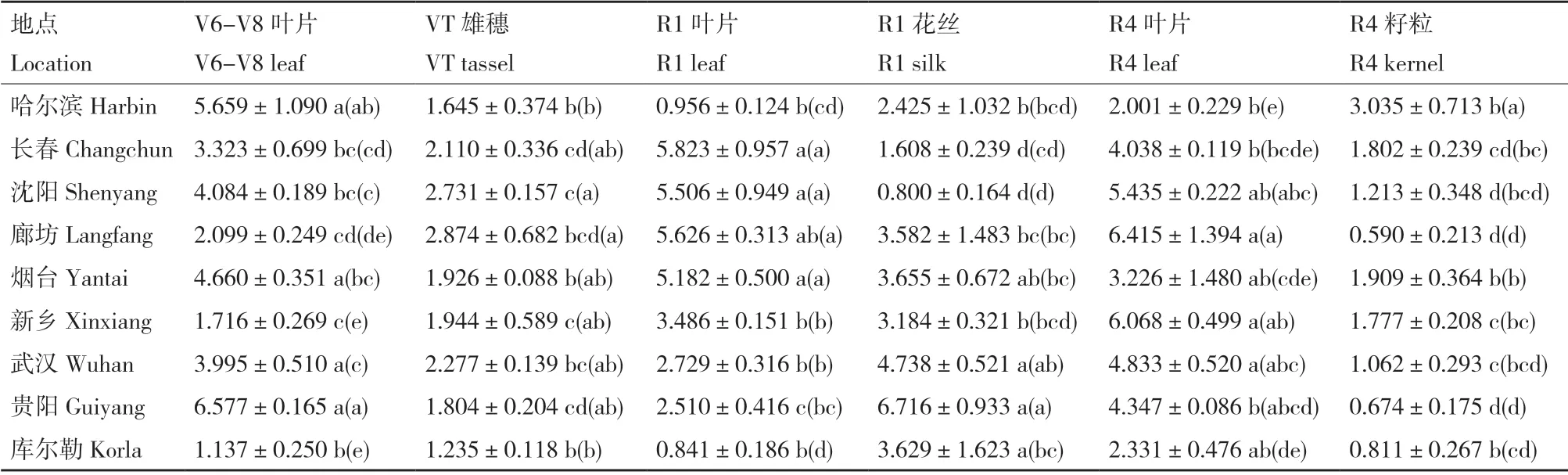
表1 瑞丰125 各生育期不同器官中Cry1Ab/Cry2Aj 杀虫蛋白表达量Table 1 Cry1Ab/Cry2Aj insecticidal protein expressions of Ruifeng 125 in different tissues at different growth stages(2019)
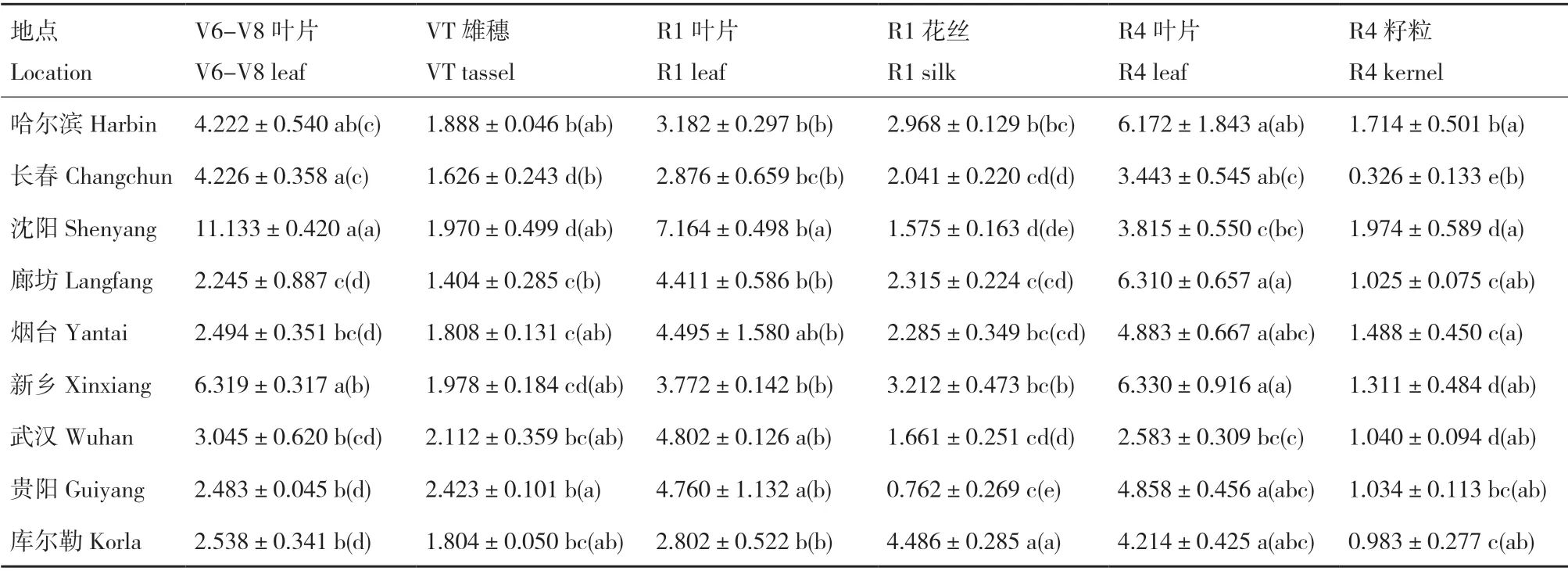
表2 瑞丰125 各生育期不同器官中Cry1Ab/Cry2Aj 杀虫蛋白表达量Table 2 Cry1Ab/Cry2Aj insecticidal protein expressions of Ruifeng 125 in different tissues at different growth stages(2020)
在两年的试验中,2019年的廊坊、烟台、新乡和2020年的哈尔滨、长春、沈阳、廊坊、烟台、新乡的Cry1Ab/Cry2Aj 杀虫蛋白含量均呈现叶片>花丝>雄穗>籽粒的趋势;2019年的武汉、贵阳、库尔勒和2020年的库尔勒的Cry1Ab/Cry2Aj 杀虫蛋白含量均呈现花丝>叶片>雄穗>籽粒的趋势;2019年的长春和2020年的武汉的Cry1Ab/Cry2Aj 杀虫蛋白含量均呈现叶片>雄穗>花丝>籽粒的趋势;2019年的沈阳和2020年的贵阳的Cry1Ab/Cry2Aj 杀虫蛋白含量均呈现叶片>雄穗>籽粒>花丝的趋势;2019年的哈尔滨的Cry1Ab/Cry2Aj 杀虫蛋白含量呈现籽粒>叶片>花丝>雄穗的趋势。整体上看,各地点种植的瑞丰125 呈现出叶片中Cry1Ab/Cry2Aj 杀虫蛋白含量较高,而籽粒中Cry1Ab/Cry2Aj 杀虫蛋白含量较低的规律。
对于瑞丰125 在不同地点的Cry1Ab/Cry2Aj 杀虫蛋白含量表达情况,2019年的结果显示,V6-V8叶片中贵阳、哈尔滨的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,VT 雄穗中廊坊、武汉、沈阳的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R1 叶片中长春、廊坊、沈阳的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R1 花丝中贵阳、武汉的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R4 叶片中廊坊、新乡的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R4 籽粒中哈尔滨的Cry1Ab/Cry2Aj 杀虫蛋白含量较高。2020年的结果显示,V6-V8 叶片中沈阳、新乡的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,VT雄穗中贵阳、武汉的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R1 叶片中沈阳、烟台的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R1 花丝中库尔勒、新乡的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R4 叶片中新乡、廊坊的Cry1Ab/Cry2Aj 杀虫蛋白含量较高,R4 籽粒中沈阳的Cry1Ab/Cry2Aj 杀虫蛋白含量较高。整体上看没有明显的空间变化规律。
为了从整体上明确瑞丰125 不同器官之间Cry1Ab/Cry2Aj 杀虫蛋白表达量的规律,将9 个地点的数据平均后进行统计分析,结果如图1所示。2019年和2020年的Cry1Ab/Cry2Aj 杀虫蛋白含量数据均表现出R4 叶片>V6-V8 叶片>R1 叶片>R1 花丝>VT 雄穗>R4 籽粒的趋势,R4 叶片Cry1Ab/Cry-2Aj 杀虫蛋白含量为4.299 μg/g 鲜重(2019年)/4.734 μg/g 鲜重(2020年),R4 籽粒Cry1Ab/Cry2Aj 杀虫蛋白含量为1.430 μg/g 鲜重(2019年)/1.210 μg/g 鲜重(2020年)。对于V6-V8、R1、R4 三个时期的叶片,Cry1Ab/Cry2Aj 杀虫蛋白表达量随着生育期的延长,有略微的增长,但3 个时期之间的Cry1Ab/Cry2Aj 杀虫蛋白表达量均没有显著性差异(P>0.05)。
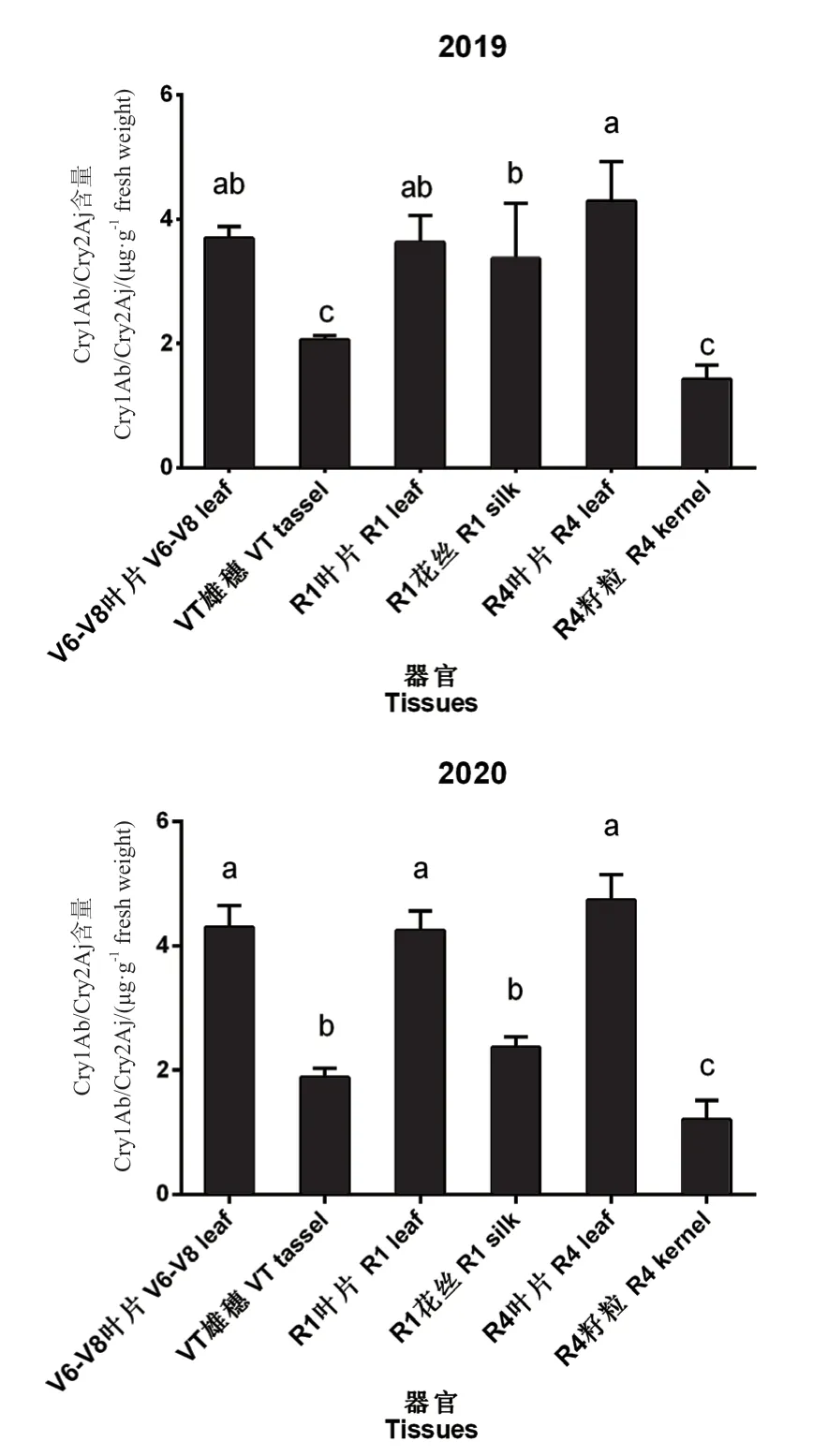
图1 瑞丰125 不同生育期的不同器官中Cry1Ab/Cry2Aj杀虫蛋白表达量Fig.1 Cry1Ab/Cry2Aj insecticidal protein expressions of Ruifeng 125 in different tissues at different growth stages
2.2 不同地点种植的瑞丰125Cry1Ab/Cry2Aj杀虫蛋白表达量
为了从整体上明确在不同地点种植的瑞丰125Cry1Ab/Cry2Aj 杀虫蛋白表达量的变化规律,将9 个地点各器官样品Cry1Ab/Cry2Aj 杀虫蛋白表达量平均后进行统计分析,结果如图2所示。在不同地点种植的瑞丰125Cry1Ab/Cry2Aj 杀虫蛋白表达量有差异,但整体差异较小。2019年各个地点Cry1Ab/Cry2Aj杀虫蛋白表达量范围为1.664-3.771 μg/g鲜重,贵阳高于其他地区,但与长春、沈阳、廊坊、烟台、武汉没有显著性差异,库尔勒显著低于其他地区。2020年各个地点Cry1Ab/Cry2Aj 杀虫蛋白表达量范围为2.423-4.605 μg/g 鲜重,沈阳显著高于其他地区,长春、武汉低于其他地区,但与廊坊、烟台、贵阳、库尔勒没有显著性差异。
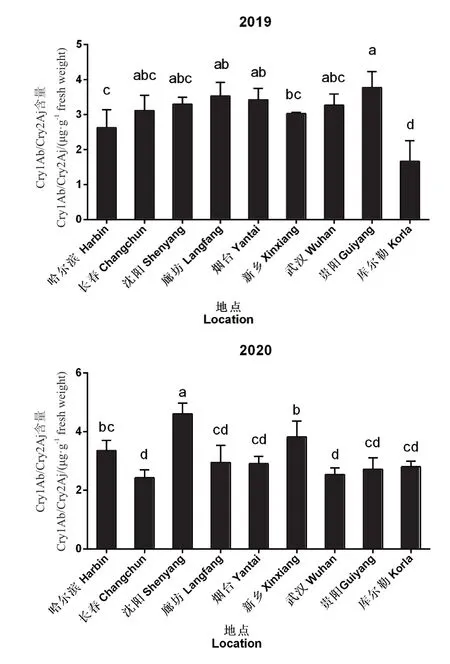
图2 瑞丰125 在不同地点的Cry1Ab/Cry2Aj 杀虫蛋白表达量Fig.2 Cry1Ab/Cry2Aj insecticidal protein expressions of Ruifeng 125 in different locations
3 讨论
在转Bt基因抗虫玉米中,Bt 杀虫蛋白的表达量可能因组织类型、发育时期和环境状况而异[24],了解Bt 杀虫蛋白表达量的时空动态变化规律对害虫的综合防治和农业转基因生物安全评价管理具有重要意义。本研究通过测定在9 个地点种植的转基因抗虫玉米瑞丰125 在各生育期不同器官Cry1Ab/Cry2Aj杀虫蛋白表达量,明确了瑞丰125Bt 杀虫蛋白表达量的时空变化规律,有利于为其未来的商业化推广和安全管理提供数据参考。
2019-2020 两年的试验结果表明,瑞丰125Cry1Ab/Cry2Aj 杀虫蛋白表达量在不同的玉米器官中差异较大,整体上看,叶片中Cry1Ab/Cry2Aj 杀虫蛋白表达量较高而籽粒中Cry1Ab/Cry2Aj 杀虫蛋白表达量较低,随着作物生长,叶片中Cry1Ab/Cry2Aj杀虫蛋白表达量略有上升,结果与前人研究结果一致[11,25-28]。孙红炜等[11]研究发现,转cry1Ab /cry2Aj和g10evo-epsps基因玉米双抗505-12-5 在玉米大喇叭口期、吐丝期、乳熟期,心叶中的Bt 杀虫蛋白含量均高于根、茎。Liang 等[25]研究发现,不同地点种植的转cry1Ab和epsps基因抗虫耐除草剂玉米DBN9936,叶片Bt 杀虫蛋白含量高于花丝、雄穗、籽粒,籽粒中Bt 杀虫蛋白含量较低。Trtikova 等[26]研究发现,转基因抗虫玉米MON810 叶片、根部、茎秆、籽粒之间的Bt 杀虫蛋白含量差异较大,组织之间Bt 杀虫蛋白含量水平为叶片>根>茎>籽粒>花粉,且Bt 杀虫蛋白含量随生长时期延长而逐渐增加。刘允军和王国英对转基因抗虫玉米97Y6 Cry1A杀虫蛋白的含量进行了分析发现,叶片Bt 杀虫蛋白含量显著大于其他组织,且随生育期呈增加趋势[27]。Bilbo 等[24]测定了DKC64-24 等6 个转基因抗虫玉米品种的不同组织Bt 杀虫蛋白含量,发现Cry1F、Cry2Ab2 杀虫蛋白含量在玉米叶尖大于花丝、籽粒,且不同年份之间有一定差异。Darvas 等[28]对转基因抗虫玉米MON810 进行测定发现,花丝中Cry1Ab含量低于叶片、茎秆。
本研究发现在9 个地点种植的瑞丰125 的Cry1Ab/Cry2Aj 杀虫蛋白表达量有差异,但整体差异较小。2019年有6 个地点的瑞丰125 的Cry1Ab/Cry2Aj 杀虫蛋白表达量没有显著性差异,2020年有7 个地点的瑞丰125 的Cry1Ab/Cry2Aj 杀虫蛋白表达量没有显著性差异,两年中仅有个别地点出现偏高或偏低的情况。不同地点Bt 杀虫蛋白表达量之间存在的差异可能与当地气候条件、土壤状况、耕作措施等有关。如Trtikova 等[26]研究表明转基因抗虫玉米品系PAN 6Q-321B 和 PAN 6Q-308B(均为MON810 衍生品系)在冷/湿应激下的Bt 杀虫蛋白表达量增加了4 倍,表明Cry1Ab 杀虫蛋白表达水平与水分和温度条件有关。王家宝等[29]以3 个转Bt基因棉花品种鲁棉研15 号、鲁S6177 和新棉33B为研究对象,发现3 个品种转基因抗虫棉花的主茎老叶的Bt 杀虫蛋白含量在追肥处理后增加29.7%,3 个品种转基因抗虫棉花的功能主茎叶、幼蕾、主茎老叶的Bt 杀虫蛋白含量在积水处理后分别下降27.7%、29.9%、6.6%,新棉33B 的功能主茎叶、幼蕾、主茎老叶的Bt 杀虫蛋白含量在干旱处理之后分别下降30.0%、37.0%、52.9%。Marquardt 等[30]发现土壤中氮含量与转Bt基因抗虫玉米DeKalb 61-19的Cry3Bb1 杀虫蛋白表达量有一定的正相关性。Griffiths 等[31]发现转Bt基因抗虫玉米MEB307Bt(MON810 衍生品系)中的Cry1Ab 杀虫蛋白表达量在不同类型土壤中具有显著性差异,且不同时期的叶片中Cry1Ab 杀虫蛋白表达量在施用溴氰菊酯后均显著增加。由于本研究的9 个地点之间气候条件、土壤状况等相差较大,而且测定环境、取材方法、人员操作习惯、样品储存环境等均会对测定结果产生一定影响,导致不同地点的Bt 杀虫蛋白表达量之间存在微小差异,个别地点如贵阳、库尔勒、沈阳在试验中出现Bt 杀虫蛋白表达量偏高或偏低的情况。
亚洲玉米螟、黏虫等鳞翅目害虫是我国玉米生产上最严重的生物胁迫问题,玉米螟在东北春玉米区和新疆南疆等地主要为1、2 代危害,在黄淮海夏玉米区主要为3 代危害,黏虫主要以2、3 代连续危害[8],瑞丰125 在拔节期(V6-V8)、吐丝期(R1)、成熟期(R4)的叶片中Bt 杀虫蛋白表达量相对较高,有利于对1、2 代玉米螟和黏虫的防治。本研究中测定的籽粒、花丝、雄穗等玉米繁殖器官的Bt 杀虫蛋白含量略低于叶片,与前人研究结果一致,但相关的抗虫试验表明瑞丰125 无论是在心叶期还是穗期,对玉米螟、黏虫均具有高抗水平[11,32]。翁绿水等[20]在对抗虫水稻Bt 杀虫蛋白的研究中指出,虽然Bt 杀虫蛋白表达量在不同时期、不同组织中存在差异,但目前研发的抗虫植物品种足以有效控制目标害虫的危害。但由于植物中Bt 杀虫蛋白表达规律的复杂性,未来的研究中抗虫性生物测定也是不可或缺的。除此之外,9 个不同地点种植的瑞丰125的Cry1Ab/Cry2Aj 杀虫蛋白表达量整体差异较小,表示瑞丰125 可能在不同的玉米生产区具有相对一致的害虫防治效果,对其产业化具有重要意义。
转Bt基因抗虫玉米中的Bt 杀虫蛋白表达量受各种因素影响,导致Bt 杀虫蛋白在时间上和空间上的分布不均匀,而低剂量的Bt 杀虫蛋白可能会增加靶标害虫的生存几率,引起靶标害虫的抗性风险增加[24]。靶标害虫对Bt 杀虫蛋白的抗性问题是对影响Bt 作物可持续推广的最大因素,靶标害虫的抗性治理是转基因玉米生产应用的重要环境问题[33]。为了实现转基因作物的可持续应用,有效阻止或延缓靶标害虫抗性种群的发生,各国科学家提出了抗性治理策略IRM(insect resistance management),目前应用最广泛的主要有“高剂量/庇护所”(high dose/refuge)策略和“多基因”(pyramid)策略[34]。在“高剂量/庇护所”策略中,在Bt 作物周边种植一定面积的非Bt 作物,提供足够数量的敏感个体,与来自Bt 作物区存活的少量抗性纯合子个体进行自由交配,产生的杂合子个体后代能被高剂量表达Bt杀虫蛋白的抗虫作物杀死,达到稀释抗性基因的目的[35]。转Bt基因玉米表达高剂量Bt 杀虫蛋白是策略成功实施的关键。高剂量Bt 杀虫蛋白能够杀死靶标害虫中的100%隐性敏感纯合(ss)个体和99%抗性杂合(sr)个体,仅有抗性纯合(rr)个体可能存活[32,36-39]。“高剂量/庇护所”策略主要分为3 种形式:结构庇护所(structured refuges)、种子混合庇护所(seed blends)、自然庇护所(natural refuge)。结构庇护所为Bt 作物和非Bt 作物分别以块状模式种植来降低害虫的抗性进化速度,种子混合庇护所为种植之前均匀混合Bt 作物种子和非Bt 作物种子,自然庇护所是指可以提供敏感害虫的杂草或其他栽培植物[40]。在“多基因”策略中,在同一株植物中同时导入两个或多个没有交互抗性的针对同一靶标害虫的抗虫基因,使得转基因植物产生抗性的风险减小,可有效延缓抗性的产生和发展[36-37,40]。瑞丰125 可以同时表达Cry1Ab 和Cry2Aj 两种不同类型的杀虫蛋白,与仅含单一Bt 杀虫蛋白的植株相比,这种“多基因”作物对害虫的抗性治理起到积极的作用。
4 结论
转cry1Ab/cry2Aj和g10evo-epsps基因抗虫耐除草剂玉米瑞丰125 的Cry1Ab/Cry2Aj 杀虫蛋白呈现出叶片中表达量较高,而籽粒中表达量较低的规律,不同地点种植的瑞丰125 的Cry1Ab/Cry2Aj 杀虫蛋白表达量有所差异,但差异整体较小,表明瑞丰125 具有良好的应用前景。本研究可为未来瑞丰125 的商业化推广、构建Bt 玉米防控技术体系、庇护所策略实施、安全管理等提供数据支撑和参考。
