七烯甲萘醌合成过程中关键蛋白的定位分析
2023-02-02陈奇张智航夏洪志孙怡金柯吕雪芹崔世修刘龙
陈奇,张智航,夏洪志,孙怡,金柯,吕雪芹,崔世修,刘龙*
1(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学,未来食品中心,江苏 无锡,214122) 3(南通励成生物工程有限公司,江苏 南通,226010)
维生素K2是一类重要的脂溶性维生素,根据侧链异戊二烯基数目的不同,可以分为多种亚型,如四烯甲萘醌(menaquinone-4, MK-4)、七烯甲萘醌(menaquinone-7, MK-7)、八稀甲萘醌(menaquinone-8,MK-8)等[1]。维生素K2在治疗骨质疏松和心血管硬化等疾病中发挥重要作用[2]。目前,维生素K2主要通过微生物发酵的方法获取。菌种之间生理特性存在差异,导致不同的菌种合成的维生素K2类型不同,比如大肠杆菌(Escherichiacoli)主要合成MK-4和MK-8[3],芽孢类细菌主要合成MK-7[4]。在维生素K2的众多亚型中,MK-7在人体内的半衰期更长,具有良好的亲和性[1],且近期有研究表明MK-7能够降低发生线粒体功能障碍与帕金森疾病的风险[5]。这些重要的功能使MK-7受到了越来越多的重视,但其生产效率的低下限制了其产业化的进程。
MK-7的结构由2-甲基-(1,4)-萘醌核(1,4-dihydroxy-2-naphthoic acid,DHNA)及C-3位的脂肪侧链(C35)组成。在原核生物中,DHNA是由分支酸经过7步催化获得,侧链由丙酮酸和甘油醛-3-磷酸经过甲基赤藓糖醇-4-磷酸途径(methylerythritol-4-phosphate pathway, MEP pathway)获得[6]。在1,4-二羟基-2-萘甲酸异戊二烯基转移酶(1,4-dihydroxy-2-naphthoic acid prenyltransferase, MenA)的作用下将侧链转移到DHNA的C2的位置上,形成2-脱甲基甲萘醌[7]。然后,在甲基转移酶(methyltransferase,MenH)的作用下在C3的位置上增加一个甲基,最终生成MK-7[8](图1)。很多研究通过增加menA的表达量实现维生素K2的高效合成,比如在E.coli中组成型过表达menA和menD,相比于野生型菌株,八烯甲萘醌的产量提高了5倍[3]。在纳豆芽孢杆菌(Bacillussubtilisnatto)中,HU等[9]确定了D78、D84、D208和D212位天冬氨酸在保持MenA活性发挥重要作用,并通过定点突变技术获得Q67R突变体,提高MenA活力,促进了MK-7的合成。在枯草芽孢杆菌(Bacillussubtilis)中,通过在不同位点增加menA开放阅读框的拷贝数,MK-7的产量达到75 mg/L,相比于出发菌株提高了约2.3倍[10]。尽管MenA在MK-7的合成过程中起到重要作用,但是对MK-7合成途径中关键基因性质的研究还较少,限制了MK-7产量的进一步提高。
研究表明MK-7是细胞膜的组成成分[11],在电子传递的过程中起到电子载体的作用[12],但是关于MK-7进出细胞膜的过程机制却缺少相关报告[13]。针对此问题,结合前期实验结果,我们发现MenA和MenH是MK-7合成途径过程中的关键酶,并且通过(http:// www.cbs.dtu.dk/services/TMHMM/)预测MenA和MenH的结构特点,发现MenA具有8个明显的跨膜结构域。为了确认MenA和MenH在细胞中的定位,我们将MenA、MenH与eGFP进行融合,通过绿色荧光蛋白分布确定MenA和MenH位于细胞膜中,进一步发现MenA和MenH在细胞膜上出现随机聚集的现象。实验结果表明,MenA与MenH位于细胞膜,并且MenH在细胞膜中呈现点状分布。然后,利用表面活性剂Triton-100能够破坏细胞膜结构的特性,验证细胞膜的完整性对MK-7合成的影响。在发酵培养基中的Triton-100体积分数为0.1%时,MK-7的合成受到明显的抑制。综上所述,细胞膜的完整性是合成MK-7的前提,位于细胞膜上的MenA和MenH对MK-7在细胞膜中的合成发挥重要作用。

图1 枯草芽孢杆菌中MK-7的合成途径Fig.1 Synthetic pathway of MK-7 in B.subtilis
1 材料与方法
1.1 菌株和质粒
本实验所用出发菌株为B.subtilis168,克隆菌株为E.coliJM109,穿梭质粒为pHT01。实验所用菌株、质粒全部保藏于本实验室。
1.2 重组菌株构建
以B.subtilis168的基因组为模板,扩增menA的开放阅读框(open reading frame, ORF),使用linker“GSGGGGS”将获得的ORF与egfp进行融合,然后构建在质粒pHT01上。利用同样的方式,分别构建其他蛋白与eGFP的重组表达质粒,使用天然启动子对menA基因进行表达,使用Pveg启动子对menH基因进行表达,用上述构建的质粒转化B.subtilis168,得到重组菌株。
1.3 荧光蛋白的检测
将重组菌株接种到LB培养基中,37 ℃下220 r/min培养12 h,然后8 000×g离心2 min收集菌体。在激光扫描共聚焦显微镜下观察荧光的分布,其中eGFP的激发波长为488 nm,接收波长507 nm。将获得的绿色荧光图片使用软件ImageJ 1.52进行处理。
1.4 MK-7的发酵
首先在14 mL圆底试管中加入3 mL LB培养基,接入获得的重组菌株置于37 ℃摇床,220 r/min过夜培养。按照3%的接种量,把过夜培养的种子接入发酵培养基中,放入避光的摇床,220 r/min,40 ℃培养,定时取样测量生长情况与MK-7的产量。发酵培养基的配方为(质量分数):5%葡萄糖,5%蔗糖,5%大豆蛋白胨,0.06% KH2PO4。为检测细胞膜对MK-7产量的影响,在发酵培养基中加入不同浓度的表面活性剂Triton-100,体积分数分别是0.05%,0.1%,0.2%,0.5%,1%。
1.5 MK-7的提取与检测
吸取发酵液到棕色离心管中,使用异丙醇和正己烷的混合物(体积比1∶2)以体积比4∶1的比例(有机物∶发酵液)萃取细胞中MK-7。将混合物用涡旋振荡器剧烈振荡10 min,然后以5 000×g离心5 min以分离有机相和水相,收集有机上清液用来检测MK-7含量。检测MK-7含量的仪器是配备有光子二极管阵列紫外检测器的高效液相色谱仪(Agilent 1260,Santa Clara,CA,USA),色谱柱为C18 ODS色谱柱(5 μm,250 mm×4.6 mm,Thermo Fisher Scientific,Waltham,MA,USA)检测波长为254 nm,柱温为40 ℃。甲醇∶二氯甲烷(体积比9∶1)用作流动相,流速为1 mL/min。MK-7校准曲线在1~100 mg/L呈线性关系(R2=0.998)。
2 结果与分析
2.1 基于生物信息学分析MenA和MenH
课题组前期在强化MK-7合成实验中,发现通过强化menA和menH的表达,能够明显促进MK-7的合成,从而确定menA是MK-7合成过程中的关键基因[10]。基于B.subtilis168的基因组数据,MenA的性质如下:MenA酶蛋白由311个氨基酸组成,其中带有负电荷氨基酸(Asp+Glu)的总共有14个,带有正电荷的氨基酸(Arg+Lys)总共有20个。MenA的分子质量为33.838 kDa,等电点为9.18,蛋白亲水性平均值(grand average of hydropathicity, GRAVY)为0.718。对MenA的跨膜结构进行预测(http:// www.cbs.dtu.dk/services/TMHMM/),结果如图2所示。MenA酶蛋白共具有8个跨膜结构,跨膜区集中在蛋白中部。
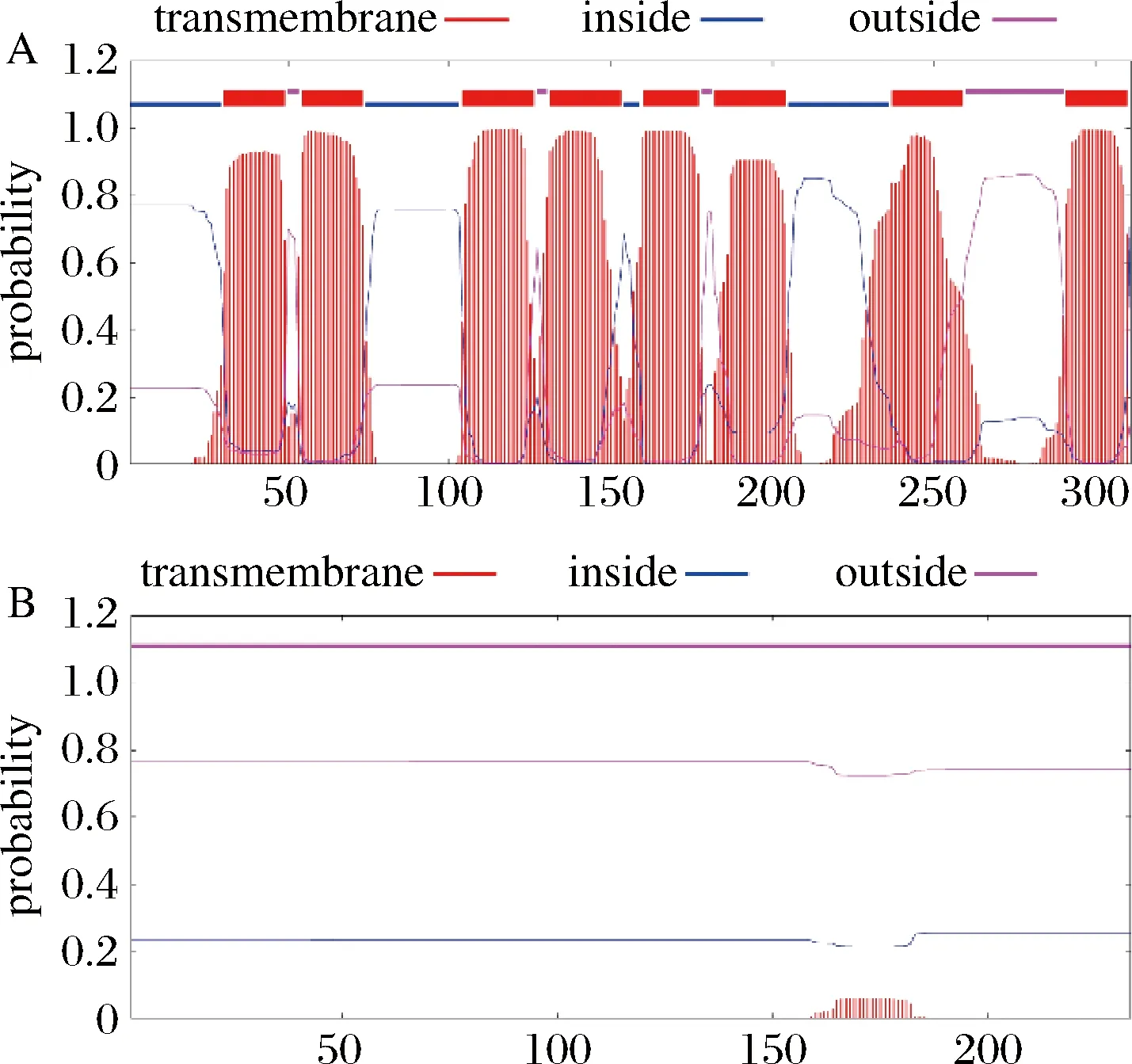
A-TMHMM预测MenA潜在的跨膜区域; B-TMHMM预测MenH潜在的跨膜区域图2 生物信息学预测MenA和MenH的跨膜结构域Fig.2 Prediction of transmembrane domains of MenA and MenH by bioinformatics
使用同样的方法预测了MenH的性质,结果如下:MenH酶蛋白由233个氨基酸组成,其中带有负电荷氨基酸(Asp+Glu)的总共有29个,带有正电荷的氨基酸(Arg+Lys)总共有31个。MenH的分子质量为26.576 kDa,等电点为8.27,GRAVY为-0.367。对MenH的跨膜结构进行预测,结果如图2-B所示,MenH酶蛋白没有明显的跨膜结构。
2.2 MenA和MenH的定位
为了验证MenA在细胞中的定位,首先在质粒pHT01上使用天然启动子表达menA,获得重组质粒pHT01-Pnative-menA-eGFP。将重组质粒转化入B.subtilis168中,然后将重组菌株接种于LB液体培养基中,37 ℃下220 r/min培养12 h。发酵结果显示,强化表达menA之后,细胞的生长并未受到影响(图3-A)。利用激光共聚焦荧光显微镜观察荧光的分布,发现荧光信号出现在细胞膜上,而且是均匀的分布在细胞膜上(分别利用CtaD和YuxO作为阳性和阴性对照)(图3-C),说明MK-7支链结构和骨架结构的结合是发生在细胞膜上的。
MenH在MK-7合成的过程中起到提供甲基的作用,催化整个过程中的最后一步。根据生物信息学的预测,MenH并没有跨膜结构域,应该游离于整个细胞中。为了验证MenH在细胞中的定位,使用同样的方法构建重组质粒pHT01-Pveg-menH-eGFP。将重组质粒转化入B.subtilis168中,然后将重组菌株接种于LB液体培养基中,37 ℃下220 r/min培养。结果显示过表达menH对细胞的生长没有明显的影响(图3-B)。培养12 h之后,在激光共聚焦荧光显微镜的下观察荧光的分布,根据荧光定位实验结果,MenH同样位于细胞膜上,但是有些荧光在细胞中呈现聚集分布。这一分布特点与MenA不同,MenA均匀的分布在细胞膜上,而MenH则是随机地在细胞中出现聚集(图3-C)。
2.3 不同浓度表面活性剂对MK-7合成的影响
表面活性剂Triton-100是一类非离子型表面活性剂,能够促进脂类物质的溶解,从而破坏细胞膜的结构。为了检测不同状态的细胞膜对MK-7合成的影响,我们在MK-7发酵培养基中加入不同浓度的表面活性剂Triton-100。由于加入不同浓度的表面活性剂之后,细胞的生长的受到不同程度的抑制,导致细胞的生长很难统一,所以只对最大生长OD600值进行统计。结果如图4-A所示,当加入表面活性剂时,细胞的生长和MK-7的合成均受到不同程度的抑制。当Triton-100体积分数为0.1%时,MK-7的产量受到明显的抑制,仅为野生型的36.9%。特别是当Triton-100的体积分数达到0.5%时,细胞的OD600值最高仅为5.6,且几乎检测不到MK-7的合成(图4-B)。当细胞膜的结构受到破坏时,对MenA和MenH的定位产生影响,从而影响到MK-7的合成。这些结果表明,完整的细胞膜结构是高效合成MK-7的前提条件。
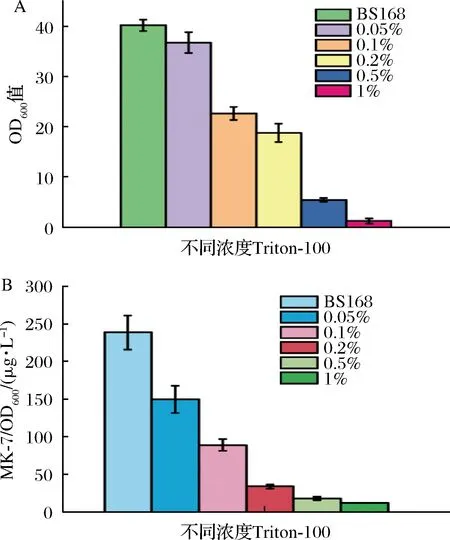
A-不同浓度Triton-100对菌株生长的影响; B-不同浓度Triton-100对菌株合成MK-7的影响图4 不同浓度表面活性剂对细胞生长和MK-7合成的影响Fig.4 Effects of different concentrations of surfactants on cell growth and synthesis of MK-7
3 结论
MK-7作为脂溶性维生素K2的重要亚型,主要分布于细胞的细胞膜中,起到电子传递的作用[14]。然而,对于MK-7如何进入到细胞膜中并没有明确的报道。MenA可能在MK-7进入细胞膜的过程中起着关键作用,其作用是使胞内游离的DHNA与不同长度异戊二烯组成的侧链进行融合,形成2-脱甲基萘醌。MenA属于异戊二烯转移酶的UbiA家族(IPR000537),包括了来源于细菌中的4-羟基苯甲酸酯八烯基转移酶(UbiA)[15],酵母中的对羟基苯甲酸酯聚异戊二烯基转移酶(COQ2)[16]。根据已知晶体结构的UbiA家族的,通过同源比对发现包含两个富含天冬氨酸的保守催化位点,能够催化反式异戊二烯基转移酶的活性,分别是NDXXDXXXD和DXXXD。
生物信息学的预测结果显示MenA具有8个跨膜区,分布在细胞膜上。本研究将MenA与eGFP进行融合,通过荧光的位置确定MenA的分布。实验结果显示MenA位于细胞膜上,与生物信息学预测的结果一致。在E.coli中通过敲除回复突变实验,并通过收集细胞膜碎片,在细胞膜碎片中发现了MenA的活性,证实了MenA位于细胞膜内,并证明含有MenA的细胞能够在厌氧的环境中生长[17]。在结核分枝杆菌(Mycobacteriumtuberculosis)中,使用同位素1-3H标记的法尼基焦磷酸(farnesylpyrophosphate, FPP)或者香叶基焦磷酸(geranylgeranylpyrophosphate, GGPP)作为底物时,发现90%的MenA活力存在于富含细胞碎片的组分中,同样也证实了MenA位于细胞膜中[18]。在本研究中,通过在发酵培养基中加入表面活性剂破坏细胞膜的结构,发现MK-7的合成受到明显的抑制,说明细胞膜的存在对MK-7的合成具有重要作用。
MenH作为催化MK-7合成过程最后一步的关键酶,起到转移甲基的作用。在耻垢分枝杆菌(Mycobacteriumsmegmatis)中,与甲萘醌合成相关的酶位于细胞内膜结构域上,包括甲基转移酶MenG和甲萘醌还原酶MenJ[19]。其中MenG的分布与MenA并不相同,MenA分布在常规质膜(包含膜磷脂与细胞壁)上。研究证明仅当存在额外拷贝的menG时,才能够在基因组上敲除menG,说明menG是耻垢分歧杆菌的必需基因[19]。在本研究中,我们依据生物信息学对MenH的结构进行了预测,发现MenH不具有跨膜结构域,但是荧光定位实验显示MenH同样位于细胞膜上。推测MenH可能是与枯草芽孢杆菌的膜蛋白互作,然后锚定在细胞膜上。本研究证明MenA 和MenH均位于细胞膜上,对MK-7在细胞膜中合成的过程中发挥作用,而且细胞膜的完整性对MK-7的合成具有重要作用。由于MenA和MenH在定位在细胞膜中方式不相同,MenH是如何与膜蛋白进行互作,以及哪种因素影响MenA和MenH在细胞膜中的定位是下一步的研究重点。
