miR-34a-5p对H2O2诱导兔源性晶状体上皮细胞凋亡的作用机制
2023-02-02王凡寅张桐祝天辉彭艳阳彭玲姜晓丹赖铭莹
王凡寅 张桐 祝天辉 彭艳阳 彭玲 姜晓丹 赖铭莹
(1深圳市南山区蛇口人民医院(深圳市前海蛇口自贸区医院)眼科,广东 深圳 518067;2暨南大学附属深圳市眼科医院)
白内障作为老年疾病的一种,其发病机制尚不明确〔1〕。研究表明,白内障疾病的发生与氧化应激反应有着密切的联系〔2〕。氧化应激在白内障发病机制中具有重要的调节作用,能够导致晶状体上皮细胞的凋亡〔3〕。晶状体上皮细胞能够维持晶状体的透明度,因此在晶状体中有着重要的作用〔4〕。而经过氧化氢(H2O2)诱导晶状体上皮细胞后,出现晶状体上皮细胞凋亡及晶状体浑浊的表现,在白内障的发生发展中有着明显作用〔5〕。随着医疗科技的发展及对白内障中晶状体上皮细胞的不断研究,发现miRNA在白内障的发生机制中占据重要作用,更是在人晶状体上皮细胞中起到调节氧化损伤的作用〔6〕。研究已证实miR-34a-5p表达上调参与在老年性核性白内障中〔7〕。本研究探讨miR-34a-5p对H2O2诱导兔源性晶状体上皮细胞凋亡的作用机制。
1 材料与方法
1.1材料 家兔36只,由深圳市南方科技大学动物实验中心提供,2~4月龄,体重1.5~2.6 kg,雌雄兼有,均无眼疾,经检查确认健康。miR-34a-5p抑制物,miR-34a-5p阴性对照物(Sigma公司),DMEM培养基、胎牛血清和青霉素、链霉素溶液购于(Hyclone公司),H2O2购于(Sigma公司),超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(CSH-Px)试剂盒、丙二醛(MDA)试剂盒(Invitrogen公司),磷酸盐缓冲液(PBS,Gibco公司),722型光栅分光光度计(上海医用仪器分析厂),活性氧荧光探针(DCFH-DA)(Abcam公司),B细胞淋巴瘤(Bcl)-2试剂盒、SIRT1试剂盒(Cell Signaling Technology公司)。
1.2细胞培养 36只家兔行空气栓塞处死,将全部家兔双眼球立即摘取,确保眼球无菌无损坏后,进行晶状体剥离,放在盛有培养液的6孔培养板中〔培养液为10 ml极限必需培养基(MEM),含有10%胎牛血清、青霉素为100×103U/L、链霉素0.1 g/L,并加入100 μmol/L H2O2〕,在温度37℃,湿度为95%湿度、含体积分数5%的CO2的孵箱内进行培养24 h。将透明兔晶状体挑选出,准备实验使用。建立H2O2诱导兔源性晶状体上皮细胞凋亡模型。
1.3miR-34a-5p转染及分组 将透明兔晶状体采用随机数字表法分为H2O2组、上调miR-34a-5p组与下调miR-34a-5p组各9个晶状体,将各组晶状体在37℃、5%CO2的培养箱内进行培养。将细胞分为3组,其中H2O2组不进行任何处理,上调miR-34a-5p组进行转染miR-34a-5p阴性对照物,下调miR-34a-5p组进行转染miR-34a-5p抑制物。进行转染24 h后,对各组标记待测。
1.4细胞增殖检测 噻唑蓝(MTT)法检测各组细胞增殖能力。将各组细胞加入96孔板中,分别于24、48、72 h后再每孔中加入30 μl的MTT液,37℃孵育4 h,弃培养液,加入150 μl的二甲基亚砜(DMSO),酶标仪在498 nm波长处检测每孔的OD值。
1.5TUNEL法检测细胞凋亡情况 常温环境中使用20 μg/ml蛋白酶K培养0.5 h后去除蛋白,使用PBS进行彻底清洗,之后将平衡缓冲液100 μl加入其中,室温环境中平衡10 min,之后滴入末端脱氧核苷酸转移酶(TDT)反应液100 μl,避光、室温环境中孵育1 h,加入100 μl柠檬酸钠缓冲液(SSC),常温环境中静置20 min后进行清洗3次,之后使用DAPI进行复染,避光培养10 min后再次进行浸洗,封片观察。DAPI复染细胞核呈蓝色,凋亡细胞细胞核呈绿色,取每切片3视野进行观察、计算细胞凋亡率,计算平均值。
1.6SOD、CSH-Px、MDA水平检测 使用722型光栅分光光度计比色对SOD、CSH-Px、MDA水平进行检测,检测液体积(ml)设定比例为500∶1同时行冰上超声对细胞裂解,3 000 r/min,在4℃条件下,进行10 min离心处理,取出上清,放置冰上检测。在波长550 nm测定SOD水平,波长532 nm测定MDA水平,波长412 nm测定CSH-Px水平。
1.7活性氧(ROS)水平检测 通过DCFH-DA所激发的荧光对ROS水平进行检测,首先使用无血清培养基对DCFH-DA进行稀释,比例为1∶1 000,将浓度稀释10 μmol/L。将收集好的细胞放置在DCFH-DA溶液上,在37℃条件下的培养箱内培养30 min,以5 min进行混匀1次。在无血清的培养基内对细胞洗涤3次,对未入细胞内的DCFH-DA进行清除。采用荧光酶标仪对荧光的强度进行检测,后以荧光强度对ROS水平进行计算。
1.8Bcl-2、SIRT1检测 使用Western印迹对Bcl-2、SIRT1表达进行检测。挑选生长状态较良好无污染对数的细胞,且在生长期,将原培养液去除,以适量的胰酶进行消化后,放到15 ml无菌离心管内,保持温度为4℃,进行1 000 r/min,5 min的离心处理,去除上清,在冰PBS 5 ml进行3次洗涤,然后加1 ml的PBS对细胞进行充分混悬,在微量离心管内,保持温度为4℃,800 r/min,离心5 min。将上清去除。放入预冷后的细胞裂解液,并加入蛋白酶抑制剂苯甲基磺酰氟(PMSF)。对Eppendorf管进行吹打处理,将其混匀,在冰上进行30 min静置,在此期间继续吹打数次。后在4℃条件下,离心处理30 min,将上清轻轻取出,去除沉淀。提取出蛋白均使用二喹啉甲酸(BCA)对Bcl-2、沉默调节蛋白(SIRT)1进行测量。
1.9统计学处理 采用SPSS21.0软件行F检验、独立样本t检验。
2 结 果
2.1各组活性率、凋亡率比较 与H2O2组相比,上调miR-34a-5p组活性率低于H2O2组,凋亡率高于H2O2组,具有统计学差异(P<0.05);与H2O2组、上调miR-34a-5p组相比,下调miR-34a-5p组活性率较高,凋亡率较低,具有统计学差异(P<0.05)。见表1。
2.2各组MDA、ROS水平比较 与H2O2组相比,上调miR-34a-5p组MDA、ROS水平较高,具有统计学差异(P<0.05);与H2O2组、上调miR-34a-5p组相比,下调miR-34a-5p组MDA、ROS水平较低,具有统计学差异(P<0.05)。见表1。
2.3各组SOD、CSH-Px水平比较 与H2O2组相比,上调miR-34a-5p组CSH-Px、SOD水平较低,具有统计学差异(P<0.05);与H2O2组、上调miR-34a-5p组相比,下调miR-34a-5p组CSH-Px、SOD水平较高,具有统计学差异(P<0.05)。见表1。
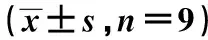
表1 各组miR-34a-5p表达在兔源性晶状体上皮细胞中活性率、凋亡率MDA、ROS、SOD、GSH-Px水平比较
2.4各组Bcl-2、SIRT1表达比较 与H2O2组相比,上调miR-34a-5p组Bcl-2表达较高,SIRT1表达较低,具有统计学差异(P<0.05);与H2O2组、上调miR-34a-5p组相比,下调miR-34a-5p组Bcl-2表达较低,SIRT1表达较高,具有统计学差异(P<0.05)。见表2、图1。
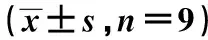
表2 各组miR-34a-5p表达在兔源性晶状体上皮细胞中Bcl-2、SIRT1表达比较
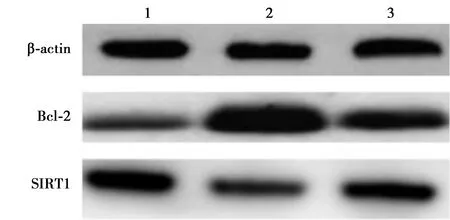
1~3:H2O2组、上调miR-34a-5p组、下调miR-34a-5p组图1 Western印迹检测各组Bcl-2、SIRT1表达
3 讨 论
白内障是世界上第一致盲原因,有相关调查显示,在全球致盲因素中,由白内障造成的失明患者占50%左右〔8〕。在65岁以上的老年人中的群体,白内障发病率较高。因此,通过探究白内障发病的机制,寻找出经济有效的防治途径除具有学术意义外,更具有广泛的社会效益〔9〕。在晶状体中晶状体的上皮细胞结构及功能在维持晶状体透明性中有着关键作用。通过在培养液内观察晶状体中发现,ROS自由基是导致晶状体内的水不溶性蛋白的增加,进而导致白内障的发生〔10〕。相关研究认为,H2O2是引起白内障发生的主要氧化物〔11〕。microRNA作为内源性非编码的小RNA分子,在近几年被发现能够在靶基因3′-UTR互补配对或者降低靶基因的翻译及对靶基因介导达到调节基因表达的作用。在细胞的发育、增殖及衰老、凋亡中均有microRNA通过定位多个mRNA进行参与〔12〕。通过miR-34a-5p对H2O2诱导兔源性晶状体上皮细胞凋亡的研究,达到寻找出治疗白内障的目的,具有重要意义及价值。
晶状体上皮细胞在晶状体前囊内的表面紧密吸附,与晶状体纤维连接较为疏松,但一直分化为晶状体纤维。细胞凋亡被分为两类,一类是细胞死亡受体途径,另一类是线粒体途径。成熟的晶状体上皮细胞相比较正常晶状体上皮细胞,平均密度较低〔13〕。在过熟期白内障中有56%重叠细胞,在正常时,白内障重叠细胞只在晶状体细胞分裂生发带。相关研究显示,白内障晶状体前囊中央区域出现重叠细胞,可能由于触发细胞增殖机制致使〔14〕。H2O2诱导晶状体上皮细胞出现凋亡,一直在研究白内障中被认为是经典模型。由H2O2诱导后的晶状体上皮细胞会出现氧化损伤,使其出现严重细胞凋亡〔15〕。本研究结果说明,通过miR-34a-5p下调,能够提升晶状体上皮细胞的活性,降低细胞的凋亡。
在晶状体上皮细胞中,由于各种刺激因子引起氧自由基是导致白内障发生发展的主要因素〔16〕。在白内障发病机制中,由于氧化应激在其中具有重要作用。经过外源性或内源性的ROS对细胞信号进行转导系统的综合作用作为氧化应激损伤的主要表现〔17〕。当ROS的过度表达,致使细胞受到严重的氧化应激,进而晶状体上皮细胞出现衰老、凋亡及坏死的后果。当H2O2诱导后的晶状体上皮细胞后,ROS会出现明显表达,能够使正常晶状体上皮细胞受到破坏,从而导致〔18〕。本研究结果说明,通过miR-34a-5p下调,能够降低H2O2诱导兔源性晶状体上皮细胞氧化应激损伤。
当晶状体细胞膜上出现大量脂质过氧化物堆积,使其膜上相关酶活性降低,损害晶状体屏障功能,导致晶状体的光学性质与晶状体中环境出现变化,脂质过氧化物同时能够引起晶状体出现混浊〔19〕。氧化应激在白内障的发病中有着重要作用,是关键性的调节因子,能够导致晶状体上皮细胞的凋亡〔20〕。经过H2O2诱导晶状体上皮细胞增加ROS含量,从而使细胞中的抗氧化物质降低,如SOD、CSH-Px等,在白内障的形成中占据重要作用〔21〕。SOD作为在正常机体中存在的抗氧化酶,能有效地清除自由,抵抗机体内氧化应激损伤及维持正常的代谢白内障形成〔22〕。本研究结果说明,通过miR-34a-5p下调,能够抵抗H2O2诱导兔源性晶状体上皮细胞造成的氧化应激,说明miR-34a-5p在H2O2诱导兔源性晶状体上皮细胞中的作用机制。
Bcl-2是重要的抗凋亡基因,能够抑制超氧离子产生过多的程序化死亡诱导因子释放,以达到抑制细胞凋亡的目的〔23〕。SIRT1作为哺乳动物内重要烟酰胺腺嘌呤二核苷酸(NAD)具有依赖性的乙酰化酶,在多种细胞的衰老、凋亡等生理过程中均有参与〔24〕。本研究结果说明,通过miR-34a-5p下调,能够抵抗H2O2诱导兔源性晶状体上皮细胞的凋亡、衰老等情况。
综上,当H2O2诱导后的晶状体上皮细胞中下调miR-34a-5p表达能够提升细胞的活性,抵抗细胞凋亡,能够显著改善氧化应激,同时减轻氧化应激造成的损伤,并具有抗衰老的作用。
