盐酸戊乙奎醚预处理对失血性休克致急性肺损伤大鼠肺组织保护作用及对炎症因子的影响
2023-02-02胡乃元欧阳华徐巧精王丹风田毅
胡乃元 欧阳华 徐巧精 王丹风 田毅
(中南大学湘雅医学院附属海口医院麻醉科,海南 海口 570208)
急性肺损伤(ALI)是常见的呼吸系统危重病症,临床表现以低氧血症、弥漫性肺泡损伤、肺不张为主,可由肺内(肺炎、脓毒症等)和肺外(创伤等)等多种因素引起〔1〕。大量研究表明,ALI的发生机制主要与机体炎性因子释放过度、导致抗炎和促炎反应失衡有关〔2,3〕。目前用于ALI治疗的常用药物包括前列环素、一氧化氮、非甾体抗炎药和糖皮质激素等,但疗效欠佳且存在不良反应发生率高等问题。抗胆碱药治疗是ALI辅助治疗的传统手段之一,其能通过抑制炎性细胞的活化,减少白细胞介素(IL)-1等炎性因子释放,减轻ALI的临床症状〔4〕。但在临床实践过程中研究者们发现,目前应用的抗胆碱药受体特异性较差,不良反应多,从而限制了其推广应用。研究发现,盐酸戊乙奎醚(PHC)作为一种新型选择性胆碱药,不仅具有一定的抗炎作用,且可选择性抑制M1和M3受体,为抗胆碱药治疗ALI提供了新的方向〔5〕。为进一步探究ALI发病机制及PHC对ALI的应用效果,本研究以失血性休克致大鼠ALI模型研究对象,探讨PHC预处理对失血性休克致大鼠ALI中肺组织和血清中IL-10、肿瘤坏死因子(TNF)-α、IL-1β等炎性因子表达的影响。
1 材料与方法
1.1材料
1.1.1大鼠 选取50只健康SD大鼠,雄性,6~8周龄,体重200~250 g,由成都达硕生物科技有限公司提供,生产许可证号:SCXK(川)2018-24,适应性饲养1 w,期间给予自由饮水和饮食,光照12 h。所有程序均经医院伦理委员会批准,每个实验程序按照相关规定进行。
1.1.2主要实验试剂 PHC(规格:1 ml∶0.5 mg,批准文号:H20051948,生产批号:20180511-1,生产厂家:成都力思特制药股份有限公司);IL-10、TNF-α、IL-1β酶联免吸附试验(ELISA)试剂盒(规格均为96T,产品货号分别为:E-EL-R0016c、E-EL-R0019c、E-EL-R0012c,生产厂家均为武汉伊莱瑞特生物科技股份有限公司);抗NF-κB、抗IκB激酶(IKK)、抗p65抗体(规格均为100 μl,产品货号分别为:8242S、2697S、3033S,生产厂家均为Cell Signaling Technology);丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)试剂盒(规格均为96T,产品货号分别为:DEIA3918、CED026、NATE-0380,均购自北京安必奇生物科技有限公司)。
1.1.3主要仪器和设备 -80℃超低温冰箱:青岛海尔集团;4℃、-20℃冰箱:合肥美菱股份有限公司;H1650-W离心机:湖南湘仪实验室仪器有限公司;TGL-20M高速台式冷冻离心机:湖南湘仪实验室仪器有限公司;CKX41倒置显微镜:日本Olympus光学工业株式会社;IX-71荧光倒置显微镜:日本Olympus光学工业株式会社;Infinite M1000 Pro 全波长酶标仪:TECAN公司;TANKPE060高纯水机:美国Millipore公司。
1.2动物分组 50只大鼠,适应性饲养1 w后,称取体重,根据体重分层随机分成:对照组(A 组)、模型组(B 组)和PHC低剂量组(C 组,0.3 mg/kg)、中剂量组(D 组,1.0 mg/kg)和高剂量组(E 组,3.0 mg/kg),每组10只。
1.3实验动物模型建立 腹腔注射的水合氯醛(浓度10%,给药剂量3.5 ml/kg)进行麻醉。所有大鼠于右侧颈动脉行穿刺置管,用于监测平均动脉压(MAP)。选择大鼠左侧股动、静脉进行穿刺置管,用于给药、放血和血液回输。A组仅行动、静脉穿刺,不予放血;其余各组插管后,监测MAP,待MAP稳定10 min后,经动脉置管开始缓慢放血,MAP降至35~45 mmHg后,维持该MAP值60 min,回输血液和等量生理盐水,制备急性肺损伤模型〔6〕。C、D、E 组PHC均在放血前30 min采用股静脉注射依剂量给予,然后按照B组方法制备急性肺损伤模型。
1.4取材 依照实验设计方案,在大鼠复苏4 h后,采用10%浓度水合氯醛对大鼠进行过量麻醉,股动脉放血处死大鼠,留取血样,静置30 min后,4℃,1 500 r/min离心20 min,取上清,-80℃冰箱保存备用。剪取大鼠右肺置于-4%浓度的甲醛溶液保存备用,剪取大鼠左肺置于-80℃冰箱保存备用。
1.5苏木素-伊红(HE)染色 (1)固定:将取得的肺组织标本放置在4%浓度的甲醛溶液中充分浸泡48 h。(2)脱水:分别用70%、80%、90%、95%、100%酒精进行梯度脱水;(3)透明:用二甲苯将标本透明2次,以替换标本组织内酒精,此过程需不断观察,直至标本透明似琥珀。(4)浸蜡:将透明标本组织放置在溶化好的石蜡里,置于溶蜡箱在65℃下保温2 h;(5)包埋:观察石蜡完全浸入到组织中以后进行包埋,待其冷却凝固以后便成为蜡块;(6)编号:记录为标本来源大鼠编号;(7)切片:标本组织蜡块用切片机在其中部自动横行切取3张4 μm厚的薄片;(8)贴片:将切片在热水中烫平,然后再贴在玻片上,置于烤箱58℃恒温保持4 h。(9)染色:在脱蜡和水洗之后,采用苏木素进行染色,保持3 min,继续水洗之后再蓝化,保持10 min,使用1%浓度的盐酸酒精再进行分化,保持20 s,最后伊红染色,保持5 min;(10)封片:使用70%、80%、90%、95%、100%酒精依次进行脱水,各自保持3 min,使用二甲苯进行透明,保持5 min,最后使用中性树脂胶完成封片。
1.6免疫荧光 利用免疫荧光技术检测肺组织中NF-κB蛋白表达,使用1.5方法中的石蜡包埋的肺组织,抗体浓度(一抗:NF-κB抗体;1∶200 二抗:1∶400)。
1.7Western印迹 对IKK、p65肺组织中的表达进行定量检测。具体步骤:(1)取出大鼠肺组织,立即在研磨器内加细胞裂解液放置在冰上进行研磨,持续30 min,将混合液小心吸入到离心管中;(2)将离心管置于低温高速离心机内,11 000 r/min,4℃离心,持续15 min,弃沉淀,取上清;(3)将上清液收集起来,二喹啉甲酸(BCA)法定量检测蛋白浓度,依照3∶1的比例加入上样缓冲液,再经过沸水浴持续5 min,进行灭活,在-20℃下储存,以备后续使用;(4) 在110 mV下,用聚丙烯酰胺凝胶电泳(PAGE)进行蛋白质分离,溴酚蓝区带到达分离胶以后,电压调至200 mA,持续2 h,溴酚蓝区带进入分离胶末端,并即将泳出分离胶底部,转至硝酸纤维膜上;(5) 按照20∶1的比例在PBST溶液中加脱脂奶粉,室温条件下封闭1 h。依照一抗的推荐浓度和用量,加入奶粉对一抗进行稀释。将硝酸纤维膜置于杂交袋,加一抗工作液在袋中,然后封口,4℃条件下,孵育过夜;(6)采用辣根过氧化物酶(HRP)标记好的二抗(抗兔IgG抗体,1∶2 000稀释)工作液,再封口,37℃条件下,孵育1 h;(7)凝胶成像分析仪扫描并分析结果。绘制标准曲线,并计算浓度,结果用相对灰度值表示。
1.8统计学方法 采用 SPSS22.0 软件,多组数据的比较采用ANOVA分析,采用 Bonferroni校正的t检验进行多重比较。
2 结 果
2.1PHC对ALI大鼠血清中TNF-α、IL-1β、IL-10、MDA、SOD、LDH水平及肺W/D值的影响 与A组相比,B、C、D、E组血清中TNF-α、IL-1β、IL-10、MDA、SOD、LDH水平及W/D值均明显升高(P<0.05);与B组相比,C、D、E组TNF-α、IL-1β、IL-10、MDA、SOD、LDH水平及W/D值明显降低(P<0.05)。见表1。

表1 各组血清中TNF-α、IL-1β、IL-10、MDA、SOD、LDH水平及肺W/D值比较
2.2PHC对ALI大鼠肺组织病理的影响 A组肺表面光滑,镜下肺泡规则,细胞形态正常;B组肺组织较A组明显增大,肺表面可见散在的红色斑点,镜下肺泡壁较A组明显增厚,肺泡腔内存在大量中性粒细胞浸润和红细胞渗出,病理结果提示ALI大鼠模型造模成功。C组、D组和E组肺组织的炎症病理改变较B组明显减轻,中性粒细胞等炎细胞浸润显著减少。见图1。
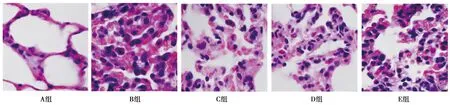
图1 各组肺组织病理学改变(HE染色,×400)
2.3PHC对ALI大鼠肺组织中NF-κB通路蛋白表达的影响 Western印迹结果表明,B、C、D、E组肺组织中IKK(2.03±0.28、1.42±0.15、1.35±0.09、1.12±0.10)、p65表达(1.78±0.21、1.67±0.22、1.36±0.18、1.22±0.14)较A组IKK(1.00±0.09)和p65表达(1.00±0.12)明显增加,而C、D、E组IKK、p65表达量较B组明显下降(均P<0.05)。免疫荧光结果显示,A组肺支气管管壁周围存在少量p65绿色荧光表达,B组中绿色荧光强度较A组明显增加,C、D、E组绿色荧光强度较B组明显减弱,提示NF-κB表达下降。见图2、图3。可推断大鼠失血性休克可诱导NF-κB通路激活,使IKK、P65蛋白表达增加,预防性给予PHC可以抑制NF-κB通路激活。
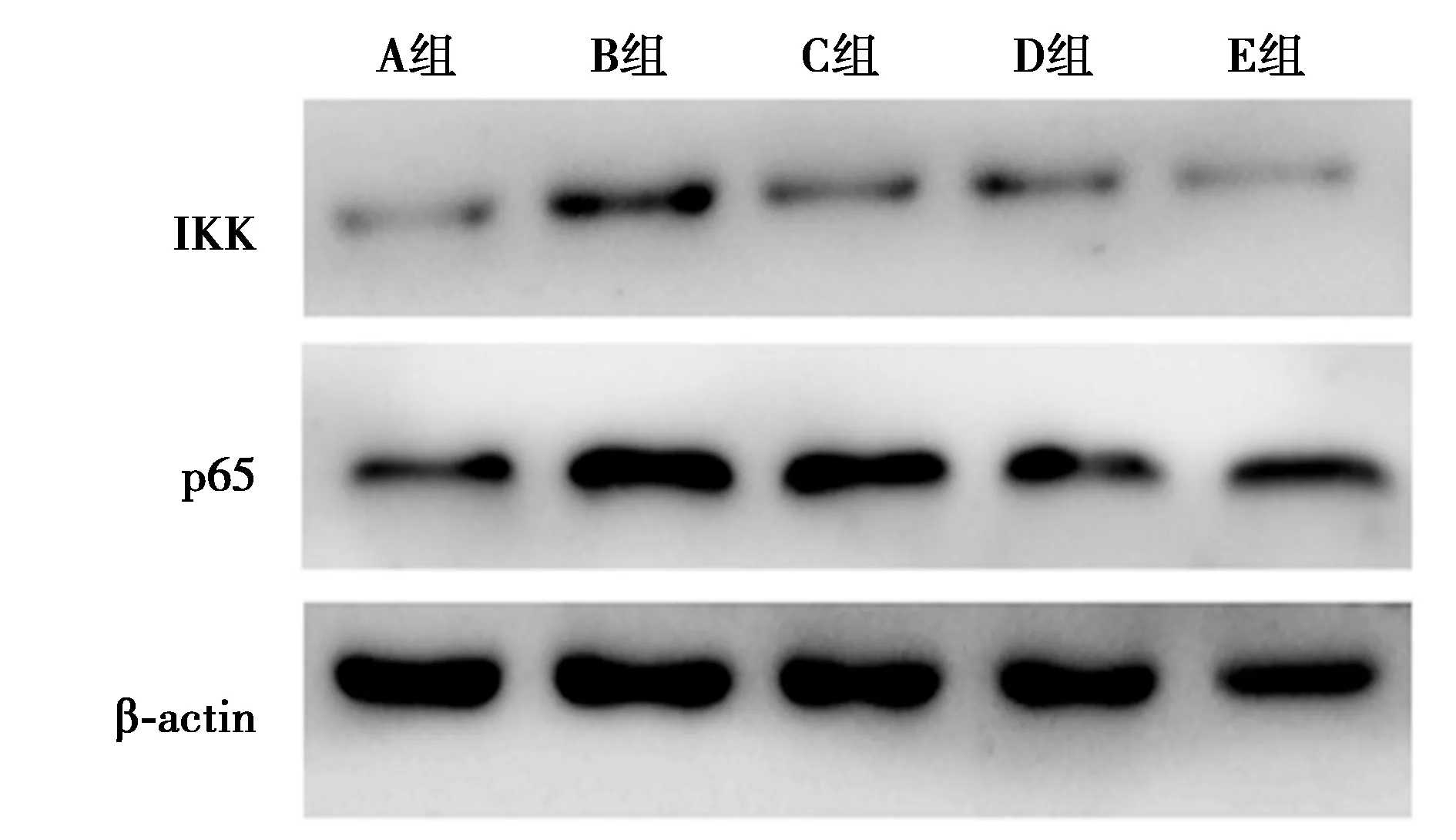
图2 Western印迹检测肺组织IKK、p65蛋白表达

图3 免疫荧光检测各组肺组织NF-κB蛋白表达(×200)
3 讨 论
有流行病学研究表明,ALI在我国ICU患者中的发病率高达10.2%,且病死率接近11.3%〔7〕。因此,进一步探究ALI的发病机制,寻找预防和治疗ALI新的安全有效的药物具有重要的临床意义。目前ALI发病机制尚不完全清楚,但多数研究认为氧化应激水平过高和炎症反应失控在ALI 发病中起着关键作用〔8~10〕。NF-κB是Rel家族二聚体蛋白的一种,在调节机体炎症介质中具有核心转录因子的作用〔11〕。当机体氧化应激水平升高时,可激活NF-κB通路,使通路下游的抗氧化酶(MDA、SOD、LDH)、炎性细胞因子(TNF-α、IL-1β、IL-10)及选择素等基因表达增加,从而使肺血管内皮遭到破坏,渗透性变大,引起肺组织水肿〔12~14〕。因此,阻断NF-κB的活化对阻止炎症介质大量产生,预防ALI 的发生、发展具有一定效果。
PHC具有抗胆碱、抗感染、抗氧化、抑制胃酸分泌等多种药理作用〔15~17〕,已广泛用于麻醉前给药、有机磷中毒、慢性阻塞性肺病、内脏平滑肌痉挛等疾病的治疗〔18〕,但在ALI中的报道尚少。本研究结果提示本动物模型造模机制为大鼠失血性休克后造成NF-κB通路激活引起下游抗氧化酶和炎性细胞因子基因转录增加。IKK和p65是NF-κB 通路中的重要蛋白成员,抑制p65和IKK活性可以减少NF-κB 激活〔19,20〕。免疫荧光结果证实了实验推测。通过对比PHC给药组结果可部分说明PHC对降低ALI的发生率具有一定的预防价值,但其机制是否与抑制NF-κB通路激活、减少下游抗氧化酶和炎性细胞因子基因的转录有关,尚需进一步验证。而进一步研究结果显示,PHC组中NF-κB、P65 和 IKK 表达水平较B组明显下降,验证以上推测。
综上,PHC可明显减轻肺组织含水量,改善ALI大鼠肺组织中炎性细胞浸润和肺水肿情况,减轻肺部病理损伤,其机制可能与抑制NF-κB通路激活、减少下游抗氧化酶和炎性细胞因子基因的转录有关。PHC具有较好的预防失血性休克致ALI的作用。本研究由于样本量有限,实验方法单一,且ALI发病复杂,仍需更大的样本量、更丰富的实验方法进行验证。
