胃癌根治术后合并肺部感染的风险模型构建及奥曲肽预防作用
2023-02-01冯贵生艾正友付林
冯贵生,艾正友,付林
胃癌根治术(radical gastrectomy, RG)后合并肺 部感染是最常见的症状之一,部分文献报道传统胃癌切除术后发生率甚至高达39%[1]。因此,早期对于胃癌病人进行有效的风险筛查,在预防并发症的发生以及改善胃癌病人预后方面具有重要意义。本研究选取280例接受RG治疗的胃癌病人为研究对象,采用logistic回归分析筛选出影响RG合并肺部感染的危险因素,并建立相应的列线图评估模型,为临床提供治疗依据。
1 资料与方法
1.1 一般资料回顾性分析简阳市人民医院2015年5月至2019年5月收治的280例行腹腔镜下胃癌根治术(RG)的病人的病例资料,根据临床资料中是否发生肺部感染分为感染组与未感染组。同时采用前瞻性分析,另外从2019年3月至2020年10月采用随机数字表法选取92例需行腹腔镜下胃癌根治术的病人分为观察组与对照组,各46例,对照组病人行常规西医及手术治疗,观察组在对照组的基础上行奥曲肽治疗,观察其对病人术后并发症的预防作用。病人及其近亲属知情同意。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 诊断标准①术中或术后病理学诊断为胃腺癌的病人;②肺部感染符合《中国成人社区获得性肺炎诊断和治疗指南》(2016版)中有关肺炎的临床诊断标准[2],即具备相应的感染诱因、临床症状、体征及实验室检查。
1.3 纳入及排除标准纳入标准:①术前无脏器或远处淋巴结转移;②行RG治疗的适应证病人;③术后病人各类并发症的发生发展、转归等记录较为完整;④无急性穿孔、肠梗阻等症状。排除标准:①术中发现病人出现肿瘤的远处转移或侵犯周围组织;②术中由于特殊情况病人需要从腹腔镜手术转为开腹手术;③存在认知功能异常的病人;④临床资料不全的病人。
1.4 观察指标本研究纳入的所有研究对象均采取单因素回归分析,主要观察指标为性别、年龄、体质量指数(BMI)、高血压史、高血脂史、糖尿病史、吸烟史、慢性阻塞性肺病(COPD)、肺气肿、冠心病史、抗生素治疗史、术前白蛋白、术前血红蛋白、病理分期、吞咽障碍、肿瘤长径、浸润深度、手术时间、术中出血量、胃管留置及口腔护理等;初步评估给予奥曲肽给药治疗后胃癌病人并发症发生情况,主要包括吻合口出血、肺部感染、肠梗阻、吻合口瘘等。
1.5 统计学方法数据采用SPSS 20.0进行统计分析,其中计量资料以±s表示,采用t检验进行分析;计数资料采用例(%)表示,采取χ2检验进行分析。采用logistic回归分析筛选出独立危险因素后利用R软件建立相应的列线图风险预测模型,并使用Calibration与Bootraps内外部验证法评估模型的预测效能,采用ROCR制定相应的ROC评估曲线。
2 结果
2.1 两组基本信息资料单因素分析两组病人的年龄、高血脂史、吸烟史、抗生素治疗史、术前白蛋白、术前血红蛋白、病理分期、吞咽障碍、肿瘤直径、浸润深度、手术时间、术中出血量、胃管留置及口腔护理的数据差异有统计学意义(P<0.05)。见表1。
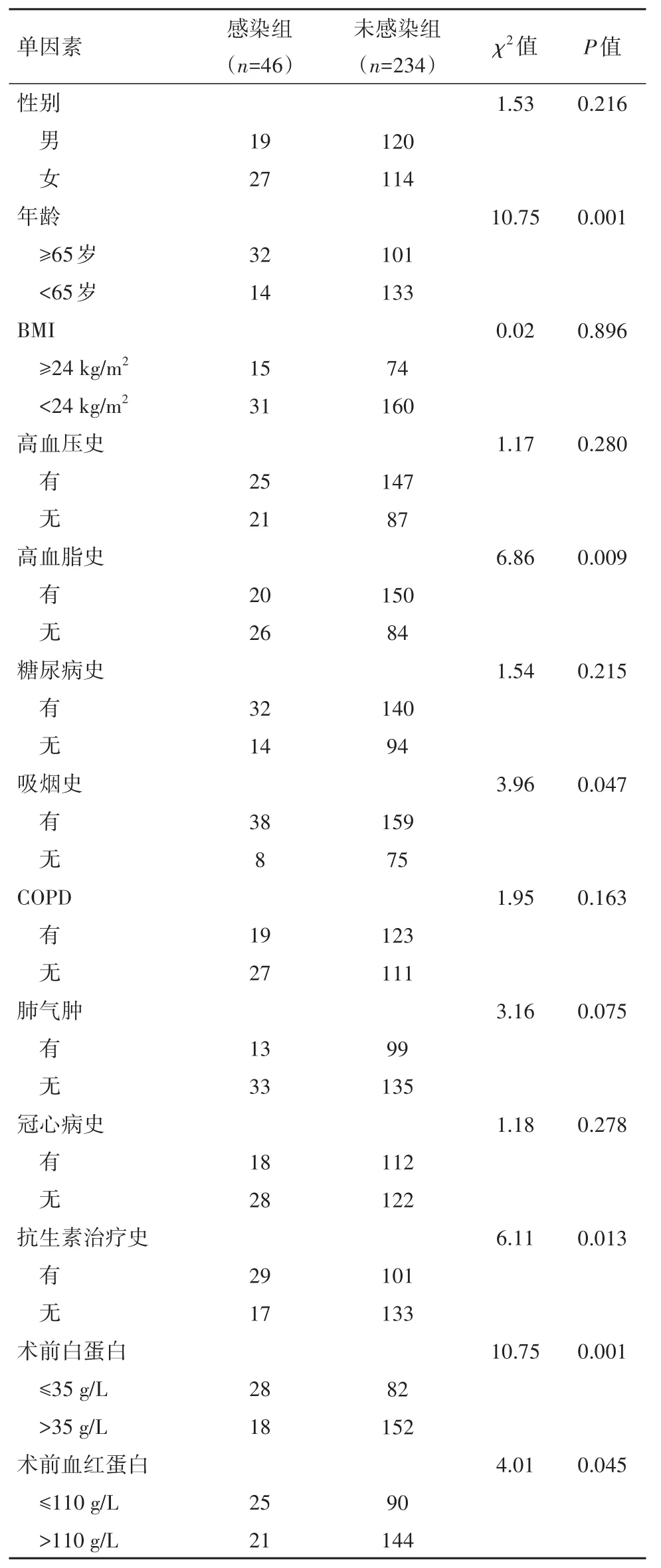
表1 胃癌根治术术后合并肺部感染的单因素分析/例

续表1胃癌根治术术后合并肺部感染的单因素分析/例
2.2 多因素Logistic回归分析结果根据胃癌根治术后病人是否并发肺部感染将病人分为感染组与未感染组,通过一般基本信息资料对比结果,对年龄、高血脂史、吸烟史、抗生素治疗史、术前白蛋白、术前血红蛋白、病理分期、吞咽障碍、肿瘤直径、浸润深度、手术时间、术中出血量、胃管留置及口腔护理等数据作二元logistic回归分析,结果表明:高血脂史、吸烟史、抗生素治疗史、术前血红蛋白、吞咽障碍、肿瘤长径、浸润深度、术中出血量及口腔护理的P>0.05,因此予以剔除,筛选出年龄、术前白蛋白、病理分期、手术时间、胃管留置为胃癌病人术后发生肺部感染的独立风险因素(P<0.05)。
2.3 影响胃癌根治术后病人合并肺部感染的风险模型的建立与验证基于上述筛选出的独立危险因素,建立了预测胃癌病人行根治术后合并肺部感染风险概率的列线图模型,通过对各因素分类进行赋值,对每位病人总分值进行对照,从而给出术后合并肺部感染的概率。为确保样本的准确性,采用内部数据验证法,构建验证集,对比两者差异,结果显示:建模集和验证集的C-index指数分别为0.82,95%CI:(0.68,0.96)和 0.81,95%CI:(0.68,0.94);两组的校正曲线均与标准曲线拟合较好;两组ROC曲线下面积(AUC)分别为0.82和0.81,证明本次模型具有良好的预测精准度。
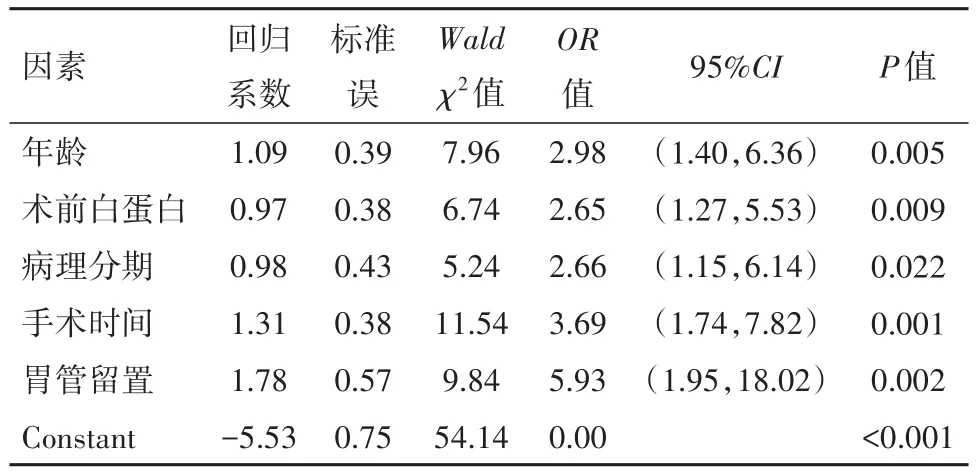
表2 胃癌根治术术后合并肺部感染的多因素Logistic回归分析结果
2.4 奥曲肽治疗后两组病人的并发症情况观察组发生不良反应事件11件,其中症状表现出吻合口瘘1件、胰瘘1件、肠梗阻2件、肺部感染5件及其他情况2件,对照组发生不良反应29件,其中症状表现出吻合口瘘2件、胰瘘3件、淋巴瘘2件、肠梗阻5件、肺部感染13件及其他4件,两组不良反应比较,差异有统计学意义(χ2=11.52,P<0.05)。另单独对比肺部感染可见,观察组发生肺部感染的例数明显低于对照组(χ2=4.42,P<0.05)。
3 讨论
RG虽作为胃癌病人较为有效的治疗方式,术后并发症问题仍是临床医师亟待解决的问题。有关文献报道,胃癌病人围手术期并发症发生率为10.5%~45.8%,其中肺部并发症发生率最高,若病人术后合并肺部感染,加之自身抵抗力较差,很容易进展为重症肺炎,死亡率极高[3-4]。本研究结果显示,胃癌病人RG治疗后合并肺部感染的发生率为16.43%(46/280),与文献报道基本一致,提示术后肺部并发症形势依然严峻,因此找出影响RG病人合并肺部感染的危险因素,并在早期采取干预措施对改善预后、降低肺部并发症具有重要意义。
本研究基于单因素、logistic多因素回归分析筛选出年龄≥60岁、术前白蛋白<35 g/L、手术时间≥3 h、病理分期为Ⅲ~Ⅳ期、留置胃管为影响RG病人合并肺部感染的独立危险因素(P<0.05)。年龄作为本研究的一项独立危险因素,46例发生肺部感染的病例数中32例病人为65岁以上年龄,发生率达到了69.57%(32/46),主要认为,年龄越大的病人机体器官生理功能减退,常合并各类基础疾病,自身抵抗力较一般人群更差,因此对创伤的应激反应的能力明显降低,极易发生感染[5]。国外文献报道,老年性腹部手术病人术后肺部并发症发生率最高达到了58.3%,住院时间与治疗费用较普通人群明显增加[6]。术前白蛋白是反应胃癌病人体内营养吸收与消耗的指标,可反映出人体所处的营养状态与疾病的严重程度[7]。本研究中60.87%(28/46)发生肺部感染的病人术前白蛋白水平<35 g/L,表现为低白蛋白血症,使得病人免疫功能变差,与此同时,肺部感染也会加重术前低白蛋白血症,二者相互影响,形成恶性循环;此外术前营养不良也可能通过影响病人呼吸肌的结构与功能,减小呼吸肌动力,影响肺功能,导致肺部并发症的发生[8-9]。手术时间作为影响RG病人合并肺部感染的重要因素,首先手术时间的长短决定了手术的创伤以及手术难度的大小,手术时间的延长也会随之增加麻醉时间,麻醉过程中常须使用气管插管,使病人可肺部直通外界空气环境,进而大量的细菌通过管道进入病人下呼吸道,引起肺炎发生[10]。胃癌的TNM分期对病人预后的影响已被国内外公认[11],本研究中发生术后肺部感染病例中80.43%(37/46)的病人病理分期处于Ⅲ~Ⅳ期,由于该阶段的病人5年生存率远低于40%以下[12],机体免疫能力明显较低,因此预后就越差。传统观念认为,留置胃管可减少术后吻合口的张力进而减少吻合口瘘、恶心呕吐等并发症的发生,然而作为一种侵袭性的操作,常会导致微生物滋生进而引发肺部感染。此外,本研究纳入的肺部相关疾病的危险因素经单因素统计分析后均差异无统计学意义,可能与本研究为单中心临床研究有关。
本次研究基于上述筛选出的危险因素建立了预测RG病人合并肺部感染的独立危险因素的列线图模型,此外为保证模型评估的准确性,避免过度拟合,本文采用内外部验证途径对模型进行了验证,结果显示,建模集和验证集的C-index指数分别为 0.82,,95%CI:(0.68,0.96)和 0.81,95%CI:(0.68,0.94),两组的校正曲线均与标准曲线拟合较好,ROC曲线下面积(AUC)分别为0.82和0.81,证明本次模型具有良好的预测精准度。
奥曲肽是一种人工合成的生长抑素类药物,具有强烈抑制激素分泌的作用,可通过直接或间接的作用于内脏血管平滑肌进而减少内脏血流量,可通过抑制胃液分泌进而产生胃黏膜屏障作用,也可通过促进血小板聚集进而产生对胃癌病人术后吻合口出血的控制作用,且临床常用于治疗上消化道出血[13-14]。本研究中结果显示,奥曲肽可通过上述各类作用导致并发症发生率明显较常规组减少,具有一定的临床价值。
综上所述,年龄≥60岁、术前白蛋白<35 g/L、手术时间≥3 h、病理分期为Ⅲ~Ⅳ期、留置胃管为影响RG病人合并肺部感染的独立危险因素,医护人员可根据本研究建立的列线图模型对胃癌病人RG后发生肺部感染的风险进行个体化预测与评估,进而改善病人预后。奥曲肽可显著降低RG术后肺部感染,减少术后各类并发症的发生率。
