miR-4306通过下调SATB2表达抑制骨肉瘤细胞增殖、迁移与侵袭
2023-01-31李书林廖艺琳周子杰肖郑伟苏凌波李俊杰蓝青陈名迪郭徽灵颜来鹏汤发强
李书林, 廖艺琳, 周子杰, 肖郑伟, 苏凌波,李俊杰, 蓝青, 陈名迪, 郭徽灵, 颜来鹏, 汤发强
(1. 福建医科大学省立临床医学院,福建 福州 350001; 2. 福建省立医院骨一科,福建 福州 350001; 3. 福建中医药大学中医学院,福建 福州 350001; 4. 福建中医药大学中西医结合学院,福建 福州 350001)
骨肉瘤是目前最常见的原发性恶性骨癌,起源于恶性间充质细胞[1]。骨肉瘤患者治疗以往主要依靠手术切除,存活率仅为20%;随着化疗和放疗技术的引入,患者长期存活率达65%~70%[2]。然而,由于肿瘤的侵袭性和转移性,伴有肺转移性骨肉瘤患者5年存活率仅有20%左右[3-4]。因此,深入探究骨肉瘤侵袭、转移的机制对提高骨肉瘤的疗效具有重要意义。
微小RNA(microRNA, miRNA)是一组内源性非编码的小核糖核酸,广泛分布于真核细胞中,其与靶基因的3′-UTR结合参与转录后调节[5]。据统计,超过30%蛋白表达受miRNA调节[6]。miRNA异常表达或突变与多种癌症相关,并可充当肿瘤标志物或癌基因[7-8]。miR-4306参与调控多种恶性肿瘤的生物学行为,如宫颈癌[9]、乳腺癌[10]和甲状腺乳头状癌[11]等。亦有研究报道,miR-4306可通过血管内皮细胞生长因子A(VEGFA)抑制ERK1/2/NF-κB信号传导,从而抑制人单核细胞衍生的巨噬细胞迁移[12]。目前,关于miR-4306在骨肉瘤中的作用尚不明确。因此,本研究拟探讨miR-4306在骨肉瘤细胞中的表达及其对骨肉瘤发生发展的影响和潜在机制。
1 材料和方法
1.1 细胞及主要试剂
DMEM购自美国Gibco公司;胎牛血清购自德国PAN Biotech公司;miR-4306模拟物(miR-4306 mimics)和模拟物阴性对照(mimics NC)购自上海市吉凯生物科技有限公司;双荧光素酶报告基因检测试剂盒购自美国Promega生物公司;BCA蛋白定量试剂盒、蛋白上样缓冲液均购自北京索莱宝科技有限公司;ECL发光试剂购自美国Thermo公司;转染试剂Lipofectamine 2000、qRT-PCR试剂盒均购自美国Invitrogen公司;Transwell小室及24孔细胞培养板购自美国Corning公司;β-肌动蛋白、富含AT序列特异性结合蛋白2(specail AT-rich sequence-binding protein 2, SATB2)、上皮-间质转化(EMT)标志蛋白N-钙黏蛋白、E-钙黏蛋白和血管内皮生长因子(vascular endothelial growth factor, VEGF)IgG一抗以及HRP标记的IgG二抗均购自武汉三鹰生物技术有限公司。
1.2 细胞培养及miR-4306相对表达水平检测
1.2.1 细胞培养 人成骨细胞hFOB 1.19和骨肉瘤细胞Saos-2、MNNG/HOS CI #5用含10%胎牛血清的DMEM,于37 ℃含有5% CO2细胞培养箱中培养。
1.2.2 qRT-PCR检测miR-4306相对表达水平 采用传统Trizol法提取人源成骨细胞hFOB 1.19和骨肉瘤细胞Saos-2、MNNG/HOS CI #5中总RNA,用逆转录试剂盒将RNA逆转录成cDNA。取cDNA等试剂按照试剂盒说明书配置20 μL反应体系:cDNA 2.0 μL、qPCR SYBR®Green Master Mix 10.0 μL、灭菌蒸馏水7.0 μL和上、下游引物各0.5 μL。qRT-PCR反应步骤:95 ℃预变性5 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃退火30 s,40个循环。qRT-PCR引物序列如下:miR-4306上游为5′-CGCGCGTGGAGAGAAAG-3′,下游为5′-AGTGCAGGGTCCGAGGTATT-5′;内参U6上游为5′-CTCGCTTCGGCAGCACATATACT-3′,下游为5′-ACGCTTCACGAATTTGCGTGTC-3′。最后根据2-ΔΔCt法进行相对定量分析。
1.3 细胞分组、转染及相关指标检测
1.3.1 细胞分组及转染 将细胞分为miR-4306 mimics组和mimics NC组。当细胞融合度达50%~70%时,按照Lipofectamine 2000试剂盒说明书将miR-4306 mimics及阴性对照稀释至5 mmol/L,分别加入细胞培养基中,转染约6 h后更换为含10%胎牛血清的新鲜DMEM,进一步培养24~48 h。用qRT-PCR检测转染效果,具体方法同“1.2.2”,确认转染成功后将细胞用于后续实验。
1.3.2 CCK-8检测细胞增殖 取“1.3.1”转染细胞,培养24 h;接种于96孔板,分别在0、24、48、72 h向每孔细胞中加入100 μL 10% CCK-8溶液,继续培养1~2 h。用酶联免疫检测仪检测450 nm处各孔光密度(D)值,并计算细胞增殖抑制率。
1.3.3 克隆形成实验检测细胞增殖能力 取“1.3.1”转染细胞,胰酶消化,完全培养基重悬,制成细胞悬液并计数;将细胞接种于6孔板中,800个/孔,每组设3个复孔,加入含10% 胎牛血清的完全培养基,摇匀后轻放于培养箱中继续培养;每隔3 d换液一次并观察细胞状态,显微镜下观察克隆大小;待孔中大多数单个克隆中细胞数>50时,弃上清液,PBS洗涤细胞1次;每孔加入1 mL 4%多聚甲醛,4 ℃固定60 min;PBS洗涤细胞1次。通过计数得出克隆形成率,对细胞的增殖能力作定量分析。
1.3.4 Transwell实验检测细胞迁移 取“1.3.1”转染细胞,消化后离心弃培养液,用PBS洗1~2遍,用无血清培养基重悬;调整各组细胞数量至1×105个/mL,取细胞悬液100 μL加入Transwell小室上表面,下室加入600 μL含20% 胎牛血清的培养基,37 ℃孵育24 h;用棉签擦去上室细胞,下室细胞用PBS冲洗;4%多聚甲醛固定30 min;用0.1%结晶紫溶液染色15 min。最终,每组在显微镜下随机选取视野拍照,观察细胞并计数。
1.3.5 Transwell实验检测细胞侵袭 将Martrigel基质胶置于4 ℃至完全融化,用无血清培养基以1 ∶8于冰上稀释Martrigel标准胶,取50 μL 稀释的Martrigel胶包被Transwell上室,4 ℃风干,37 ℃使其彻底凝固。
实验组:对实验组疑似乳腺癌患者实施MRI检查,患者在这段过程中保持仰卧体位,对冠状位、矢状位和横断位先进行常规扫描,再进行增强扫描,将对比剂注入患者肘静脉。将扫描参数设置为层厚1.2毫米,扫描6次,每次间隔20秒,扫描时长60秒,在扫描过程中发现病灶要通过患者静脉注射每千克体重0.1mmol的对比剂,扫描时长为6min20s。
取“1.3.1”转染细胞,每组1×105个/mL细胞(100 μL)接种于Transwell上室,再将Transwell小室放入含10% 胎牛血清培养基的24孔板中培养24~48 h;取出Transwell小室,用棉签擦拭小室内部细胞及残余的 Matrigel胶,PBS清洗3次;4%多聚甲醛固定30 min;0.1%结晶紫溶液染色15 min;镜检计数并分析作图。
1.3.6 蛋白质免疫印迹检测细胞内SATB2及EMT相关蛋白表达 取“1.3.1”转染细胞,加入含PMSF的蛋白裂解液,冰上静置20 min,4 ℃ 12 000 r/min离心20 min;取上清液400 μL于EP管,按BCA试剂盒说明书操作,测定蛋白浓度;按1 ∶5比例加入5×上样缓冲液,金属浴中95 ℃孵育10 min。每孔上样30 μg蛋白,行10% SDS-PAGE,80 V 30 min,120 V 60 min;恒压100 V 90 min,将蛋白转移至PVDF膜;5%脱脂奶粉室温封闭1 h;加入一抗SATB2、N-钙黏蛋白、E-钙黏蛋白和VEGF(均1 ∶1 000稀释)以及内参β-肌动蛋白(1 ∶5 000稀释),摇床4 ℃孵育过夜;TBST洗膜3次,10 min/次;加入二抗(1 ∶2 000稀释),室温孵育1.5 h;TBST洗膜3次,10 min/次;ECL显色。用Image J分析条带灰度值,确定样品中目的蛋白表达相对含量。
1.4 miR-4306靶基因预测和鉴定
经在线靶基因预测网站Targetscan、Starbase发现 miR-4306与SATB2的3′-UTR端有互补结合位点,用双荧光素酶报告系统鉴定靶向关系。分别将SATB2 WT和MUT荧光素酶报告载体同miR-4306 mimics、mimics NC共转染到骨肉瘤细胞中,具体分组如下:Luc-SATB2-WT+miR-4306 mimics组、Luc-SATB2-WT+miR-4306 mimics NC组、Luc-SATB2-MUT+miR-4306 mimics组、Luc-SATB2-MUT+miR-4306 mimics NC组。24 h后收集细胞,每孔加入200 μL裂解液裂解细胞,4 ℃裂解20 min,将裂解后的细胞样品保存至-80 ℃;每组取细胞裂解液70 μL加至96孔板,每孔加荧光素酶检测试剂100 μL,上机检测萤火虫荧光素酶活性;取100 μL海肾荧光素酶检测试剂(检测底物 ∶缓冲液=1 ∶100)加入每孔,上机检测海肾荧光素酶活性。用蛋白免疫印迹法检测各组细胞中SATB2蛋白表达水平,方法同“1.3.6”。
1.5 细胞分组与共转染
将细胞分组如下:miR-4306 mimics NC+LV-NC组、miR-4306 mimics NC+LV-SATB2组、miR-4306 mimics+LV-NC组和miR-4306 mimics+LV-SATB2组;构建SATB2过表达载体(LV-SATB2)及空载组(LV-NC),将miR-4306 和SATB2共转染至骨肉瘤细胞株中。随后通过CCK-8、克隆形成实验检测细胞增殖能力,Transwell实验检测细胞迁移及侵袭,蛋白免疫印迹法检测各组细胞中SATB2蛋白表达水平和EMT相关蛋白表达水平,具体实验方法同前。
1.6 统计学分析
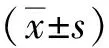
2 结果
2.1 miR-4306在骨肉瘤细胞系中表达
结果显示,与人成骨细胞hFOB 1.19相比,人骨肉瘤Saos-2,MNNG/HOS CI #5细胞中miR-4306表达水平明显降低(P均<0.01),见图1。

*:P<0.01,与人成骨细胞hFOB 1.19相比
2.2 miR-4306过表达抑制骨肉瘤细胞增殖、侵袭、迁移和EMT
如图2所示,在骨肉瘤Saos-2和MNNG/HOS CI #5细胞中,miR-4306 mimics组中miR-4306表达水平显著高于mimics NC组(t=-30.02,-108.05,P均<0.01);与mimics NC组相比,miR-4306 mimics组24、48、72 hD值及克隆形成率均显著降低(P<0.05或<0.01),细胞迁移及侵袭能力均明显降低(P<0.05或<0.01)。此外,与mimics NC组相比,miR-4306 mimics组中N-钙黏蛋白、VEGF蛋白表达水平均明显降低(P均<0.01),E-钙黏蛋白表达水平明显升高(P均<0.01)。由此表明,miR-4306 过表达可抑制骨肉瘤细胞增殖、侵袭、迁移和EMT。
2.3 SATB2是miR-4306的直接靶标
通过在线靶基因预测网站Starbase, Targetscan发现,miR-4306与SATB2存在互补结合位点(图3A);双荧光素酶实验结果显示,与Luc-SATB2-WT+miR-4306 mimics NC组比,Luc-SATB2-WT+miR-4306 mimics组荧光素酶活性明显降低(P<0.01),而在Luc-SATB2-MUT的共转染组中两者荧光素酶活性未见明显差异(图3B)。此外,骨肉瘤细胞Saos-2和MNNG/HOS CI #5中SATB2 mRNA表达水平明显高于人成骨细胞hFOB 1.19(t=-7.76,-5.27,P均<0.01,图3C);与mimics NC组相比,miR-4306 mimics组SATB2蛋白表达水平明显降低(t=12.76,t=13.56,P均<0.01,图3D)。由此表明,SATB2是miR-4306的下游直接靶标,上调miR-4306可抑制骨肉瘤细胞中SATB2蛋白表达。
2.4 miR-4306通过下调SATB2表达抑制骨肉瘤细胞增殖、迁移、侵袭和EMT
结果显示,在Saos-2和MNNG/HOS CI #5细胞中,与miR-4306 mimics NC+LV-NC组相比,miR-4306 mimics NC+LV-SATB2组D值及克隆形成率均显著升高(P<0.05或<0.01),细胞迁移及侵袭能力亦明显增强(P<0.05或<0.01),N-钙黏蛋白、VEGF蛋白表达水平明显上调(P<0.05或<0.01),E-钙黏蛋白表达水平明显降低(P<0.05或<0.01);与miR-4306 mimics+LV-NC组相比,miR-4306 mimics+LV-SATB2组D值及克隆形成率均显著升高(P<0.01或<0.05),细胞迁移及侵袭能力亦明显增强(P<0.05或<0.01),N-钙黏蛋白和VEGF蛋白表达水平明显上调(P均<0.01),E-钙黏蛋白表达水平明显降低(P均<0.01)。见图4。由此可见,LV-SATB2一定程度上可逆转miR-4306对骨肉瘤细胞增殖、侵袭、迁移和EMT的影响。
3 讨论
研究表明,致癌基因的异常激活和抑癌基因由于体细胞突变和表观遗传的失活在骨肉瘤中起着关键的致病作用[13]。miR-4306作为一个肿瘤调控因子,其表达水平的高低与肿瘤细胞的生物学行为相关。Zhao等[10]在对三阴性乳腺癌的研究中证实,miR-4306可发挥类似抑癌基因的作用,从而影响三阴性乳腺癌细胞的恶性生长与侵袭。本研究发现,miR-4306在多种骨肉瘤细胞株中的表达均明显下调,这与前期的miR-4306与肿瘤相关研究一致[9-10]。
EMT是上皮特征逐渐消失并逐渐表现出间质特征的过程,其在胚胎发育、组织修复以及各种肿瘤发生、侵袭、转移和耐药性中均发挥重要作用[14]。研究证实,肿瘤细胞EMT过程中伴随着多种标志性蛋白表达改变,如E-钙黏蛋白、N-钙黏蛋白和VEGF蛋白等[15-16]。本研究发现,转染miR-4306 mimics后,骨肉瘤细胞中E-钙黏蛋白表达水平明显升高,同时N-钙黏蛋白和VEGF蛋白表达水平明显下降,提示miR-4306抑制骨肉瘤细胞的侵袭、迁移和EMT。

A:qRT-PCR检测骨肉瘤细胞中miR-4306相对表达量;B:CCK-8检测细胞增殖能力;C:克隆形成实验检测细胞增殖;D:Transwell实验检测细胞迁移;E:Transwell实验检测细胞侵袭;F:蛋白免疫印迹法检测信号通路蛋白表达;**:P<0.01,*:P<0.05,与mimics NC组相比;#:P<0.05,##:P<0.01,与同时间点mimics NC组相比
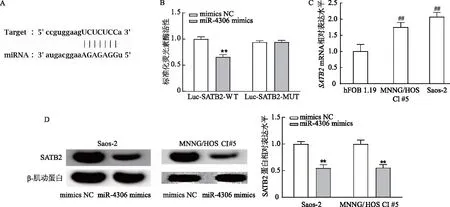
A:预测miR-4306与SATB2存在互补结合位点;B:双荧光素酶实验证实miR-4306与SATB2的靶向结合位点;C:qRT-PCR检测人成骨细胞hFOB 1.19以及骨肉瘤细胞Saos-2,MNNG/HOS CI #5中SATB2 mRNA相对表达水平;D:蛋白质免疫印迹检测转染后骨肉瘤细胞中SATB2蛋白相对表达水平;**:P<0.01,与mimics NC组相比;##:P<0.01,与人成骨细胞hFOB 1.19相比
此外,本研究采用Starbase、Targetscan等生物靶基因预测网站分析,并通过双荧光素酶报告基因实验证实,SATB2是miR-4306的直接下游靶基因。SATB2是一种转录因子和表观遗传调节因子,其在中枢神经发育、癌症发展和预后以及免疫调节方面发挥重要作用[17-18]。研究表明,SATB2可通过抑制非小细胞肺癌细胞中的EMT介导的转录因子的表达来防止EMT诱导,而SATB2基因敲除可促进转化生长因子-β诱导的非小细胞肺癌细胞EMT和侵袭[19]。本研究结果显示,SATB2在骨肉瘤细胞系中表达水平明显上调;此外,通过转染SATB2过表达载体上调SATB2表达后发现,miR-4306对骨肉瘤细胞侵袭、迁移和EMT的抑制作用明显减弱,提示miR-4306通过抑制SATB2表达参与调控骨肉瘤细胞的生物学行为。
综上所述,miR-4306在骨肉瘤转移以及恶性进程中发挥类似抑癌基因的作用,其可能与抑制下游SATB2表达有关。本研究目前仅通过体外细胞实验探讨miR-4306对骨肉瘤发生与发展的作用机制,尚缺乏临床样本及动物实验的验证,有待后续进一步完善。
