乌司他丁治疗未液化细菌性肝脓肿合并感染性休克的临床疗效分析
2023-01-31郭明凤高利利陶佳丽吴魏芹孙青松赵红梅孙虹陈豆豆
郭明凤,高利利,陶佳丽,吴魏芹,孙青松,赵红梅,孙虹,陈豆豆
肝脓肿(liver abscess,LA)主要是由微生物经动脉、静脉、胆道及直接播散等途径引起的肝脏局灶性、感染性病变,是临床上较为常见的急性疾病之一,而细菌性肝脓肿(pyogenic liver abscess,PLA)占LA发病率的80%以上[1-2]。近年来流行病学调研[3]显示PLA的发病率、致死率均呈逐年上升趋势。PLA的临床症状较重,表现为畏寒、高热、肝区疼痛、恶心、呕吐、黄疸等一系列症状,早期若得不到及时治疗,易进展至感染性休克,导致脏器功能衰竭,危及生命[1-4]。其中未液化细菌性肝脓肿,早期无法进行穿刺引流、手术干预等措施,往往病死率较高。因此,早期控制其炎症反应、维持循环稳定、保护脏器功能尤为重要。有研究[5-6]显示乌司他丁作为一种蛋白酶抑制剂,可有效调节炎症因子释放,降低内毒素反应,改善微循环缺血再灌注损伤,从而降低临床病死率。但目前乌司他丁在治疗PLA方面报道较少,鉴于此,本文研究分析乌司他丁治疗未液化细菌性肝脓肿合并感染性休克的疗效,以期为临床治疗提供依据。
1 资料与方法
1.1 一般资料 选取2018年3月—2022年3月南京医科大学附属淮安第一医院重症医学科收治的未液化细菌性肝脓肿合并感染性休克患者89例为研究对象。纳入标准[7-8]:(1)有畏寒、高热、肝区疼痛等消化系统感染症状。(2)经B超、CT、MRI等影像学检查证实为细菌性肝脓肿。(3)存在全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),如出现两种或两种以上的下列表现即可诊断SIRS①体温>38 ℃或<36 ℃;②心率>90次/分;③过度通气,呼吸频率>20次/分,或PaCO2<4.3 kPa;④血白细胞>12×109/L,<4×109/L,或幼稚型细胞>10%。(4)收缩压低于12.0 kPa或较原基础值下降的幅度超过5.33 kPa至少1h,或血压依赖补液或药物维持。(5)有组织灌注不良的表现,如少尿(<30 mL/h)超过1 h,或高乳酸血症等。(6)细菌培养阳性,如无明确的病原学证据时,患者经相关抗感染治疗后,其临床症状得到控制,病灶缩小、消失。排除标准[7-10]:(1)由阿米巴、结核、真菌等其他微生物引起的LA;(2)已经液化或需行穿刺、手术等治疗的PLA;(3)24h内死亡的患者;(4)细菌性肝脓肿为非主要诊断的患者;(5)临床资料、治疗过程不完整的患者。随机分为对照组(46例)和研究组(43例)。2组患者性别、年龄、脓肿个数、部位及直径等一般资料比较差异无统计学意义(P>0.05) ,具有可对比性。见表1。本研究取得所有患者或家属知晓,并签署知情同意书,同时获得本院医学伦理委员会审批通过。

表1 2组患者一般资料比较
1.2 方法 对照组患者给予液体复苏、维持循环稳定、吸氧、维护重要脏器功能及营养支持等处理,在抗菌药物使用方面,初始阶段应用碳青霉烯类(如亚胺培南西司他丁1 g/8 h),待血培养后,根据其病原学药敏实验结果进行调整。研究组在对照组基础上,予以0.9%氯化钠50 mL联合乌司他丁20万单位(广东天普生化医药股份有限公司,国药准字H20040505 ),静脉泵入维持1 h,每8小时/次,连用3 d以上,待患者休克及感染症状得到控制后停药。
1.3 观察指标 (1)实验室指标。比较2组患者治疗前及治疗后第3天清晨空腹血液WBC、降钙素原(PCT)、CRP、TNF-α及IL-6水平。(2)临床指标。比较2组患者ICU住院时间、发热持续时间及血管活性药物维持时间。(3)肝功能指标。比较2组患者治疗前及治疗后第3天清晨空腹血清总胆红素(TBil)、谷丙转氨酶(ALT)及谷草转氨酶(AST)水平。

2 结果
2.1 2组患者实验室指标比较 治疗前,2组患者各实验室指标水平比较差异无统计学意义(P>0.05);治疗后第3天,2组患者WBC、CRP、PCT,TNF-α及IL-6水平均低于治疗前,且研究组均低于对照组,差异有统计学意义(P<0.05)。见表2。
2.2 2组患者临床指标比较 研究组患者ICU住院时间、发热持续时间及血管活性药物维持时间均短于对照组,差异有统计学意义(P<0.05)。见表3。
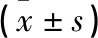
表2 2组患者实验室指标比较

表3 2组患者临床指标比较
2.3 2组患者肝功能指标比较 治疗前,2组患者各肝功能指标水平比较差异无统计学意义(P>0.05);治疗后第3天,2组患者TBil、ALT及AST水平均低于治疗前,且研究组均低于对照组,差异均有统计学意义(P<0.05)。见表4。
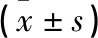
表4 2组患者肝功能指标变化比较
3 讨论
感染性休克又称为脓毒症休克,是ICU常见病、多发病之一,其发病急、危、重,且往往合并一个或多个脏器功能不全,若早期循环衰竭症状得不到控制,则患者病死率超30%[11]。而未液化细菌性肝脓肿引起的感染性休克病情更为凶险,因肝脏炎症部位脓肿未液化无法进行穿刺、手术等干预,脓毒血症的病程较长,其感染病灶持续释放大量内毒素、氧自由基等炎症介质,使患者出现持续性低血压等循环障碍,进而危及生命[12]。对于此类患者早期控制其机体炎症反应、保护脏器功能是纠正休克、改善预后的主要措施。
乌司他丁是从健康人尿中分离纯化的一种能抑制多种蛋白水解酶活力的糖蛋白,对中性粒细胞弹性蛋白酶、透明质酸酶等多种炎性介质酶的释放有抑制作用,另具有稳定溶酶体膜、清除氧自由基等多种降低SIRS反应的作用[5-6]。此外,其还可保护血管内皮细胞、降低脓毒症中毛细血管通透性、抑制微血栓形成,减轻缺血缺氧再灌注造成的组织细胞损害,使受损的重要脏器功能得以保护[13]。因此,乌司他丁具有抗炎、保护脏器功能的双重协同作用。有研究[13]显示乌司他丁在感染性休克、DIC、重症胰腺炎、失血性休克和其他重症疾病治疗中均有良好疗效。
WBC、PCT、CRP、TNF-α及IL-6是临床上常见评估感染性疾病的指标,其中TNF-α、IL-6是机体急性感染期最先激活、释放的细胞因子,可启动脓毒症的SIRS反应,是导致脓毒休克患者病情恶化的关键;PCT是脓毒症诊断及预后标志物之一,其升高程度与感染严重性、病死率呈正相关,且其敏感性优于其他炎症因子[14]。本研究中,所有患者治疗后相关炎症因子水平均较治疗前下降,且研究组患者WBC、PCT、CRP、TNF-α及IL-6下降趋势较对照组加快,这证实了乌司他丁在控制感染、抑制内毒素等炎症反应方面具有良好的疗效,与既往乌司他丁在肺部感染、泌尿感染、外伤后感染等治疗方面的研究[15]一致。ICU住院时间、发热持续时间及血管活性药物维持时间较对照组缩短了1 d左右,与Hu等[16]报道乌司他丁可以有效减少脓毒休克患者病程1 d结果相同。
未液化细菌性肝脓肿合并感染性休克患者的肝脏是受累较重的靶器官之一,SIRS时机体大量炎性介质的产生容易诱导肝细胞凋亡,加之组织缺血再灌注损伤、微血栓形成,极易导致急性肝损伤甚至发生肝衰竭[7]。TBil、ALT、AST水平变化可反映肝功能损害的严重程度[17],在本研究中,研究组TBil、ALT、AST水平优于对照组。这可能与乌司他丁下调了促分裂原活化蛋白激酶的表达,进而有效清除内毒素及保护细胞的线粒体,增强机体抗氧化防御能力,从而恢复肝细胞结构和功能的机制有关[5]。
综上,在常规治疗基础上联合应用乌司他丁能够有效控制未液化细菌性肝脓肿合并感染性休克患者的炎症反应,促进脏器功能恢复,缩短治疗时间,改善患者的临床症状,值得在临床实践中推广应用。但本研究病例样本量较少,研究结论可能存在一定的局限性,仍需大样本的前瞻性研究进一步证实。
