引入靶区外扩预测放射治疗中危及器官自动分割的平均剂量偏差
2023-01-31许六军张玉洁张建英
许六军,张玉洁,张建英
(复旦大学附属中山医院放疗科,上海 200032)
放射治疗(放疗)应在使靶区达到处方剂量的同时保证危及器官(organ at risk, OAR)受照剂量在安全范围内[1],分割OAR是其中的重要环节[2]。传统方法采用人工完成分割,操作耗时,且具有操作者主观依赖性。近年来,自动分割OAR技术快速发展,现已开发出许多自动分割算法和自动分割模型[3-5],如何评估其可否用于临床成为亟待解决的问题[6-7]。几何学参数是评估自动分割效果的常用指标,可有效评估分割图像的几何特征[7];剂量学评估则可有效预测治疗肿瘤效果及OAR毒副作用[8];前者无须考虑剂量分布,方便高效,后者对临床更有参考价值,但耗时长[9]。计划靶区体积(planning target volume, PTV)是放疗剂量分布的基础。有学者[10]提出将PTV位置引入几何参数,可在无剂量分布数据的情况下评估剂量最大值。本研究观察引入靶区外扩预测自动分割OAR产生的平均剂量偏差的价值。
1 资料与方法
1.1 一般资料 随机选取2019年5月—2021年10月100例于复旦大学附属中山医院接受放疗(医科达直线加速器VersaHD)的直肠癌患者,男66例、女34例,年龄29~83岁、平均(59.6±11.0)岁;均具有完整的CT、PTV及OAR、放疗计划和剂量分布等资料;排除采集放疗影像时条件或分辨率、计算网格等达不到本研究标准者。治疗前患者或家属签署知情同意书。
1.2 仪器与方法
1.2.1 分割组织和放疗计划 利用Siemens Healthcare大孔径CT仪获取层厚3 mm、分辨率0.977 mm×0.977 mm的定位图像,导入Monaco计划系统,手动分割靶区和组织,并设计放疗计划。由主治医师手动分割PTV,经副主任或主任医师审核;由2名工作7年以上的主管技师手动分割膀胱、小肠和双侧股骨头共4个OAR。之后采用AccuContour软件进行自动分割,以模型微调功能获得符合标准的OAR分割模型,分割膀胱、小肠和双侧股骨头。采用Monaco计划系统进行优化设计,计算网格为2 mm×2 mm×2 mm。最后将PTV均匀外扩,外扩距离分别为5、10、20、30及50 mm。
1.2.2 剂量重采样和结构预处理 将CT图像、分割结构和剂量分布以DICOM格式导入Python程序。CT网格为0.977 mm×0.977 mm×3 mm,剂量网格为2 mm×2 mm×2 mm;以CT网格为基础,采用线性插值对剂量进行重采样。
于DICOM格式下,以轮廓点的三维坐标存储ROI。基于CT网格判断每个网格点是否在ROI轮廓内,得到该ROI的掩膜;所用掩膜包括PTV、OAR及PTV外扩环与OAR的重叠部分(记为PTV_ring ∩ OAR Mask)。如PTV外扩10~20 mm的环与膀胱重叠,则记为PTV_ring_10~20 mm ∩ Bladder Mask,其获得方式如下:①使用PTV轮廓(红线)得到PTV Mask(浅红色填充),见图1A;②以膀胱轮廓(蓝线)得到Bladder Mask(浅蓝色填充),见图1B;③分别得到PTV外扩10 mm和20 mm的轮廓(绿线),以在PTV 20 mm 掩膜中、但不在PTV 10 mm 掩膜中的区域为PTV外扩10~20 mm环的掩膜,记为PTV_ring_10~20 mm Mask(浅绿色填充),见图1C;④PTV外扩10~20 mm环与膀胱重叠区域的掩膜为同时在PTV_ring_10~20 mm Mask和Bladder Mask中的区域,记为PTV_ring_10~20 mm ∩ Bladder Mask(浅橙色填充),见图1D。

图1 基于膀胱癌患者盆腹部轴位CT图中的PTV(A)、膀胱(B)、PTV外扩10~20 mm环(C)和重叠区域(D)的掩膜
1.2.3 OAR的分段平均剂量 对于1个OAR,以CT网格分割后,其结构包含N个点,分别记为i1,i2,…,iN,则该OAR的平均剂量为:
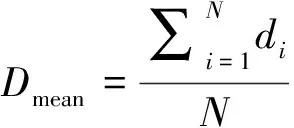
(1)
其中di为点i的剂量。利用OAR中每个点与PTV的距离将其分为7段,与PTV的距离分别为<0、[0,5)、[6,10)、[10,20)、[20,30)、[30,50]及>50 mm,分别计算上述7段OAR的剂量平均值。
1.2.4 基于靶区外扩预测剂量差异 根据公式(2)计算手动分割与自动分割OAR的平均剂量差异:
ΔDmean=Dmean(manual)-Dmean(auto)

(2)
将OAR分为上述7段,则该公式可简化为7段求和,平均剂量偏差为上述7段剂量偏差的统计值。见公式(3):
ΔDmean=Dmean(manual)-Dmean(auto)
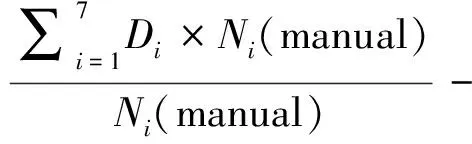
(3)
其中Di为i段的平均剂量,Ni为i段的网格点数目。
1.3 数据分析及统计学分析 于100例中随机选取30例作为训练集,统计7段对应的剂量平均值Di;以其余70例为测试集,代入每段的Di,得到预测的手动和自动分割平均剂量差异;计算预测与实际平均剂量的差异,平均剂量差异即该OAR手动分割平均剂量与自动分割平均剂量之间的差值。
对上述100例进行重新分组,随机选择50例统计7段Di,并预测其余50例的预测平均剂量与实际平均剂量差异,以验证统计病例选择是否影响研究结果。
采用Origin2020软件绘制散点图,以Python编程计算一致性相关系数(concordance correlation coefficient, CCC),以CCC>0.9为一致性好。对预测与实际平均剂量的差异进行直方图统计。
2 结果
2.1 OAR的分段平均剂量 30例直肠癌的7段平均剂量见表1。其中的剂量为每个OAR每段距离的代表剂量,如对于膀胱中距离PTV>50 mm的区域,认为每个网格点的剂量均为14.39 Gy;将代表剂量用于后续预测平均剂量。

表1 训练集30例直肠癌患者不同部位与PTV不同距离的7段平均剂量(Gy)
2.2 平均剂量差异 测试集70例中,对于膀胱,69例预测与实际平均剂量差异<0.5 Gy,1例差异为1.3 Gy;对于小肠,69例剂量差异均<3 Gy,1例为3.1 Gy;对于双侧股骨头,所有70例预测与实际平均剂量差异均<0.5 Gy。对膀胱、小肠和左、右侧股骨头,预测与实际平均剂量差异的CCC分别为0.96、0.86、0.81和0.69。见图2。

图2 针对测试集70例预测与实际平均剂量的散点图(上图)及差异直方图(下图) A~D.膀胱、小肠,左、右侧股骨头 (红线对应差异为0,蓝线内区域对应绝大部分病例所在区间)
针对50例测试集再次进行预测,46例膀胱预测与实际平均剂量的差异均<0.5 Gy,4例差异分别为0.58、0.57、0.74、0.93 Gy,49例小肠预测与实际平均剂量的差异均<3 Gy,1例差异为13.60 Gy;对于双侧股骨头,所有病例预测与实际平均剂量差异均<0.5 Gy。对于膀胱、小肠和左、右侧股骨头,预测与实际平均剂量差异的CCC分别为0.97,0.90,0.82和0.78。
3 讨论
自动分割是近年的热门研究领域[11]。既往评估自动分割效果多注重于几何学指标,而剂量学指标才是与放疗效果及毒副反应密切关联的因素[7]。近年来,越来越多的研究者开始关注自动分割的剂量学评估[12-14]。直接剂量学评估需要放疗计划,效率相对较低。几何学和剂量学评估各有其优势,将两者结合可实现高效评估自动分割,更加贴近临床需求。将PTV位置引入自动分割的几何评估,在一定程度上也是将剂量分布信息引入几何评估。
本研究选择100例直肠癌患者,采用自动分割的OAR并加以优化,以制定训练集放疗计划,真实反映了自动分割在临床应用中可能产生的剂量差异[15-16];通过引入PTV与OAR的相对位置关系并设计几何指标,观察OAR手动与自动分割的平均剂量差异。本研究结果表明,对于70例测试集,双侧股骨头预测平均剂量与实际平均剂量差异均<0.5 Gy,69例膀胱的差异均<0.5 Gy,69例小肠的差异<3 Gy;而在50例测试集亦获得近似结果,表明靶区外扩能对大多数直肠癌病例较好地预测OAR自动分割用于临床时可能引起的平均剂量偏差。
本研究4种OAR中,小肠的结果相对较差,特别是在50例测试集中,1例小肠的预测平均剂量与实际平均剂量差异为13.60 Gy,可能原因在于自动分割小肠相对困难,分割效果较差,且影响因素较多而复杂;而本研究方法可能更适用于自动分割效果较好的OAR。
综上所述,引入靶区外扩可有效预测直肠癌放疗中自动分割OAR产生的剂量偏差。
