饲料中添加辅酶Q10对吉富罗非鱼幼鱼生长、抗氧化能力和组织结构的影响
2023-01-30葛汝祥娄格格姜能座郭雅哲朱晓鸣李晨昊刘轩宇陈新华
黄 莹 葛汝祥 娄格格 满 洲 姜能座 郭雅哲 朱晓鸣李晨昊 刘轩宇 陈新华
(1.福建农林大学海洋学院, 福建省海洋生物技术重点实验室, 福州 350002; 2.福建省测试技术研究所, 福州 350003;3.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
随着环保意识和健康认知的不断提高, 绿色养殖成为新时代产业发展的前进方向, 而寻找多功能、无污染、无残留的饲料添加剂是促进水产养殖可持续发展的必经之路。辅酶Q10(Coenzyme Q10), 又称泛醌, 是一种天然存在的脂溶性物质, 结构与维生素K、维生素E和质体醌相似, 其作为线粒体电子传递链(ETC)中的辅助因子参与细胞生物能量学, 对于ATP产生至关重要[1]。辅酶Q10主要来源为机体自身合成, 机体合成量会随年龄增加而减少[2]。辅酶Q10合成量不足会导致机体组织出现线粒体功能障碍和氧化损伤, 对心肌、大脑等需能高的组织造成危害[3]。另外, 辅酶Q10的缺乏还会导致CoQ2、CoQ6等基因的变异, 肝脏、肾脏等器官受损引起多种疾病, 因此需要外源补充保证体内辅酶Q10含量的稳定[4]。由于辅酶Q10为脂溶性, 在被动物摄食后, 易透过细胞膜被完全吸收[5]。有研究表明, 高剂量的辅酶Q10添加也不会对动物产生明显的毒性[6—8], 说明辅酶Q10是一种多功能、易吸收、安全性高的营养性添加剂。
辅酶Q10可清除自由基[9], 降血脂[10], 抗氧化[11],提高免疫力[12], 对肝肾具有保护作用[13], 并且可治疗多种疾病[14], 提高动物存活率[15], 保证动物精子质量[16]等功能。辅酶Q10自1957年Frederick Crane从牛心脏中分离得到后[17], 已在食品、医药和畜牧等领域有广泛应用[18,19]。在小鼠摄食辅酶Q10后,脂肪组织中的脂质氧化增多, 脂质清除率提高, 减少了脂肪组织的重量[20]。用辅酶Q10可治疗醋酸铅引起的氧化应激, 大鼠皮质组织中SOD、CAT和GSH-Px酶活性显著提升, MDA含量显著降低, 同时SOD和CAT的基因表达量显著上调[21]。辅酶Q10能发挥保护缺血心肌的作用, 可有效改善冠心病患者的心功能[22]。高血压患者接受辅酶Q10外源补充后, 其血压水平明显下降[23]。饲料中补充辅酶Q10后, 鹌鹑(Coturnix japonica)的日采食量、日增重和饲料转化率都得到显著提升[24]。辅酶Q10通过发挥其抗氧化特性, 可提高雄鹿精子质量和胚胎的发育能力[25]。辅酶Q10能显著改善动物生长性能和肉品质, 在饲料行业具有广阔的应用前景[26]。
罗非鱼又名非洲鲫鱼, 是我国重要的水产养殖鱼类。自20世纪50年代引入我国后, 养殖产量和养殖水平得到大幅提升。目前, 中国已是罗非鱼最大的生产国和消费国, 罗非鱼养殖具有较好的前景[27]。吉富罗非鱼是罗非鱼经遗传性状改良后的品种, 具有生长快、食性杂、易饲养和肉质鲜美等优点。目前关于辅酶Q10在水产动物上的研究鲜有报道。本实验旨在研究长期摄食辅酶Q10对吉富罗非鱼幼鱼生长、体成分、抗氧化能力、肝脏抗氧化相关基因表达和抗病力等方面的影响, 为辅酶Q10应用于水产饲料提供理论依据。
1 材料与方法
1.1 养殖系统
养殖实验在循环水养殖系统中进行, 系统由12个体积相同的圆柱体PP缸(直径80 cm, 桶高70 cm)组成, 水体体积为180 L/缸, 每缸水流速度为0.6 L/min。每天检测2次气温和水温, 每2周检测水体溶氧和氨氮情况。实验期间, 水温为24—26℃, 保持水体中溶解氧含量在6 mg/L以上, 氨氮为0.2—0.4 mg/L, pH为6.8—7.0。光照周期12L﹕12D, 光照周期为每天8:00到20:00。
1.2 实验饲料及实验设计
实验基础饲料的原料组成和常规化学成分如表1所示。实验基础饲料添加不同水平辅酶Q10(0、40、80和120 mg/kg)配置成4种实验饲料。以豆粕、鸡肉粉、菜粕、棉粕和鱼粉等为主要蛋白源, 以豆油为主要脂肪源。饲料原料由福建大昌生物科技实业有限公司提供。辅酶Q10购自美国Sigma公司。将辅酶Q10纯品按设计量与豆油充分混合, 然后将含有不同含量辅酶Q10的大豆油添加到各组实验饲料中混合均匀, 用饲料机制成直径为2 mm的颗粒饲料, 在室温下于阴暗处平铺放置, 待干燥后储存于–20℃冰箱。

表1 实验基础饲料配方及化学组成(g/kg干物质)Tab.1 Diet formulation and chemical composition of experimental diets (g/kg in dry matter)
1.3 实验鱼与饲养实验
实验吉富罗非鱼幼鱼来自福建省淡水水产研究所养殖基地。正式实验前挑选健康活泼、规格相近、体表无明显损伤的吉富罗非鱼幼鱼暂养于室内循环水养殖系统中。用实验基础饲料暂养2周后, 挑选规格相近的312尾吉富罗非鱼幼鱼随机投放到12个养殖缸中, 每养殖缸放养26尾。将这12个缸随机分成4个实验组, 每组再设置3个平行, 进行为期56d的养殖实验。在暂养期间和实验期间, 每天分别于8:00和16:00连续投喂1h达到表观饱食(少量多次地循环投喂, 不留残饵或极少残饵)。实验开始2周后, 每天于幼鱼摄食2h后用虹吸管收集鱼缸中新鲜的鱼粪, 烘箱中60℃烘干, –20℃保存, 留作干物质消化率分析用。每天记录水温、摄食情况和实验鱼死亡情况, 在养殖实验结束后, 实验鱼饥饿24h后称取每缸鱼的终末体重。
1.4 实验取样
在养殖实验结束后, 每缸分别取12尾鱼用MS-222(购自美国Sigma公司)麻醉。麻醉后随机取3尾鱼, 使用注射器于尾静脉采血, 于4℃下以3500 r/min离心10min, 取3尾鱼血清混合成一个样品于–80℃冰箱中保存, 用于血液指标的测定。在冰盘上解剖出肝脏, 3尾鱼肝脏混合成1个样品, 放入冻存管中经液氮急冻, 稍后转移到–80℃冰箱中保存, 用于肝脏抗氧化酶的测定。另取3尾鱼称取体重并测量体长, 解剖后称取内脏团和肝脏质量, 用于计算肥满度、脏体比和肝体比。再取3尾鱼解剖出肝脏和肠道, 经中性甲醛固定后进行HE染色, 制作切片, 绒毛密度按照Barducci 等[28]的方法计算每mm2的绒毛个数。剩余3尾鱼, 解剖出肝脏后混合, 置于–80℃保存, 用于分析肝脏相关基因的表达。
1.5 样品的测定
采用外源指示剂(Y2O3)测量干物质消化率[29]。根据指示剂及干物质在饲料和粪便中的含量变化,计算干物质消化率。
实验饲料和鱼体的水分、粗蛋白、粗脂肪、灰分的测定参照文献[30]的方法测定: 将样品在105℃烘干至恒重, 通过失重法测定干物质, 从而计算出水分; 粗蛋白采用FOSS 定氮仪(2300 Kjeltec Analyzer Unit)测定; 粗脂肪采用索氏抽提仪(Soxtec system HT6, Tecator, Hoganas, Sweden)测定; 灰分在马福炉中550℃燃烧3h, 失重法测定。
过氧化氢酶(CAT)、总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和谷胱甘肽S转移酶(GST)活性及丙二醛(MDA)、胆固醇(TC)和甘油三酯(TG)含量均采用南京建成生物工程研究所试剂盒测定。
肝脏相关基因表达测定采用实时荧光定量PCR (qRT-PCR)反应体系。根据TRIzol法提取样品的总RNA后, 再根据试剂盒说明逆转录合成cDNA。逆转录过程中使用DNA酶去除基因组DNA, 引物的扩增效率在有效范围(0, 1)之内。因β-actin具有氨基酸序列的高度保守性, 能在不同组织中持续衡量地表达, 且表达量高, 故将其作为内参基因用来计算基因的相对表达量[31]。以逆转录cDNA第一条链为模板, 然后β-actin与目的基因引物同时在不同反应孔内进行qRT-PCR扩增。总反应体积为20 μL的反应体系如下: cDNA模板9 μL, 10 μL SYBR Green Realtime PCR Master Mix, 10 μmol/L正/反定量引物各0.5 μL。每个时相做5个平行样品, 每个样品做4次重复。PCR反应条件: 95℃ 15s, 60℃ 1min,40个循环。本实验所需特定引物(表2)均在NCBI(the National Center for Biotechnology Information)数据库中设计[32]。经验证后使用特定引物组扩增选定的基因, 同时对每个基因的溶解曲线进行分析,溶解曲线均无杂峰, 证明引物设计符合实验要求[33]。

表2 实验所用引物Tab.2 Primers used in the experiment
根据仪器自动给出样品的RQ值(2–ΔΔCt, ∆Ct=样品目的基因的Ct值–内参基因β-actin Ct值, ΔΔCt=每一个样品的∆Ct值–基准样品的∆Ct值), 记录下RQ值, 基因表达水平均用RQ平均值±标准误(mean±SE)来表示。
1.6 攻毒实验
所用的病原为嗜水气单胞菌, 购自广东省微生物菌种保藏中心(GIMCC)。将嗜水气单胞菌接种在FWA培养基(蛋白胨5 g/L、牛肉膏2.5 g/L、酵母膏2.5 g/L、葡萄糖1 g/L、NaCl 15 g/L、MgSO40.05 g/L、K2HPO40.2 g/L和琼脂15 g/L, pH 7.2—7.4)上, 30℃培养36h后, 用0.85%的无菌生理盐水洗脱菌体, 菌液浓度为3×107cfu/mL。在56d的养殖试验结束后,每缸随机取10尾鱼, 经胸鳍基部注射0.3 mL嗜水气单胞菌活菌悬液, 进行攻毒实验, 分别记录攻毒后1—10d的死亡情况, 计算累计存活率。
1.7 数据处理
利用下列公式计算特定生长率、摄食率和饲料效率:
特定生长率(SGR, %/d)=100×(LnWt–LnW0)/t
摄食率(FR, %BW/d)=100×I/[(Wt+W0)/2]/t
饲料效率(FE, %)=100×(Wt–W0)/I
干物质消化率(DMD, %)=100×(1–B/B1)
肥满度(CF, g/cm3)=100×(Wt/L3)
肝体比(HSI)=100%×(Wz/Wt)
脏体比(VSI)=100%×(Wv/Wt)
攻毒后累计存活率(%)=100×Xt/X0
式中,W0为平均初始体重(g),Wt为平均终末体重(g),t为实验时长(d),I为摄食量(g),B为饲料中Y2O3含量,B1为粪便中Y2O3含量,L为平均终末体长(cm),Wz为平均终末肝胰脏质量(g),Wv为平均终末内脏团质量(g),X0为开始攻毒时实验鱼的尾数,Xt为攻毒t时间后实验鱼的存活尾数。实验数据以平均值±标准误(mean±SE)表示, 采用SPSS 20.0软件进行统计分析。实验结果经一元方差分析(Oneway ANOVA)后, 用Duncan’s 进行多重比较, 当P<0.05时, 为差异显著。
2 结果
2.1 饲料中辅酶Q10水平对吉富罗非鱼幼鱼生长性能的影响
在整个实验过程中, 各实验组的吉富罗非鱼幼鱼均未表现出行为异常。由表3所示, 不同水平辅酶Q10对吉富罗非鱼幼鱼初始体重(IBW)、终末体重(FBW)、存活率(SR)、摄食率(FR)、特定生长率(SGR)、饲料效率(FE)、肥满度(CF)、肝体比(HSI)和脏体比(VSI)均无显著影响(P>0.05), 120 mg/kg辅酶Q10组终末体重、特定生长率和饲料效率在各组中均为最高。当辅酶Q10添加量为120 mg/kg时,吉富罗非鱼幼鱼的干物质消化率显著升高(P<0.05)。

表3 饲料辅酶Q10含量对吉富罗非鱼幼鱼生长、饲料利用及体指标的影响(平均值±标准误)*Tab.3 Effects of dietary CoQ10 on growth performance, feed utilization and physical indexes of juvenile GIFT tilapia (mean±SE)*
2.2 饲料中辅酶Q10对吉富罗非鱼幼鱼体成分的影响
如表4所示, 各实验组间吉富罗非鱼幼鱼去内脏全鱼的水分、干物质、粗蛋白和灰分含量无显著差异(P>0.05), 当辅酶Q10添加量为120 mg/kg时,去内脏全鱼的粗脂肪含量显著低于对照组(P<0.05)。各组间吉富罗非鱼幼鱼内脏团的水分、干物质、粗蛋白、粗脂肪和灰分含量均无显著差异(P>0.05)。
表4 饲料辅酶Q10含量对吉富罗非鱼幼鱼体成分含量的影响(平均值±标准误)Tab.4 Effect of dietary CoQ10 on body composition of juvenile GIFT tilapia (mean±SE)
2.3 饲料中辅酶Q10水平对吉富罗非鱼幼鱼抗氧化指标的影响
由表5所示, 40 mg/kg辅酶Q10组吉富罗非鱼幼鱼血清过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和谷胱甘肽S转移酶(GST)活性均显著高于对照组(P<0.05), 总超氧化物歧化酶(SOD)与对照组无显著差异(P>0.05)。80 mg/kg辅酶Q10组吉富罗非鱼幼鱼血清CAT和GSH-Px均显著高于对照组(P<0.05), SOD和GST均与对照组无显著差异(P>0.05)。与对照组相比, 120 mg/kg辅酶Q10组吉富罗非鱼幼鱼血清CAT、SOD和GSH-Px活性显著升高(P<0.05), GST活性无显著差异(P>0.05)。120 mg/kg辅酶Q10组吉富罗非鱼幼鱼血清中胆固醇(TC)和甘油三酯(TG)含量显著低于对照组, 其他各组TC和TG与对照组均无显著差异(P>0.05)。

表5 饲料辅酶Q10含量对吉富罗非鱼幼鱼血清抗氧化指标以及血清胆固醇(TC)和甘油三酯(TG)含量的影响(平均值±标准误)Tab.5 Effect of dietary CoQ10 on serum antioxidant indexes, total cholesterol (TC) and triglyceride (TG) of juvenile GIFT tilapia(mean±SE)
如表6所示, 40 mg/kg辅酶Q10组吉富罗非鱼幼鱼肝脏的过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性均显著高于对照组(P<0.05), 总超氧化物歧化酶(SOD)、谷胱甘肽S转移酶(GST)和丙二醛含量(MDA)均与对照组无显著性差异(P>0.05)。与对照组相比, 80和120 mg/kg辅酶Q10组吉富罗非鱼幼鱼肝脏CAT、SOD、GSH-Px、GST活性均显著升高(P<0.05), MDA含量均显著降低(P<0.05)。

表6 饲料辅酶Q10含量对吉富罗非鱼幼鱼肝脏抗氧化指标的影响(平均值±标准误)Tab.6 Effect of dietary CoQ10 on liver antioxidant indexes of juvenile GIFT tilapia (mean±SE)
2.4 饲料中辅酶Q10对吉富罗非鱼幼鱼肝脏和肠道组织学的影响
如图1所示, 对照组吉富罗非鱼幼鱼肝脏组织学切片显示出肝脏组织的正常组织学特征。可以观察到正常的肝实质, 肝细胞形成索状结构。且细胞间界限分明, 大多数肝细胞只有一个细胞核, 细胞核位于细胞中央, 近似圆形, 边缘清晰, 胞质丰富。各辅酶Q10组的肝脏结构均未出现异常, 肝细胞排列紧密, 大小和排列方式均与对照组相似。

图1 辅酶Q10含量对吉富罗非鱼幼鱼肝脏组织学的影响(HE,标尺为50 μm)Fig.1 Liver of juvenile GIFT tilapia fed with diets containing CoQ10 (HE, Bar=50 μm)
如图2所示, 各实验组吉富罗非鱼幼鱼肠道组织学切片显示出肠道组织的正常组织学特征。从内到外由黏膜层、黏膜下层、肌层和外膜四层结构构成。肠道组织完整, 肌层紧实, 黏膜层肠绒毛柱状上皮细胞完整且紧密排列, 表面可观察到纹状缘, 杯状细胞均匀分布。120 mg/kg辅酶Q10组肠道组织结构正常, 肠绒毛相较于对照组排列更加紧密。由表7所知, 120 mg/kg辅酶Q10组吉富罗非鱼肠道的绒毛长度、绒毛密度和肌层厚度均显著高于对照组(P<0.05)。

表7 饲料辅酶Q10含量对吉富罗非鱼幼鱼肠道结构的影响(平均值±标准误)Tab.7 Effects of dietary CoQ10 on intestinal structure of juvenile GIFT tilapia (mean±SE)
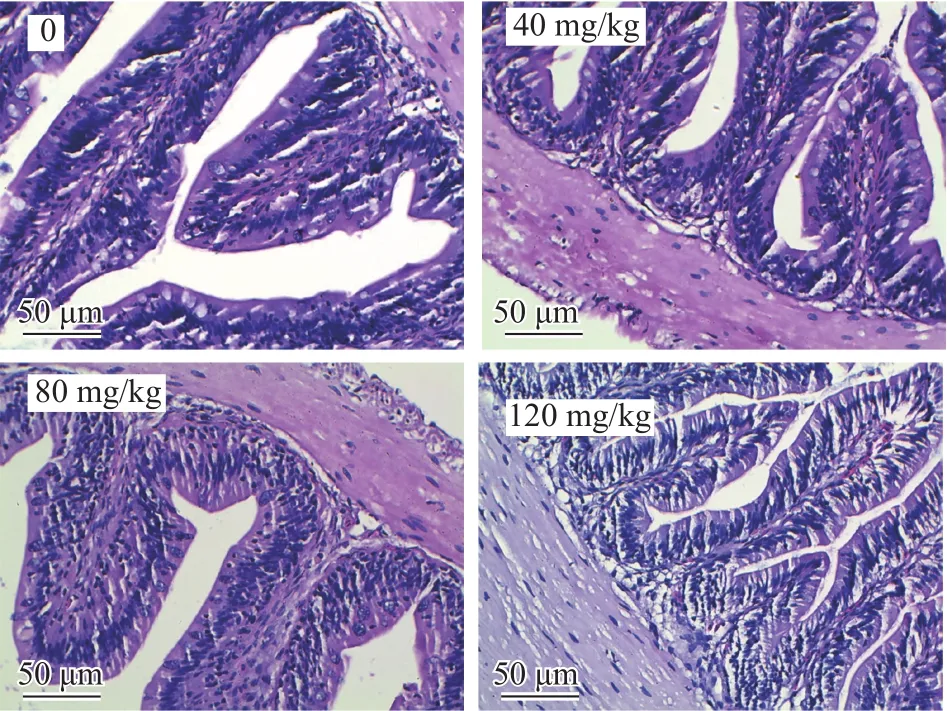
图2 辅酶Q10含量对吉富罗非鱼幼鱼肠道组织学的影响(HE,标尺为50 μm)Fig.2 Intestinal histology of juvenile GIFT tilapia fed with diets containing CoQ10 (HE, Bar=50 μm)
2.5 饲料中辅酶Q10水平对吉富罗非鱼幼鱼肝脏相关基因表达的影响
如图3所示, 120 mg/kg辅酶Q10组的sod、cat、gsh-px和gst基因表达量最高, 且显著高于其他各组(P<0.05)。80和120 mg/kg辅酶Q10组的免疫球蛋白M(igm)基因表达量显著高于对照组(P<0.05)。各辅酶Q10组的il-1β和il-8基因表达量均显著低于对照组(P<0.05)。

图3 辅酶Q10含量对吉富罗非鱼幼鱼肝脏相关基因表达的影响Fig.3 Effect of dietary CoQ10 on the expression of liver-related genes in juvenile GIFT tilapia
2.6 饲料中辅酶Q10水平对吉富罗非鱼幼鱼抗病力的影响
如图4所示, 每天记录一次所有组吉富罗非鱼幼鱼的累计存活率。注射嗜水气单胞菌8d后, 所有组存活率达到稳定状态。80和120 mg/kg辅酶Q10组的累计存活率分别为70.00%和80.00%, 均显著高于对照组和40 mg/kg辅酶Q10组(P<0.05), 其10d累计存活率均为46.67%。
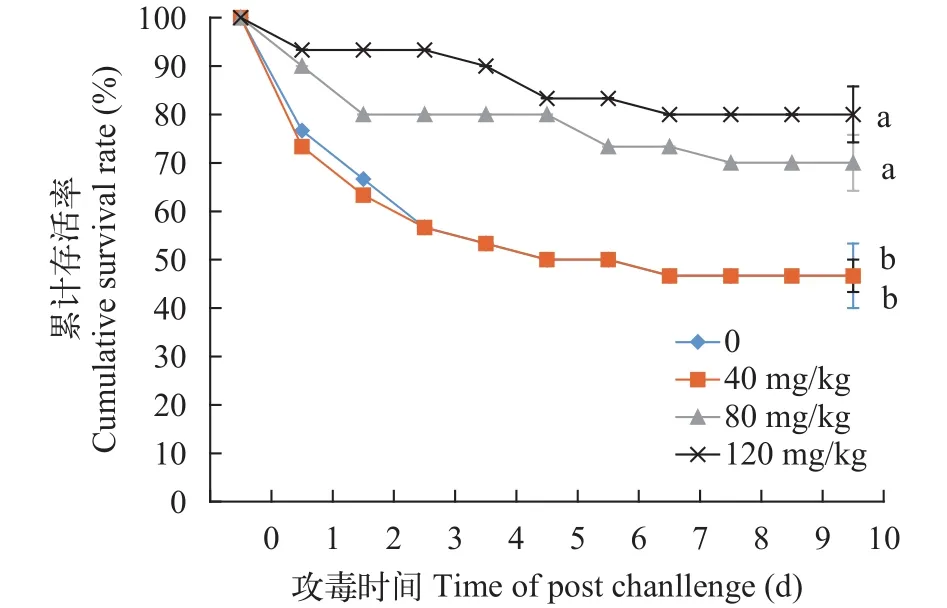
图4 辅酶Q10含量对嗜水气单胞菌攻毒后吉富罗非鱼幼鱼存活率的影响Fig.4 Effects of dietary CoQ10 on survival rate of juvenile GIFT tilapia challenged with Aeromonas hydrophila
3 讨论
3.1 饲料中辅酶Q10水平对吉富罗非鱼幼鱼生长性能的影响
日粮中补充辅酶Q10对肉鸡采食量、体重增加和饲料转化率均无显著的影响[34,35]。但也有研究发现, 饲料中补充辅酶Q10能提高动物的生长性能[36],例如显著增加了21日龄肉鸡的平均体重[37]。饲粮中补充辅酶Q10后, 鹌鹑的终末体重、累计采食量和饲料效率显著增加[24,38]。饲料中补充40 mg/kg辅酶Q10, 显著提高了非洲鲶(Clarias gariepinus)的终末体重和特定生长率[39]。生长性能提升的原因可能是辅酶Q10具有一定的抗炎特性, 能显著降低机体应激状态造成的损伤[40]。但在本实验中, 不同辅酶Q10水平对终末体重、特定生长率、摄食率和饲料效率均无显著影响, 但随着辅酶Q10含量的增加终末体重、特定生长率和饲料效率有上升的趋势,120 mg/kg辅酶Q10组终末体重、特定生长率和饲料效率均为最高, 比对照组分别提高了2.32%、3.03%和4.44%。研究结果不同可能是受物种、年龄、饲料组成和实验条件等因素的影响。肥满度能反映鱼类生长状况, 其大小与温度、饲料和繁殖等密切相关[41]。肝体比可反映实验期间肝脏功能的好坏,而脏体比可用来衡量动物摄入能量的分配情况[42]。饲喂辅酶Q10显著降低了非洲鲶的肝体比, 但对肥满度无显著影响[39]。在本实验中, 不同辅酶Q10水平对肥满度、肝体比和脏体比均无显著影响, 该结果与El Basuini等[43]的报道相似。
3.2 饲料中辅酶Q10水平对吉富罗非鱼幼鱼体成分的影响
腺苷酸活化蛋白激酶(AMPK)是重要的脂质代谢调节因子, 在AMPK磷酸化后会刺激分解代谢途径, 减少胆固醇、脂肪酸和甘油三酯的合成[44]。过氧化物酶体增值物激活受体(PPAR)是脂质代谢中的转录因子, 在脂代谢和脂肪酸氧化中起重要作用[45]。辅酶Q10能通过介导AMPK途径诱导PPAR的表达,从而减少脂肪的合成[44]。研究表明, 肉鸡肝脏中PPAR-α基因的表达随辅酶Q10补充水平的升高而线性增加, 脂肪酸氧化增多, 肉鸡腹部脂肪和血脂降低[46]。羟甲基戊二酰辅酶A还原酶(HMGR)是胆固醇合成的限速酶, 辅酶Q10能显著降低HMGR活性从而抑制胆固醇的生成[47]。日粮中补充20 mg/kg辅酶Q10, 肉鸡肝脏中HMGR活性显著降低, 血清中胆固醇显著降低[35]。小鼠在摄食辅酶Q10后, 脂肪组织中的脂质氧化增多, 脂质清除率提高, 降低了脂肪组织的重量[20]。血清TC和TG含量可反映机体脂质代谢情况, TC和TG含量过高可引起动物肝功能损伤[48]。日粮补充辅酶Q10, 肉鸡血液中TC和TG含量显著降低[49]。饲料中添加辅酶Q10, 水牛(Bubalus bubalis)犊牛的血清总脂质和TG均显著降低[50]。家兔摄食含辅酶Q10的饲粮, 血清TC和TG均显著降低[51]。在本实验中, 当辅酶Q10添加量为120 mg/kg时, 显著降低了吉富罗非鱼幼鱼血清TC、TG及去内脏全鱼的粗脂肪含量, 但对水分、粗蛋白和灰分均无显著影响。
3.3 饲料中辅酶Q10水平对吉富罗非鱼幼鱼抗氧化指标的影响
动物体抗氧化系统由一系列抗氧化酶组成。机体长期处于不良条件下会产生大量氧自由基, 自由基发生脂质过氧化反应转化为MDA。CAT能协同SOD将体内多余活性氧自由基转化为水, GST也可以与GSH-Px互作清除自由基[43]。辅酶Q10在机体以其还原态形式发挥抗氧化作用。还原型辅酶Q10的异戊二烯侧链能够渗入饱和脂肪酸的膜脂类双层, 保护细胞膜的磷脂和低密度脂蛋白, 减少自由基对脂质、蛋白质的损伤并清除体内多种氧化诱导剂诱导产生的自由基[52,53]。辅酶Q10能显著提高SOD和GSH-Px的活性, 有效降低人体血清MDA的含量, 说明辅酶Q10对人体具有抗氧化作用[54]。水牛犊牛在断奶期间补充辅酶Q10后, 血清中SOD和CAT酶活性显著升高[50]。饲料中添加20 mg/kg的辅酶Q10能显著增加育肥猪背长肌SOD酶活性,MDA含量显著降低[18]。饲喂40 mg/kg辅酶Q10能显著改善冷应激下鹌鹑的抗氧化状态(TAS), 显著增加SOD活性和降低MDA含量[38]。辅酶Q10能减轻肉鸡氧化应激损伤, 肝脏线粒体内T-SOD活性升高以及MDA含量显著降低[55]。鱼类的血液指标是反映鱼体健康状况的重要参数, 血液中抗氧化酶活性反映了清除机体自由基和活性氧的能力[56]。非洲鲶在摄食辅酶Q10后, 血清SOD、CAT、GSHPx酶活性显著升高, 血清MDA含量显著降低[39]。在本实验中, 随着饲料中辅酶Q10添加量增加, 各辅酶Q10组吉富罗非鱼幼鱼血清和肝脏CAT和GSHPx活性均显著升高。当添加量为80或120 mg/kg时,吉富罗非鱼幼鱼SOD和GST活性均显著高于对照组, 且MDA含量显著下降。说明添加辅酶Q10可显著提高吉富罗非鱼幼鱼的抗氧化能力。
3.4 饲料中辅酶Q10水平对吉富罗非鱼幼鱼肝脏和肠道组织学的影响
肝脏是鱼类最重要的代谢器官, 具有消化、解毒和代谢等多种功能。肝脏的结构状态可以直接反映鱼类肝脏的健康状况[57]。泛醇是辅酶Q10的双电子还原产物, 在线粒体中起抗氧化剂的作用。大鼠和狗服用200 mg/kg及以上泛醇, 肝细胞有细小空泡形成,但研究认为该变化是对辅酶Q10吸收的适应性反应, 不会引起细胞毒性变化[58]。大鼠口服2000 mg/kg辅酶Q10 28d后, 肝脏重量和组织学结构与对照组无显著差异变化[8]。小鼠每日口服0.56、1.13和2.25 g/kg的辅酶Q10, 肝脏谷草转氨酶(AST)和谷丙转氨酶(ALT)活性不受辅酶Q10添加水平的影响, 辅酶Q10不会造成肝损伤[7]。非洲鲶摄食含40 mg/kg辅酶Q10的日粮后, 肝组织切片均显示出正常的肝脏结构, 并且肝脏的AST、ALT和碱性磷酸酶(ALP)活性显著降低[39]。本研究结果显示, 各辅酶Q10组吉富罗非鱼幼鱼肝组织结构与对照组对比无显著变化, 细胞间界限分明, 排列紧密。结合肝脏抗氧化酶活性升高和丙二醛(MDA)含量的减少, 说明辅酶Q10可减少肝脏的氧化损伤, 有助于肝脏组织的健康。
肠道是鱼类消化与吸收营养的主要器官, 由浆膜层、肌层、黏膜下层和黏膜层组成[59]。肠绒毛是营养物质消化吸收的主要部位, 其形态结构直接反映鱼类消化吸收能力。饲料添加剂的使用能够促进鱼类肠道发育和维持肠道健康。在本实验中,饲料中添加120 mg/kg辅酶Q10显著增加吉富罗非鱼幼鱼肠道绒毛长度和绒毛密度。肠绒毛表面积的增加, 更有利于营养物质的吸收。饲料中补充其他添加剂也有类似效果, 例如在欧洲海鲈(Dicentrarchus labrax)饲料中添加0.2%微囊丁酸钠后, 显著提高了绒毛长度和绒毛密度, 有利于肠道形态结构的完整和稳固[60]。饲料中添加肉桂醛能显著提高鳗鲡(Anguilla japonica)肠道的绒毛数量和长度, 从结构上改善了肠道的消化与吸收功能[61]。饲料中添加丁酸钠显著提高了黄颡鱼(Pelteobagrus fulvidraco)前肠和后肠的绒毛长度, 促进了肠道发育和维持肠道健康[62]。肠道的蠕动依靠肠道肌肉的收缩作用,而肌层的厚度能一定程度促进肠道蠕动, 有利于肠道内物质运输[63]。本实验结果显示, 120 mg/kg辅酶Q10组吉富罗非鱼幼鱼肠道肌层厚度显著增加,可能提高了其对营养物质的消化吸收效率。类似的研究显示, 1500 mg/kg的枸杞多糖能有效提高尼罗罗非鱼前肠的肌层厚度, 促进食物在下游消化道的消化吸收[64]。结合本研究干物质消化率的升高,说明辅酶Q10对吉富罗非鱼幼鱼肠道消化和吸收能力可能有一定程度的改善, 且添加量为120 mg/kg时具有明显的效果。
3.5 饲料中辅酶Q10水平对吉富罗非鱼幼鱼肝脏相关基因表达的影响
40 mg/kg辅酶Q10显著增加了大鼠线粒体锰超氧化物歧化酶(MnSOD)基因的表达, 且肝脏SOD、CAT和GSH-Px酶活性显著升高[65]。饲料中添加40 mg/kg辅酶Q10, 使肉鸡肝脏CAT基因被高度表达[15]。白细胞介素(Interleukin,il)是一种促炎细胞因子, 在介导T淋巴细胞和B细胞的活化、增殖和分化过程中有重要作用[66]。辅酶Q10能抑制il-1、il-6等多种促炎细胞因子的表达[67,68]。NF-κB通路可以被活性氧激活, 而辅酶Q10可以通过抑制NF-κB从而下调促炎细胞因子的表达[69,70]。大鼠涂抹辅酶Q10药膏后, 与炎症有关的HO-1、il-1β、tnf-α和NF-κB的基因表达显著下调[71]。用辅酶Q10治疗氧化损伤的大鼠, 大鼠肝脏中促炎细胞因子il-6下降至正常水平[72]。免疫球蛋白M(igm)在特异性免疫中起着识别和清除潜在病原体的重要作用, 其含量水平可反映鱼类免疫功能强弱[73]。在本实验中, 120 mg/kg辅酶Q10上调了sod、cat、gsh-px、gst和igm基因的表达, 而不同水平辅酶Q10组均下调了il-8和il-1β基因的表达。这说明当添加量为120 mg/kg时, 机体抗氧化防御系统明显增强。辅酶Q10还能作用于机体免疫系统, 减少炎症因子的表达量, 提高机体的免疫力[12]。
3.6 饲料中辅酶Q10水平对吉富罗非鱼幼鱼抗病力的影响
辅酶Q10的添加可刺激体内抗体水平的提高,增加巨噬细胞和T淋巴细胞的数量和功能, 从而提高机体免疫水平[14]。辅酶Q10减轻了氟化物污染引起的贫血和组织学变化, 提高了非洲鲶对温和气单胞菌(Aeromonas sobria)的抗病力[39]。奶蓟草和辅酶 Q10的联用可调节氧化应激反应和脑镍含量来减轻氯化镍引起的尼罗罗非鱼神经行为障碍[74]。辅酶Q10减少了大鼠神经缺陷和组织损伤, 增强了抗病力[75]。嗜水气单胞菌我国流行最为广泛的一种典型人-畜-水生动物共患的病原菌, 广泛分布于淡水、海洋和河口等水生环境[76]。鱼类感染嗜水气单胞菌后易出现出血病, 主要表现为头部、腹部等部位充血, 漂浮于水面等现象, 致死率极高[77]。在本实验中, 80和120 mg/kg辅酶Q10组吉富罗非鱼幼鱼嗜水气单胞菌侵染后的累计存活率显著高于对照组。辅酶Q10充分发挥了免疫防御作用, 可能与其提升了机体抗氧化酶活性和抗氧化相关基因的表达有关, 进而提高了鱼体抗病力。
4 结论
饲料中添加辅酶Q10≤120 mg/kg对吉富罗非鱼幼鱼存活、生长、饲料利用及组织结构均无不良影响。饲喂120 mg/kg辅酶Q10能显著提高吉富罗非鱼幼鱼的消化率、抗氧化能力、肝脏抗氧化相关基因的表达和对嗜水气单胞菌的抗病力, 降低血脂和去内脏全鱼的脂肪含量。
