直肠LARS危险因素分析及风险预测模型构建
2023-01-30张登云高玉熙张凯刘波向姿张坚
张登云,高玉熙,张凯,刘波,向姿,张坚
(青岛大学附属医院平度院区胃肠外科,山东 青岛 266700)
直肠癌是常见的胃肠道肿瘤,对于大多数直肠癌病人手术仍然是重要的治疗方式。随着外科手术方式及医疗器材的不断变革,很大一部分低位直肠恶性肿瘤病人在切除原发肿瘤的同时也保留住肛门,从而减少了病人永久性肠造瘘的可能。但是低位前切除术,尤其是超低位前切除术和经括约肌切除术后,许多病人会发生一定程度的肛门排便功能方面的问题,如大便频繁、排便急迫感、大便失禁、排便困难等一系列症状,即所谓的低位前切除综合征(LARS),降低了直肠癌术后病人的生活质量,给病人及家属的生活带来诸多不便[1-2]。目前LARS的治疗方法很多,其中早期干预治疗在整体治疗中起着关键作用,但LARS的早期诊断相对滞后,导致早期干预治疗效果不尽人意,因此LARS的早期诊断在其治疗中显得尤为重要。本研究收集了单中心行保肛手术病人的临床资料,分析LARS的发生率及导致 LARS的潜在危险因素,并构建列线图风险预测模型,用于早期准确识别高风险人群并制定LARS的预防与治疗方案。
1 资料与方法
1.1 一般资料
回顾性分析2019年9月—2020年9月青岛大学附属医院收治的242例行直肠前切除术直肠癌病人临床资料。纳入标准:①术前或术后病理确诊为直肠癌;②完成直肠前切除术;③病人年龄为18~85岁;④病历资料完整。排除标准:①造口未还纳;②既往盆底、直肠、肛门手术史;③术前存在排便功能障碍(如腹泻、肠易激综合征、功能性便秘等);④手术方式为Hartmann或Miles;⑤合并其他盆腔或肛门疾病(如直肠脱垂等)。
1.2 资料收集
收集病人资料,包括性别、年龄、临床特征(有无高血压史、糖尿病史,是否行新辅助治疗,手术时长,手术方式,是否行临时性造口,吻合口位置,是否发生吻合口瘘,术后恢复时间,体质量指数(BMI),术后病理结果(包括肿瘤TNM分期),病灶大小,肿瘤位置(肿瘤下缘距肛缘的距离)等)。按照美国癌症联合委员会(AJCC)公布的第8版直肠癌TNM分期标准进行分期。肿瘤位置分为低位(≤5 cm)、中高位(>5 cm)。术后恢复时间为病人恢复正常排气排便至随访时的时间。
1.3 排便功能评价及LARS诊断标准
应用LARS量化评分表评价直肠癌术后病人的排便功能,依据病人是否有排气、大便失禁、里急后重感及排便频率、是否排便急迫进行评分,根据得分将病人分为无LARS(0~20分)、轻度LARS(21~29分)、重度LARS(30~42分),评分越高说明LARS病情越重[3-6]。
1.4 统计学分析
采用SPSS 28.0软件进行统计学分析。以性别、术后病理学检查结果(包括TNM分期)及临床特征(包括有无高血压史、糖尿病史,是否行新辅助治疗、手术方式,是否行临时性造口,是否发生吻合口瘘)作为分类变量,年龄、肿瘤病灶大小、肿瘤位置、手术时间、术后恢复时间、BMI作为数值变量,将数值变量按研究要求转变为分类变量。分类变量比较采用χ2检验,对差异有统计学意义的变量进行多因素Logistic回归分析。以P<0.05为差异有统计学意义。
1.5 Nomogram模型构建及评价方法
首先使用R语言4.0.2版本软件的随机抽样函数将病人按7∶3的比例随机划分为训练队列和验证队列,其中训练队列170例,验证队列72例。将上述筛选出的有统计学意义变量利用训练队列数据构建Nomogram模型,将Logistic回归线性模型系数转换成0~100分,通过各变量相对应得分的总和得出相应的预测概率。Nomogram模型评价方法:基于训练、验证组数据计算或绘制列线图在训练组和验证组中的校准曲线、C-index、ROC曲线、AUC值、DCA曲线。校准曲线中,校准曲线与参考线越相近,表明预测值与实际观测值越接近。通过C-index和AUC值来评价Nomogram模型的预测精确度,其中C-index区间为0.5~1.0,C-index值越接近1表明Nomogram模型的预测精确度越高。同时进行Hosmer-Lemeshow拟合优度检验,P>0.05表明模型的预测值与实际值无偏差,P值越大表明预测模型的一致性越好。应用DCA曲线评价列线图的临床应用价值,正向净收益越大,说明该模型预测训练集、验证集直肠恶性肿瘤病人LARS发生有良好临床实用性。
2 结 果
2.1 临床特征分析
入组病人出现临床症状包括便频、排便急迫感、大便失禁136例,无以上症状者106例。LARS评分量表评估显示有76例病人(31.4%)发生LARS,166例病人(68.6%)术后未发生LARS。单因素方差分析显示,直肠保肛术后LARS的发生与病人BMI、新辅助治疗、吻合口瘘、恢复时间、肿瘤位置有关(χ2=5.348~41.482,P<0.05)。见表1。
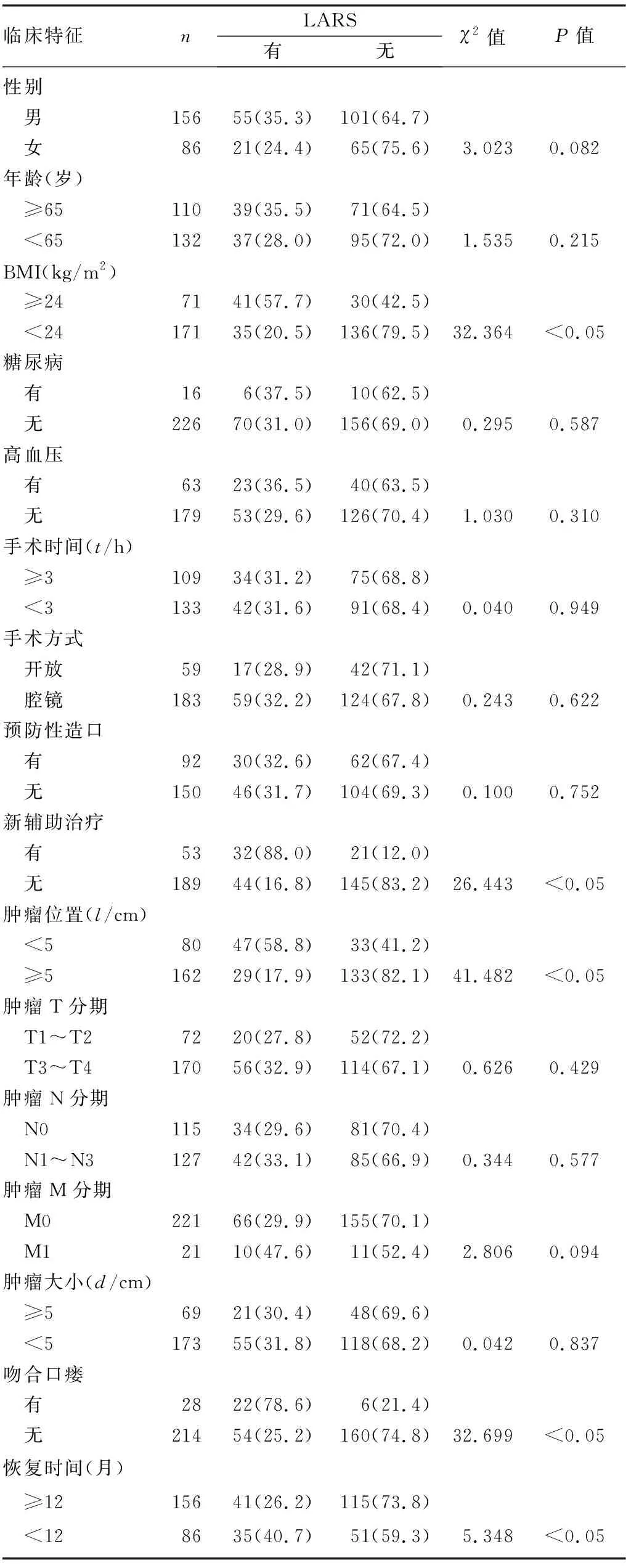
表1 病人临床特征分析(例(χ/%))
2.2 LARS发生预测变量的筛选
将BMI、新辅助治疗、吻合口瘘、恢复时间、肿瘤位置纳入多因素Logistic回归分析,结果显示,BMI≥24 kg/m2(OR=3.616,95%CI=1.757~7.442,P<0.05)、肿瘤距肛缘距离≤5 cm(OR=5.305,95%CI=2.568~10.956,P<0.05)、新辅助治疗(OR=5.082,95%CI=2.267~11.393,P<0.05)和吻合口瘘(OR=14.265,95%CI=4.706~43.244,P<0.05)是直肠恶性肿瘤保肛根治术后LARS发生的独立危险因素。见表2。
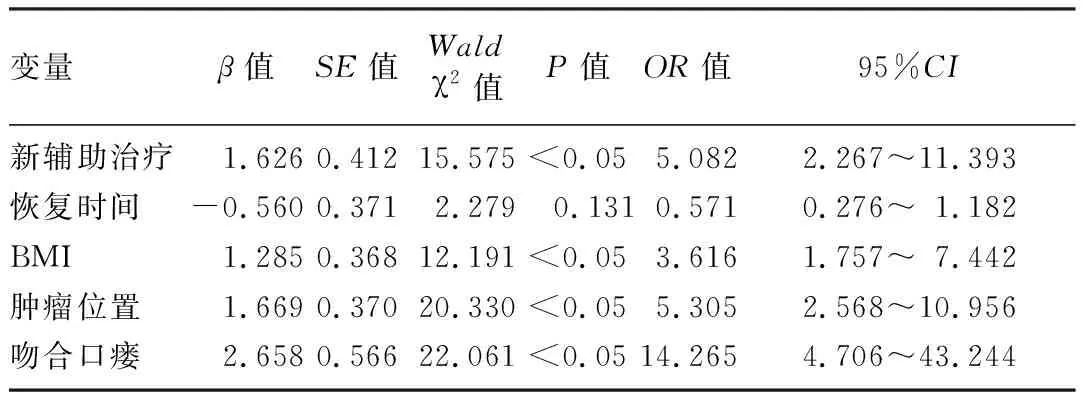
表2 直肠癌保肛根治术后发生LARS的多因素Logistic回归分析
2.3 Nomogram模型的构建及评价
训练队列和验证队列基线数据差异无显著性。见表3。根据多因素Logistic回归分析结果,以训练队列中的4项变量BMI≥24 kg/m2、肿瘤距肛缘距离≤5 cm、新辅助治疗和吻合口瘘为基础,构建预测直肠癌保肛根治术后LARS发生风险的Nomogram模型。结果显示,训练集Nomogram预测的C-index为0.834(95%CI=0.684~0.953),AUC值为0.868(95%CI=0.737~0.936);验证集评价C-index为0.893(95%CI=0.697~0.964),AUC值为0.819(95%CI=0.767~0.945)。绘制校准曲线示训练集和验证集的校准曲线与理想曲线校准良好,且经Hosmer-Lemeshow拟合优度检验,预测模型与实际观察值之间无差异(χ2=2.179,P>0.05),表明本研究建立的列线图模型拟合优度良好,本研究模型预测的直肠保肛术后LARS发生率与实际发生率相符。应用DCA曲线评价列线图的临床应用价值,结果显示,在训练集与验证集病人的广泛患病风险范围内,列线图均显示了很大的正向净收益,说明该模型在预测训练集、验证集病人LARS患病情况方面均拥有良好临床实用性。见图1~4。
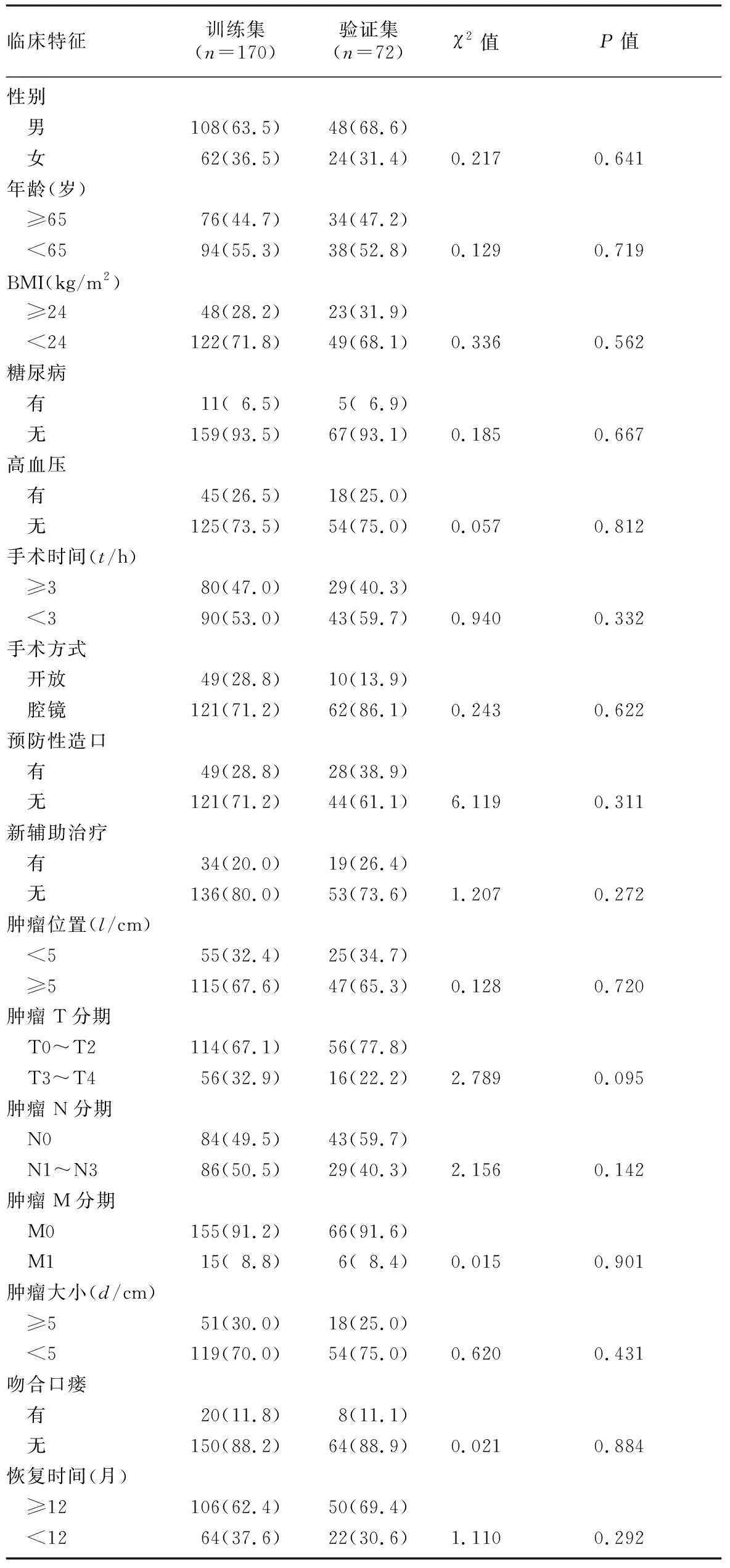
表3 训练集与验证集病人基线资料比较(例(χ/%))

图1 预测直肠癌保肛根治术后LARS发生风险的Nomogram模型
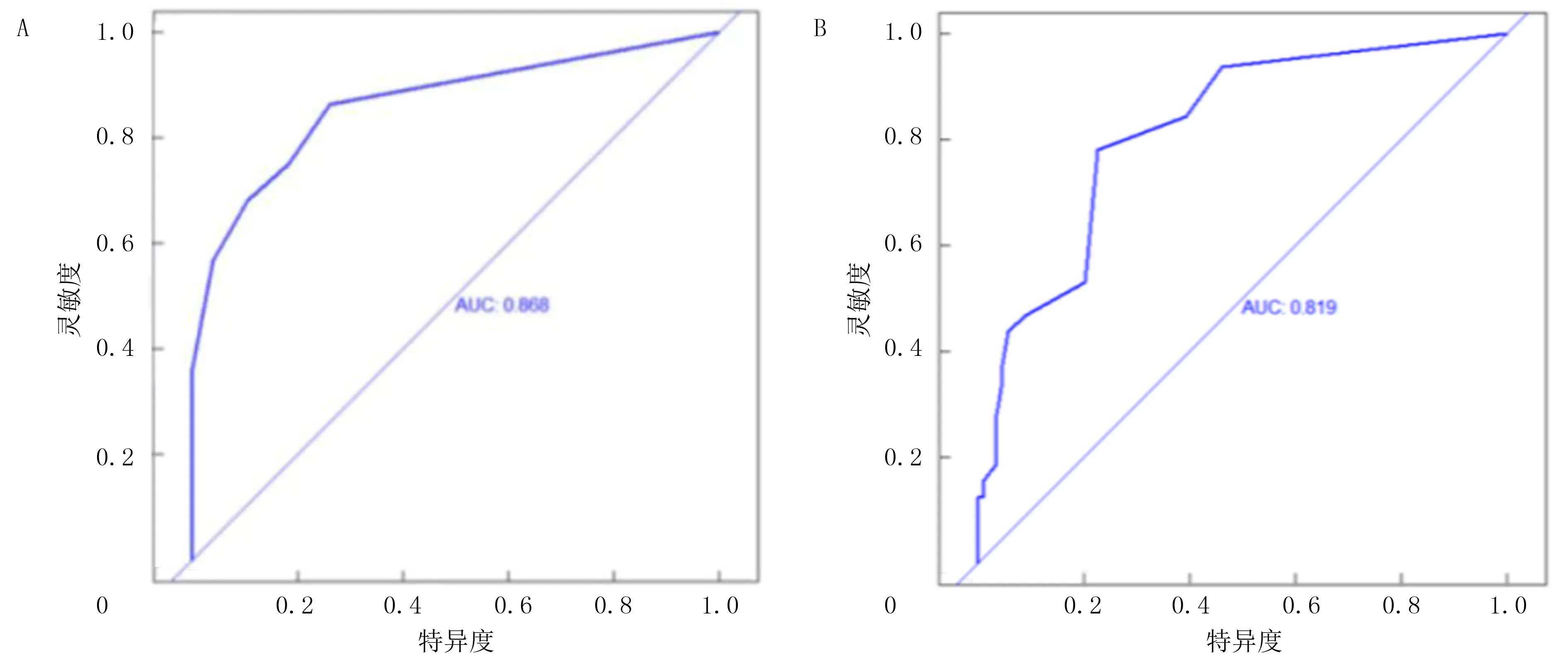
A:训练集;B:验证集。图2 Nomogram模型训练集及验证集的ROC曲线
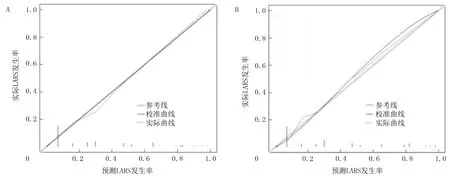
A:训练集;B:验证集。图3 Nomogram模型训练集及验证集的校准曲线
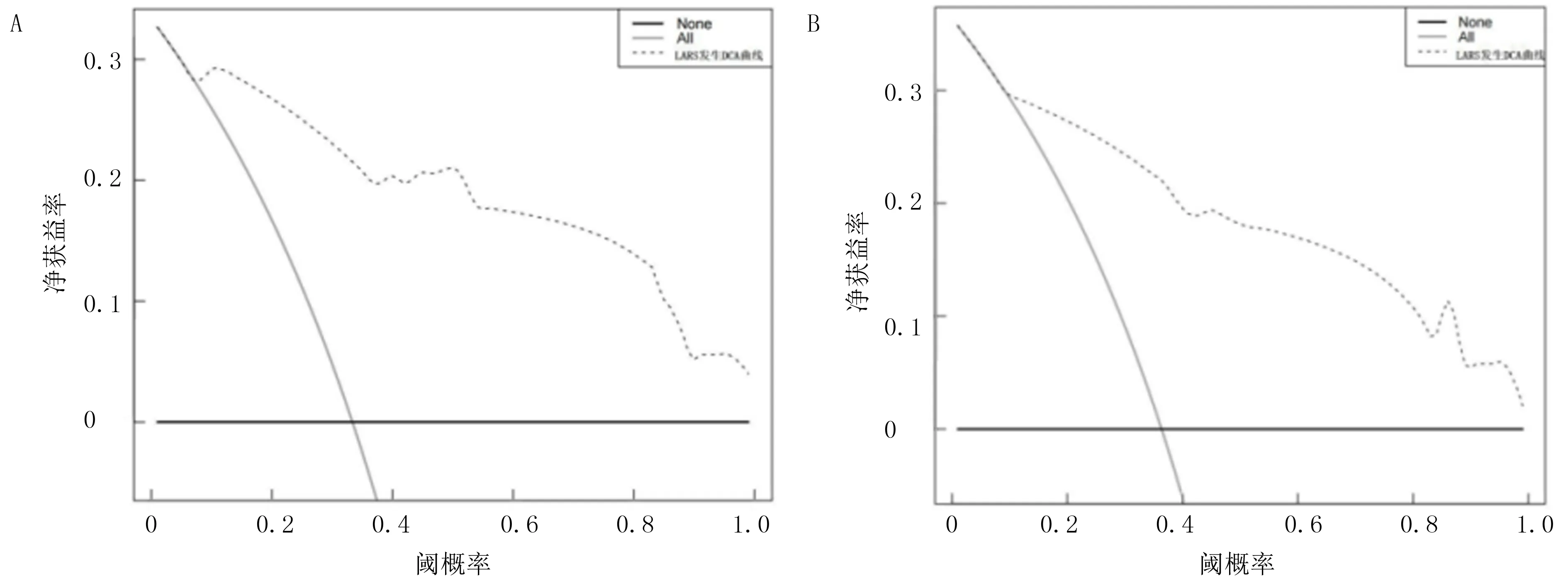
A:训练集;B:验证集。图4 Nomogram模型训练集及验证集的DCA曲线
3 讨 论
LARS可出现在直肠癌保肛手术后,严重损害了病人的生活质量,其严重程度与病人术后的生活质量显著相关。LARS的发展可能涉及多方面问题的相互作用。本研究构建的列线图纳入的危险因素包括肿瘤位置、术后吻合口瘘、BMI、新辅助治疗,显示出良好的预测能力。
本研究中LARS的发生率为31.4%。有研究表明,25%~80%肠道吻合病人术后出现了一系列肠道排便功能障碍的表现,如便频、大便失禁等,即前切除综合征[7-8]。目前LARS的病因尚不明确,有研究指出其发病机制可能与肛门内和外括约肌功能紊乱、肛管抑制反射减弱、直肠储量和顺应性降低等有关[9-13]。
本研究发现肿瘤位置是LARS发生的重要因素。国外学者关于LARS发生的危险因素分析表明,肿瘤位置较低及吻合口位置较低对保肛术后病人的肠道功能恢复有明显的负面影响,残留直肠≤4 cm的病人发生LARS的风险为残留直肠>4 cm病人的4.6倍[8]。有研究表明,“新直肠”易受到粪便的影响而增加收缩或痉挛的次数,从而引起便频、便急、便不尽感等排便功能障碍症状[14]。可见经过肠切除及肠吻合后,病人本身直肠结构发生改变,“新直肠”的容量及顺应性较前下降,导致新建直肠的储备容量显著下降,这也可能是病人出现LARS的基础。
本研究显示,BMI是另一个LARS发生的危险因素,病人体质量越大,LARS发生的可能性越高。肥胖病人往往解剖间隙及解剖标志较模糊,术中进行游离时会增加盆腔、肛周神经及肛门括约肌损伤的可能性,使LARS发生的风险提高。
本研究显示,术前新辅助治疗是LARS发生的高危因素。有研究表明,术前进行新辅助放化疗是病人术后排便功能障碍发生的重要影响因素[15-17],本研究结果与其一致。术前新辅助治疗可能导致排便相关神经损伤,同时损伤肛门直肠括约肌,影响正常的排便功能[18]。有研究表明,新辅助治疗后肠管水肿较重,在一定程度上增加了吻合口瘘的发病风险[19]。术后吻合口瘘可引起吻合口周围炎症反应,导致盆腔及肛周局部脓肿,在一定程度上使肠管纤维增生,引起肠壁的顺应性降低,导致肠管容量减少、肠腔狭窄,引起病人排便障碍等。
综上所述,本研究通过分析导致LARS的潜在危险因素,构建了Nomogram模型预测直肠癌病人术后LARS的发生,对早期准确识别高风险人群并制定LARS的预防与治疗方案具有指导意义。但本研究存在以下问题:①本研究为单中心研究,样本量较少,所得结论仍需更多样本量进行验证;②本研究为回顾性分析,随访调查时间较短,对病人术后短期及长期的动态、持续观察及研究相对不足;③一些临床指标的缺失导致纳入影响因素较少,如新辅助治疗的不同治疗方案和时间、病人进食时间及术后进食情况等是否会影响LARS发生尚不清楚。
