89株蜡样芽孢杆菌食品分离株携带毒力基因情况及PFGE分型研究*
2023-01-29卢晓芸施怡茹吴丽珠高红梅张红芝徐秋芳
卢晓芸,施怡茹,吴丽珠,高红梅,郁 晞,庄 源,张红芝,徐秋芳△
1.上海市青浦区疾病预防控制中心,上海 201799;2.上海市疾病预防控制中心,上海 200336
蜡样芽孢杆菌为兼性厌氧的革兰阳性芽孢杆菌,是重要的食源性条件致病菌[1-3],能引起腹泻、呕吐、眼部疾病、败血症等疾病,甚至导致患者死亡[4-5]。其常污染米面制品、肉制品、蔬菜等,尤其是富含蛋白质、碳水化合物的食物。国家食源性疾病监测数据显示,该菌引起的相关食源性疾病仍存在未被报告或被误诊的情况(蜡样芽孢杆菌呕吐型和腹泻型的症状类似于金黄色葡萄球菌或产气荚膜梭菌引起的食物中毒)[6],导致其相关食源性疾病事件统计数低于实际事件数。毒力基因和脉冲场凝胶电泳(PFGE)技术能在食源性疾病暴发调查中对致病菌进行分子分型和毒力基因鉴定。
本研究建立上海市青浦区蜡样芽孢杆菌毒力基因检测方法和PFGE分型检测方法,并对2016-2020年729份样品进行检测,了解青浦区蜡样芽孢杆菌毒力基因和PFGE分型,结合污染情况对蜡样芽孢杆菌引起的食物中毒风险进行评估,减少因蜡样芽孢杆菌引起的食品安全问题。
1 材料与方法
1.1菌株和样品来源 对2016-2020年729份样品(包含熟制米面制品208份、学生午餐260份、熟肉制品84份、酱料78份、蔬菜99份)进行蜡样芽孢杆菌检测,分离得到89株蜡样芽孢杆菌。样品采样分别涉及餐饮服务环节(70份)、学生餐配送公司环节(260份)、流通环节(399份)3个环节。本研究使用蜡样芽孢杆菌标准菌株CICC23828作为阳性对照菌株和PFGE实验条件优化的质控菌株。
1.2仪器与试剂 主要仪器包括PCR扩增仪(ABI,美国),以及普通电泳仪、PFGE仪、凝胶成像系统等(Bio-Rad,美国)。主要试剂包括甘露醇卵黄多黏菌素(MYP)琼脂、血平板等(上海科玛嘉生物科技有限公司,中国)。PCR反应体系2×Taq PCR Master mix(BBI,美国)、PCR引物及DNA相对分子质量标准(50~1 200 kb,上海生工生物,中国)。限制性内切酶XbaⅠ和NotⅠ、蛋白酶K(Takara,日本)、Seakem Gold琼脂糖(Lonza,瑞士)。
1.3方法
1.3.1检定 按照国家食品安全标准(GB4789.14-2014现行有效标准),使用MYP琼脂分离样品中的可疑菌落,使用血平板划线分离单个纯菌落,进行常规生化试验和确证试验,同时使用全自动微生物生化系统进行鉴定。对菌株进行生化分型试验[过氧化氢酶试验、动力试验、硝酸盐还原试验、酪蛋白分解试验、溶菌酶耐性试验、V-P试验、葡萄糖利用(厌氧)试验、根状生长试验、溶血试验、蛋白质毒素结晶试验]。
1.3.2毒力基因检测 普通PCR电泳法检测蜡样芽孢杆菌腹泻毒素毒力基因片段、呕吐毒素毒力基因片段(溶血性基因hblA、hblC、hblD,非溶血性基因nheA、nheB、nheC,肠毒素基因entFM、bceT,细胞毒素基因cytK,呕吐毒素基因ces)[3]。PCR条件:预变性94 ℃ 4 min,变性94 ℃ 30 s,退火54 ℃ 30 s,延伸72 ℃ 1 min,40个循环;最后延伸72 ℃ 10 min[7]。PCR扩增产物电泳:产物5 μL,120 V电泳30 min。同时设蜡样芽孢杆菌标准菌株CICC23828作为阳性对照菌株。所用引物序列及PCR产物大小[1,8-9]见表1。

表1 蜡样芽孢杆菌毒力基因引物序列和产物大小
1.3.3PFGE分型试验 参考黄铭珊[1]及张慧娟等[10]的研究,PFGE方案如下:(1)小胶块。取新鲜菌落用TE制备5.0麦氏浊度的菌悬液。取400 μL菌悬液加入8 μL溶菌酶(100 μg/μL,下文水平相同),37 ℃水浴20 min。加入20 μL蛋白酶K(20 μg/μL)和400 μL 1% Seakem Gold琼脂糖(TE和SeaKem Gold agarose制备,54 ℃水浴30 min以上)轻柔混匀后,加入模具,4 ℃凝固5 min。(2)裂解细胞。使用TE和溶菌酶处理小胶块(每管5 mL TE和25 μL 溶菌酶,37 ℃水浴,170 r/min振荡摇晃4~6 h)。(3)消化蛋白。取出充分裂解的小胶块,使用细胞裂解液CLB和蛋白酶K处理小胶块(每管5 mL CLB和25 μL蛋白酶K,54 ℃水浴,170 r/min振荡摇晃18 h)。(4)洗胶块。使用纯水和TE分别54 ℃水浴后170 r/min振荡摇晃洗涤15 min(先纯水洗2次,后TE洗4次)。(5)酶切。选择NotⅠ酶切实验菌株小胶条,20 U NotⅠ在37 ℃酶切4 h。沙门菌H9812小胶块用50 U XbaⅠ在37 ℃酶切2 h。(6)电泳。0.5×TBE电泳液2 000 mL,初始转换时间5 s,最终转换时间80 s,电压为6.0 V/cm,脉冲夹角为120°,电泳时间为18 h。(7)图像获取。电泳完成后将凝胶用GelRed溶液染色30 min,纯水脱色20 min,使用Bio-Rad成像系统成像。图谱使用BioNumerics5.10软件处理。聚类图结果根据非加权配对算术平均法(UPGMA)构建,条带的位置差异容许度设置为1.0%,电泳条带相似性系数以Dice系数表示。
2 结 果
2.1蜡样芽孢杆菌的来源分析 89株蜡样芽孢杆菌检出情况:熟制米面制品中检出35株,学生午餐中检出29株,熟肉制品中检出13株,酱料中检出5株,蔬菜中检出7株,检出率分别为16.83%(35/208)、11.15%(29/260)、15.48%(13/84)、6.41%(5/78)、7.07%(7/99)。各类型食品检出率差异有统计学意义(χ2=10.13,P=0.038)。样品采样涉及餐饮服务环节、学生餐配送公司环节、流通环节,各环节检出率分别为35.71%(25/70)、11.15%(29/260)、8.77%(35/399),差异有统计学意义(χ2=40.75,P<0.01)。
2.2蜡样芽孢杆菌的鉴定结果 89株菌株确证试验均符合蜡样芽孢杆菌生化特征,定量结果均小于105CFU/g,后续进行生化分型试验(以2型为主),结果见表2。确证试验和生化分型试验全部完成所需时长为6 d。
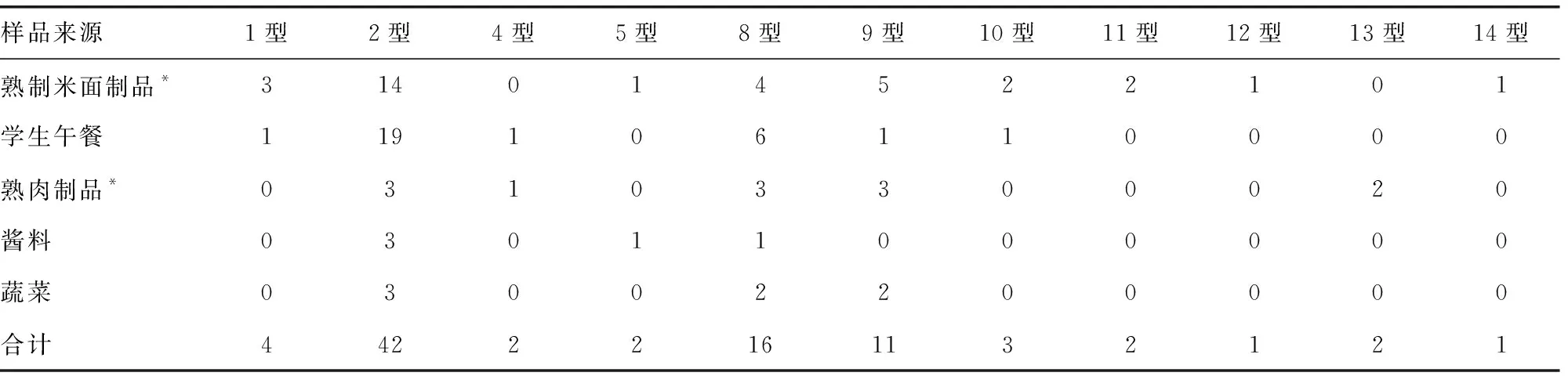
表2 89株蜡样芽孢杆菌的生化分型结果(n)
2.3蜡样芽孢杆菌的毒力基因检测结果 89株蜡样芽孢杆菌中,hblA、hblC、hblD基因都携带的蜡样芽孢杆菌有38株(42.70%),均不携带27株(30.34%),剩余24株菌株(26.96%)均携带hblA、hblC、hblD中的1~2种,携带hblC基因的菌株最多(60.67%)。nheA、nheB、nheC基因都携带的菌株有50株(56.18%),39株均携带nheA、nheB、nheC基因中至少一种(43.82%),携带nheB基因的菌株最多(88.76%)。entFM、bceT、cytK、ces这4种基因携带情况分别为71.91%、38.20%、41.57%、15.73%。各类型毒力基因(hblA、hblC、hblD、nheA、nheB、nheC、entFM、bceT、cytK、ces)携带情况不同。有9株菌株为腹泻强毒株(仅不携带ces基因),15株同时携带肠毒素基因entFM、bceT和细胞毒素基因cytK,有14株携带呕吐毒素基因ces,该38株菌株均来自熟制米面制品、学生午餐、熟肉制品。
2.4蜡样芽孢杆菌的PFGE分型结果 对89株蜡样芽孢杆菌进行PFGE和聚类分析,可分为85个带型,见图1。NotⅠ酶切可得5~12条DNA片段。编号为QPBC16005和QPBC16006的菌株、QPBC17028和QPBC17029的菌株,图谱相似度为100%,QPBC18002、QPBC18003和QPBC18004 3株菌株图谱相似度为100%,为3种带型,且均分别源自同时间同一采样地点的不同样本,其余82株带型之间均存在不同程度差异。

注:A为QPBC17028和QPBC17029的PFGE图谱;B为QPBC16005和QPBC16006的PFGE图谱;C为QPBC18002、QPBC18003和QPBC18004的PFGE图谱。
3 讨 论
本研究对上海市青浦区2016-2020年5类729份食品进行检测,共检出蜡样芽孢杆菌89株,检出率为12.21%,且菌含量低于国家致病菌限量(105CFU/g),低于我国39个城市的蜡样芽孢杆菌的总检出率(35.00%[11]),以及吉林市的32.90%[12]、宝鸡市的17.65%[13],提示本地区蜡样芽孢杆菌污染具有地区和食品种类特色。受污染样品来源以餐饮服务环节为主,提示应加强餐饮服务环节的菌株污染监测。本地区食品检出蜡样芽孢杆菌以熟制米面制品、学生午餐、熟肉制品为主,与王炜等[14]、HUSSEIN等[15]研究蜡样芽孢杆菌主要污染对象的结论一致,这些食品类别作为即食性食品引起食源性疾病风险较高,提示青浦区需要关注即食性食品在餐饮服务环节被污染。
本研究确证试验和生化分型试验结果证明,青浦区流行生化株为蜡样芽孢杆菌2型,提示应对该流行生化分型多加关注。本研究发现生化分型数据有助于菌株来源分析,但操作复杂、试剂繁多、所需时间长,且存在不能分型的菌株,后续通过毒力基因PCR(小于24 h)和PFGE(小于60 h)对此加以补充,探讨快速确定菌株型别、加快事件分析速度的试验选择,提升检测效率。
本地区毒力基因携带情况呈多样化:89株蜡样芽孢杆菌中nheA、nheB、nheC任意一种基因携带率高达100.00%,与KONG等[16]、YU等[17]研究中nhe基因的携带情况高度一致;腹泻相关基因hblA、hblC、hblD 3种基因均携带率和nheA、nheB、nheC 3种基因均携带率分别为42.70%、56.18%,其产生的溶血素和非溶血素会导致强烈腹泻;张红芝等[4]的研究提示携带ces呕吐毒素基因簇的菌株是引起呕吐型食源性疾病的潜在因子,而本研究中蜡样芽孢杆菌携带呕吐毒素基因ces高达14株且均污染即食性食品(熟制米面制品、学生午餐、熟肉制品),增加了发生食源性疾病的风险。以上提示本区域应加强食品风险监测和食品安全管理,并应对区域内腹泻和呕吐事件多加关注。
PFGE结果显示,青浦区蜡样芽孢杆菌分子分型呈现多态性。同时,蜡样芽孢杆菌菌株编号为QPBC16005和QPBC16006两株、QPBC17028和QPBC17029两株、QPBC18002、QPBC18003和QPBC18004 3株的PFGE图谱相似度为100%,分别为3种带型,均分别源自同时间同一采样地点不同样本,均污染即食性食品,是食品操作环节不当导致的交叉污染(受到相同菌株污染),提示PFGE分型可以实现食品污染的有效溯源,且本区域需提高食品操作环节卫生要求。剩余82株蜡样芽孢杆菌的条带类型分布表明菌株之间无明显聚集性,说明青浦区蜡样芽孢杆菌在遗传特征上目前仍呈高度多样性。
综上所述,本研究分析了蜡样芽孢杆菌在青浦区的污染情况、生化分型、呕吐和腹泻相关的毒力基因携带情况、PFGE分型结果,分析污染食品的潜在风险,探讨快速确定菌株型别检测方法的选择,为评估青浦区食品中蜡样芽孢杆菌污染危害提供重要数据支持。
