人参皂苷Rh2在卵巢颗粒细胞炎性反应中的作用及作用机制网络药理学与分子生物学研究*
2023-01-28王文芳
王文芳,海 鑫
(哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150086)
多囊卵巢综合征(PCOS)是一种以多囊卵巢、高雄激素血症和无排卵为特征的复杂生殖内分泌疾病,是造成女性不孕的重要原因之一,育龄妇女发病率为6%~10%[1]。病理生理学因素包括下丘脑-垂体-卵巢轴紊乱、内分泌及遗传因素等[2-4]。越来越多的证据表明,慢性轻度炎症在PCOS的发展中起着至关重要的作用。尤其是促炎细胞因子表达失调与PCOS相关病因学存在密切联系[5],主要表现为血清中C反应蛋白(CRP)、白细胞介素6(IL6)、肿瘤坏死因子-α(TNF-α)和C-C基序趋化因子配体2(CCL2)等的高表达[6-8]。研究表明,抑制卵巢局部及全身的炎性反应可减轻卵巢炎性反应,从而抑制PCOS模型小鼠的卵巢功能障碍[9-11]。故探讨炎性反应在PCOS中潜在的作用机制对了解PCOS的发病机制具有重要意义。研究表明,西洋参具有清除自由基及抗氧化作用,在抗肿瘤、降糖、降血压、止吐、保护神经等方面具有良好的功效[12];能调节前列腺素生物合成,降低前列腺素E2(PGE2)、卵泡刺激素(FSH)、黄体生成素(LH)等的高激素水平,使雌二醇(E2)分泌接近正常水平,防止卵巢衰老[13];可通过调节血清激素水平和改变卵巢组织中卵巢早衰(POF)相关基因的表达水平,有效预防POF,缓解相关症状[14]。人参皂苷Rh2(简称Rh2)是西洋参的重要活性成分,具有提高免疫力、增强记忆力、抗抑郁和保护心血管等药理作用[15]。同时,Rh2在抗氧化及抗肿瘤活性中起着重要作用[16]。如Rh2通过调节信号转导及转录激活因子3(STAT3)/miR-214信号通路减轻溃疡性结肠炎[17];通过激活调节哮喘模型小鼠核因子-κB(NF-κB),减轻过敏性气道炎症[18]。但Rh2在PCOS中尤其是在内毒素诱导的颗粒细胞验证中的作用及潜在作用机制尚未明确。本研究中基于网络药理学及分子生物学方法探讨了西洋参中主要活性成分Rh2在致卵巢颗粒细胞炎性反应中的作用及作用机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:H-YGD型倒置荧光显微镜(中国凤凰光学有限公司);硝酸纤维素膜(美国PALL公司)。
试药:人参皂苷Rh2(分析标准品,阿拉丁试剂<上海>有限公司,40µmol/L);DMEM高糖培养基、胎牛血清、5%脱脂牛奶(美国Gibco公司);脂多糖(LPS,质量浓度为1 µg/mL),2',7'-二氯双氢荧光素双乙酸酯(DCFH-DA)染色液,均购自美国西格玛公司;1%青-链霉素,辣根过氧化物酶(HRP),与HRP结合的山羊抗兔抗体(编号为GB23303,1∶3 000),十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶,均购自上海碧云天生物技术有限公司;哺乳动物雷帕素靶蛋白(mTOR,广州锐博生物技术有限公司);抗β-actin(美国Abclonal公司,编号为AC004,1∶25 000);抗mTOR(英国Abcam公司,编号为ab109268,1∶1 000);白细胞介素1β(IL-1β)试剂盒、TNF-α试剂盒(南京建成科技有限公司)。
细胞:KGN细胞(人卵巢颗粒细胞瘤细胞系,北纳生物科技有限公司)。
1.2 方法
西洋参活性成分及潜在靶点筛选:通过中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)搜索西洋参已知化学成分,根据口服生物利用度(OB)≥30%且类药性(DL)≥0.18进行筛选,并在TCMSP中预测、提取西洋参有效成分的作用蛋白靶点,将筛选出的蛋白靶点名导入蛋白质数据库(UniProt,https://www.uniprot.org/),物种设置为人类,将作用人类蛋白名称转换成标准基因名。
PCOS疾病相关靶点筛选:通过人类基因信息数据库(Genecards,https://www.genecards.org)及孟德尔遗传数据库(DMIM,https://www.omim.org/)筛选与PCOS相关的疾病基因靶点,剔除重复靶点,设置关联分数≥10,结果导出为Excel文件。
治疗PCOS活性成分筛选:将西洋参活性成分与PCOS疾病靶点导入,取交集数据库(Venn,https://bioinfogp.cnb.csic.es/tools/venny/index.html)进行对比匹配处理,共同靶点即为西洋参治疗PCOS的关键靶点,反向筛选出治疗PCOS的潜在活性成分。
PCOS-西洋参-活性成分-靶点网络构建:将西洋参活性成分、PCOS疾病靶点导入Cytoscape 3.9.1软件,构建疾病-药物-活性成分-靶点基因可视化网络,网络中节点(Node)代表疾病、药物、靶点、活性成分,边用来连接疾病与靶点、靶点与活性成分、活性成分与药物。
蛋白互作(PPI)网络构建:将西洋参治疗PCOS的关键靶点输入蛋白质-蛋白质相互作用数据库(String,https://string-db.org/),物种设置为人类,可信度设置为中等可信,隐藏未连接的节点,其他参数保持数据库系统推荐设置,进行PPI分析,获取PPI网络。
细胞培养及转染:取KGN细胞,进行短串联重复序列(STR)分析以确保细胞真实性,培养于添加10%胎牛血清及1%青链霉素的DMEM高糖培养基,置温度为37℃的CO2孵箱中。为了保持细胞独特的功能特性,仅使用第4~9代的KGN细胞作为实验对象。参考文献[19-20],取LPS(质量浓度为1µg/mL)稀释为质量浓度为200 ng/mL,作用KGN细胞6 h以激活炎性反应。将不同表达的mTOR的质粒分别转染到KGN细胞中作用72 h,进行后续实验。
免疫印迹(Western blot)法[21]分析:使用12%SDSPAGE凝胶分离蛋白质样品,转移到硝酸纤维素膜上,用5%脱脂牛奶在室温下封膜2 h,并在4℃温度下用抗β-actin和抗mTOR过夜孵育过夜。硝酸纤维素膜在磷酸盐吐温缓冲液(PBST)中洗涤3次,与HRP结合的山羊抗兔抗体孵育。使用Image J软件对图像进行定量分析,计算显影正常蛋白与β-actin的灰度值比率,以确定某些蛋白质的改变。
酶联免疫吸附(ELISA)试验:KGN细胞以4×104的细胞密度接种于24孔培养板中,每孔1 mL DMEM/F12,不含红色苯酚和炭化处理的10%胎牛血清。经LPS或Rh2作用后,按IL-1β和TNF-α试剂盒中所述方法进行检测。
DCFH-DA染色:KGN细胞用DCFH-DA染色,用Rh2与LPS单独或共同处理细胞,检测正常组(正常KGN细胞)、LPS组(诱导炎性反应后的KGN细胞)、Rh2组(诱导炎性反应用药Rh224 h的KGN细胞)细胞中的ROS含量的变化,以分析Rh2及LPS对KGN细胞中活性氧(ROS)的影响。按文献[22-23]的操作进行处理,使用荧光显微镜选取随机5个区域分析图像。
1.3 统计学处理
采用SPSS 25.0统计学软件分析。计量资料以±s表示,组间比较行t检验,3组及以上的比较采用单因素方差分析中的Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学分析
西洋参活性成分及靶点:共筛选出西洋参的主要化学成分11个(表1),预测到潜在靶点144个,通过Uniprot数据库标准基因名转换后得到680个作用人类的基因靶点。通过Genecards和OMIM数据库共检索到与PCOS相关的基因358个,其中与西洋参有效成分靶点匹配映射得到西洋参治疗PCOS的靶点共13个,分别为mTOR,AKT3,ESR1及胆碱能毒蕈碱受体3(CHRM3)、胃蛋白酶原1/胃蛋白酶原2(PGR)、类固醇5α还原酶1(SRD5A1)、类固醇5α还原酶2(SRD5A2)、细胞色素P450 19A1(CYP19A1)、细胞色素P450 2C19(CYP2C19)、UDP葡萄糖醛酸转移酶2家族多肽B7(UGT2B7)、细胞色素P450 2C9(CYP2C9)、雄激素受体(AR)、性激素结合球蛋白(SHBG)。

表1 西洋参治疗PCOS的潜在活性成分Tab.1 Potential active components of Panacis Quinquefolii Radix in the treatment of PCOS
PCOS-西洋参-活性成分-靶点网络构建:将西洋参活性成分及疾病相关靶点导入Cytoscape 3.9.1软件构建PCOS-西洋参-活性成分-靶点可视化网络。剔除天然产物分离过程中的“垃圾成分”后,共包含7个化学成分和13个靶点,主要活性成分为MOL000358(β-谷甾醇)、MOL005344(Rh2)、MOL008173(胡萝卜苷)等,详见图1。
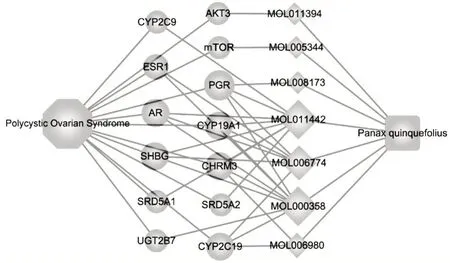
图1 PCOS-西洋参-活性成分-靶点网络Fig.1 Network of PCOS-Panacis Quinquefolii Radix-active components-targets
PPI网络构建:将PCOS及人参皂苷Rh2导入String数据库构建PPI网络,包含13个节点、71条边,平均连接度值为10.93,详见图2。利用Cytoscape3.9.1软件插件中Degree算法确定度值(Degree),并以度值排名 前6的 蛋 白 为Hub蛋 白,其 中ESR1,CYP19A1,SRD5A1,SRD5A2,AR,PGR,mTOR,AKT3 8个蛋白的度值分别为23,20,14,14,14,13,11,7,均大于平均值。

图2 人参皂苷Rh2治疗PCOS的蛋白互作网络Fig.2 Protein-Protein interaction network of ginsenoside Rh2 in the treatment of PCOS
2.2 分子生物学方法分析
Rh2对ROS表达水平的影响:结果显示,与正常组比较,LPS组KGN细胞中ROS的表达水平显著升高(P<0.05);与LPS组比较,Rh2组KGN细胞中ROS的表达水平显著降低(P<0.05),表明Rh2能抑制由LPS导致的炎性反应KGN细胞中ROS水平的升高。详见图3。
Rh2对IL-1β,TNF-α,mTOR表达水平的影响:ELISA实验结果显示,与正常组比较,LPS组KGN细胞中IL-1β和TNF-α的表达水平均显著升高(P<0.05);与LPS组比较,Rh2组KGN细胞中IL-1β和TNF-α的表达水平均显著降低(P<0.05),表明Rh2(40µmol/L,24 h)能抑制由LPS导致的炎性反应KGN细胞中IL-1β和TNF-α表达水平升高。详见图4 A和图4 B。Western bolt实验结果显示,与正常组比较,LPS组KGN细胞中mTOR的表达水平显著升高(P<0.05);与LPS组比较,Rh2组KGN细胞中mTOR的表达水平显著降低(P<0.05),表明Rh2能抑制LPS导致的炎性反应KGN细胞中mTOR蛋白表达水平的升高。详见图4 C和图4 D。
不同表达水平mTOR对IL-1β和TNF-α表达水平的影响:通过细胞转染技术将表达不同水平的mTOR质粒转染到KGN细胞中,采用Western blot法检测KGN细胞中mTOR的蛋白表达水平。结果显示,低表达(50 nmol/L)mTOR能下调KGN细胞中mTOR蛋白表达,过表达(3µg)mTOR能上调KGN细胞中mTOR蛋白表达,详见图5 A。通过ELISA试剂盒检测不同表达水平的mTOR对Rh2保护LPS刺激后KGN细胞中TNF-α和IL-1β的水平。结果显示,与Rh2组比较,低表达mTOR能明显促进Rh2对LPS诱导的KGN细胞损伤的保护作用,过表达mTOR能加重KGN细胞的炎性反应,详见图5 B至图5 D。
3 讨论
PCOS患者多伴随慢性炎症,临床表现为外周血白细胞计数及中性粒细胞计数均增加,同时血清中CRP,TNF-α,IL-1β,IL-6,IL-18等炎性因子的水平均升高[24-25]。而炎性因子水平升高,胰岛素受体酪氨酸激酶的活性会受到抑制,这可能是导致代谢性疾病发生的重要原因之一[6,26]。故本研究中使用LPS刺激KGN细胞模拟体内PCOS的过程,进而研究慢性炎症与PCOS间的作用及潜在作用机制。本研究结果显示,相较于对照组,LPS组中IL-1β和TNF-α的表达水平均升高,而Rh2能逆转此水平的升高,表明Rh2对LPS导致的炎性颗粒细胞有很好的保护作用。

注:与正常组比较,*P<0.05;与LPS组比较,#P<0.05。图4和图5同。图3人参皂苷Rh2对LPS诱导炎性反应KGN细胞中ROS水平的影响(n=3)Note:Compared with those in the normal group,*P<0.05;Compared with those in the LPS group,#P<0.05(for Fig.3-5).Fig.3 Effect of ginsenoside Rh2 on the ROS level in the KGN cells with inflammatory response induced by LPS(n=3)

A.对IL-1β水平的影响B.对TNF-α水平的影响C,D.对mTOR水平的影响图4人参皂苷Rh2对LPS诱导炎性反应KGN细胞中IL-1β,TNF-α,mTOR水平的影响(n=3)A.Effect on the IL-1β level B.Effect on the TNF-α level C,D.Effects on the mTOR levelFig.4 Effects of ginsenoside Rh2 on the IL-1β,TNF-α and mTOR levels in the KGN cells with inflammatory response induced by LPS(n=3)

A,B.不同表达mTOR质粒转染后正常KGN细胞中mTOR的表达C,D.对TNF-α和IL-1β表达水平的影响图5不同表达水平mTOR对KGN细胞中IL-1β,TNF-α,mTOR表达水平的影响(n=3)A,B.Expression of mTOR in normal KGN cells after the transfection of mTOR plasmids with different expression levels C,D.Effects on the expression levels of TNF-α and IL-1βFig.5 Effects of mTOR with different expression levels on the expression levels of IL-1β,TNF-α and mTOR in KGN cells(n=3)
信号通路激活可能参与PCOS炎症的发病机制[27],而炎性因子的产生取决于炎性信号通路的激活。GUO等[28]的研究表明,PCOS患者的mTOR活性高于健康受试者。而mTOR是与多种细胞炎症及增殖相关的重要因子之一,如在前列腺细胞和成纤维细胞中,mTOR的异常表达与炎性信号通路密切相关[29]。但目前尚无Rh2直接调控mTOR参与炎症导致PCOS的相关报道。网络药理学研究结果显示,mTOR可能是Rh2抗PCOS的重要作用靶点之一。mTOR是女性生殖的重要靶点,参与卵巢的各种过程,包括卵巢储备、卵泡发育、卵母细胞减数分裂成熟、卵巢老化、卵巢体细胞增殖和类固醇生成等[30]。同时,卵母颗粒细胞中mTOR表达升高能激活原始卵泡,进而提升卵巢储备,产生保护能力[31]。抑制mTOR会阻碍卵母细胞减数分裂成熟,这可能会限制mTOR抑制药物在生育相关疾病中的应用[32]。临床前的实验研究表明,应用mTOR调节剂有可能改善与POF及PCOS和子宫内膜异位症相关的生育问题[33]。上述研究均说明,mTOR在卵巢功能中具有良好作用。mTOR能作为一个关键因子参与体内ROS表达水平的变化[34],如ROS/mTOR能参与红景天苷保护LPS对心肌细胞的损伤[35]。分子生物学研究结果显示,Rh2能逆转由LPS诱导的KGN细胞中mTOR的表达升高;此外,外源性过表达mTOR能降低Rh2的保护能力,低表达mTOR能增加Rh2的保护能力。以上结果均说明,mTOR可能是Rh2保护LPS诱导KGN细胞炎性反应的主要调节因子。
综上所述,本研究中基于网络药理学分析了西洋参抗PCOS的主要活性成分及潜在的作用靶点;结合分子生物学方法验证了Rh2能通过激活ROS而调控KGN细胞中mTOR的表达,抑制LPS诱导的炎性因子的表达而抑制炎性反应,起到抗炎作用,为Rh2成为PCOS的潜在治疗药物提供了更多实验室依据。
