新型抗肿瘤药物药品不良反应及危险因素分析*
2023-01-28陈春燕单慧亭伊力亚斯买买提艾力朱青梅赵海霞熊代琴
陈春燕,单慧亭,伊力亚斯·买买提艾力,朱青梅,赵海霞,熊代琴△
(1.新疆医科大学第一附属医院,新疆 乌鲁木齐 830011;2.新疆医科大学,新疆 乌鲁木齐 830054)
近年来,以小分子靶向药物和大分子单克隆抗体为代表的新型抗肿瘤药物被广泛应用于临床,为肿瘤的药物治疗带来了新方法[1]。但新型抗肿瘤药物上市时间较短,且上市前的临床研究局限性较多,如受试者筛选严格、样本量有限、观察周期较短等[2],故上市后的使用安全性监测十分重要。本研究中回顾性分析了某三甲医院上报的新型抗肿瘤药物的药品不良反应(ADR),并对使用利妥昔单抗致ADR患者应用倾向性评分1∶2匹配对照组,通过Logistic回归分析识别相关危险因素,为新型抗肿瘤药物的安全应用提供参考。现报道如下。
1 资料与方法
1.1 资料来源
通过中国医院药物警戒系统(CHPS)收集某三甲医院2020年1月至2021年12月使用新型抗肿瘤药物致ADR的评价结果为肯定、很可能和可能等级的有效报告151份,涉及患者151例。收集同期使用利妥昔单抗、原发疾病为血液系统肿瘤的患者854例作为对照。
1.2 方法
回顾性分析:对151例新型抗肿瘤药物致ADR的患者按性别、年龄、原发疾病、给药途径、ADR表现及累及系统、ADR发生及转归等进行统计与分析。
危险因素分析:统计使用利妥昔单抗发生ADR与未发生ADR患者的相关信息,分析ADR发生的危险因素。
1.3 统计学处理
采用SPSS 23.0统计学软件分析。单因素分析中,计数资料用率(%)表示,行χ2检验;多因素分析中,采用二元Logistic回归分析法进行处理。P<0.05为差异有统计学意义。
2 结果
2.1 患者性别与年龄分布
151例 患 者 中,男88例(58.28%),女63例(41.72%),男女比为1.40∶1;年龄6~85岁,平均(56.81±18.19)岁;≥70岁人群占比最高,共39例(25.83%)。详见表1。
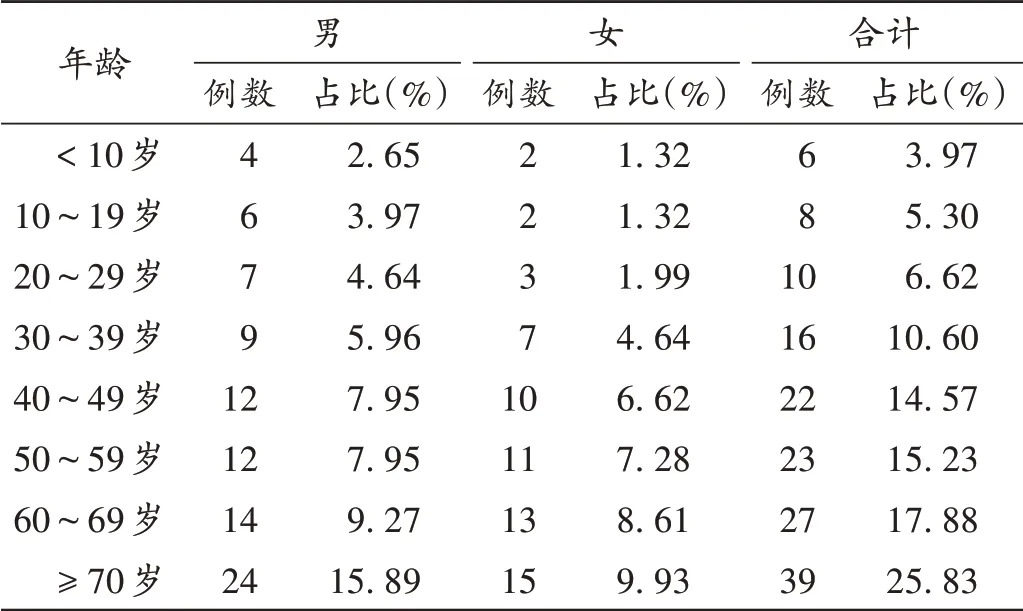
表1 新型抗肿瘤药物致ADR患者的性别与年龄分布(n=151)Tab.1 Sex and age distribution of patients with ADR induced by novel antitumor drugs(n=151)
2.2 新型抗肿瘤药物使用情况
151例患者的原患疾病见表2。给药途径中,静脉给药102例(67.55%),口服给药35例(23.18%),皮下注射10例(6.62%),胸腔灌注4例(2.65%)。超药品说明书用药以超适应证及超给药途径为主,共32例(21.19%),详见表3。

表2 新型抗肿瘤药物致ADR患者的原患疾病(n=151)Tab.2 Primary diseases of patients with ADR induced by novel antitumor drugs(n=151)

表3 新型抗肿瘤药物超药品说明书使用情况Tab.3 Off-label drug use of novel antitumor drugs
2.3 新型抗肿瘤药物分类
根据《新型抗肿瘤药物临床应用指导原则(2021年版)》中对新型抗肿瘤药物的分类,151例ADR中,使用小分子靶向药物81例,涉及9种新型抗肿瘤药物;大分子单克隆抗体70例,涉及15种新型抗肿瘤药物。其中,利妥昔单抗致ADR例数最多,共45例(29.80%)。详见表4。

表4 新型抗肿瘤药物分类(n=151)Tab.4 Classification of novel antitumor drugs(n=151)
2.4 利妥昔单抗致ADR及临床表现
151例ADR中,利妥昔单抗致ADR 45例(78例次),位居新型抗肿瘤药物致ADR第1位,ADR临床表现以寒战(24例次)、发热(16例次)居多,其次分别为皮疹(9例次)、瘙痒(5例次)、胸闷(4例次)、气短(4例次)、肝功能异常(4例次)、头痛(3例次)、恶心(2例次)、骨髓抑制(2例次)、呼吸困难(1例次)、心悸(1例次)、血压升高(1例次)、抽搐(1例次)、腹痛(1例次)。部分患者ADR涉及多个临床表现,故ADR临床表现例次数多于ADR例数。
2.5 利妥昔单抗致ADR危险因素分析
45例使用利妥昔单抗致ADR患者的原发疾病均为血液系统肿瘤。为避免患者的性别、年龄、体质量指数(BMI)对结果的影响,在使用利妥昔单抗未发生ADR的人群中,以1∶2的比例对患者的性别、年龄、BMI进行匹配,卡钳值设定为0.10,获得对照组90例。
采用单因素和多因素二元Logistic回归分析,对患者的过敏史,用药前淋巴细胞水平、粒细胞水平,是否预防用药,是否联用其他抗肿瘤药物,是否首次使用药物6个因素进行分析。结果见表5。

表5 利妥昔单抗致ADR单因素分析[例(%)]Tab.5 Univariate analysis of ADR induced by rituximab[case(%)]
可见,用药前淋巴细胞水平高、粒细胞水平低及预防用药均有显著差异(P<0.05),提示为使用利妥昔单抗致ADR的危险因素。选取单因素分析结果中P<0.05的因素进行多因素Logistic回归分析,结果见表6。可见,用药前淋巴细胞水平高[RR=9.24,95%CI(3.21,26.61),P=0.00]是使用利妥昔单抗致ADR的危险因素。
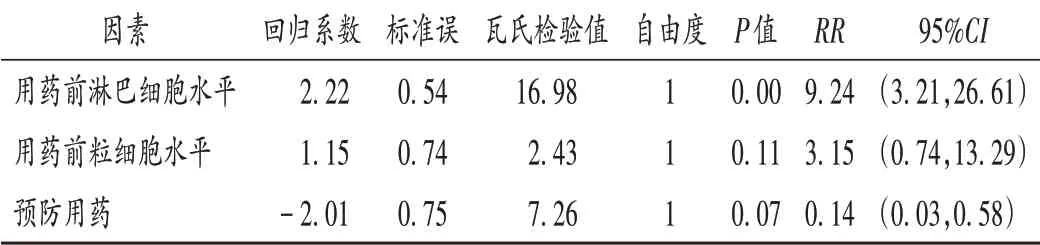
表6 利妥昔单抗致ADR多因素回归分析Tab.6 Logistic multivariate regression analysis of ADR induced by rituximab
2.6 ADR累及系统/器官及临床表现
151例患者中,ADR累及系统/器官主要涉及皮肤黏膜(85例次,36.17%),其次为全身性损害(59例次,25.11%)等。临床表现主要包括皮疹(46例次)、发热(32例次)、瘙痒(25例次)、寒战(25例次)等。部分患者ADR的临床表现涉及多个系统,故ADR临床表现例次数多于ADR例数。详见表7。

表7 ADR累及系统/器官及临床表现(n=235)Tab.7 Systems/organs involved in ADR and the clinical manifestations of ADR(n=235)
2.7 ADR发生与转归时间分布
151例患者中,使用注射剂型116例(76.82%),口服剂型35例(23.18%)。ADR最早发生于首次用药5 min内,最迟发生在用药后第16天。129例(85.43%)发生在用药7 d内。130例(86.09%)患者可在7 d内转归。详见表8。

表8 新型抗肿瘤药物致ADR的发生与转归时间分布(例,n=151)Tab.8 Time distribution of occurrence and outcome of ADR indued by novel antitumor drugs(case,n=151)
2.8 ADR程度分级及转归
151例患者中,严重ADR 15例次,新的ADR 6例次。所有ADR经停药和对症治疗后,好转132例,痊愈19例,无死亡病例。新的和严重ADR分布及临床表现见表9。

表9 新的和严重ADR分布及临床表现Tab.9 Distribution of new and severe ADR and their clinical manifestations
3 讨论
3.1 ADR与年龄、性别的关系
肿瘤发病情况存在显著的性别差异,男性发病率远高于女性[3]。本研究中使用新型抗肿瘤药物致ADR的患者中,男女比例为1.40∶1,与肿瘤发病的性别差异一致。新型抗肿瘤药物致ADR可出现在任何年龄,多见于老年患者。本研究中ADR高发年龄为≥70岁,这可能与老年患者身体机能下降、脏器功能衰退等因素有关。故在制订化疗方案时,应充分考虑患者的性别和年龄因素,加强用药安全监护。
3.2 ADR与原患疾病及超药品说明书使用情况
151例患者中,原患疾病为血液系统肿瘤的比例最高,其次为消化系统和呼吸系统肿瘤。近年来,非霍奇金淋巴瘤、白血病等血液系统肿瘤及肝癌、肺癌等发病率呈逐年增长趋势,新型抗肿瘤药物的用量也随之逐渐增加,其致ADR的比例也在逐渐升高[4]。因肿瘤治疗的特殊性,抗肿瘤药物的超药品说明书使用较常见。151例患者中,有超药品说明书用药32例。14例为超给药途径用药,其中硼替佐米10例,重组人血管内皮抑制素4例。国产硼替佐米(昕泰)给药途径只有静脉注射,进口硼替佐米(万珂)可皮下注射,故临床医师常采用皮下注射。国产硼替佐米(昕泰)皮下注射的安全性尚不明确,国内仅有少数小样本研究[5],超给药途径使用带来的医疗风险不容忽视。重组人血管内皮抑制素的灌注疗法已有较多循证支持,如《中国肿瘤热疗临床应用指南(2017.V 1.1)》中推荐体腔灌注热疗用于晚期恶性肿瘤伴发的胸腔、腹腔积液[6]。18例均为超适应证用药,以使用例次较多的沙利度胺为例,国家卫生健康委员会办公厅发布的《新型抗肿瘤药物临床应用指导原则(2020年版)》指出,沙利度胺可用于初治及难治复发多发性骨髓瘤,用于骨髓增生异常综合征也被相关诊疗指南[7]收录,循证证据级别较高。但超药品说明书用药不受法律保护,风险较高,使用时应在患者知情同意的情况下,做到有据可依、有章可循。
3.3 利妥昔单抗致ADR的因素分析
151份ADR报告中,利妥昔单抗致ADR的例次数居首位,与临床使用量多有关。利妥昔单抗的ADR临床表现以寒战、发热等超敏反应为主,其余还包括皮疹、瘙痒、呼吸困难等。本研究中的多因素Logistic回归分析显示,用药前淋巴细胞水平高的风险比(RR)为9.24,回归系数为2.22,提示淋巴细胞水平高于正常值的患者更易发生ADR。淋巴细胞水平升高是利妥昔单抗致ADR的危险因素,与利妥昔单抗致ADR多以超敏反应为主有关,与刘思源等[8]的研究结果一致。仅45例利妥昔单抗致ADR,是否可通过淋巴细胞水平作为预测利妥昔单抗致ADR的潜在因素,仍需大样本研究论证。另外,利妥昔单抗致ADR有80%发生于首次用药,药品说明书中提示“输注反应主要在首次使用时发生”。使用利妥昔单抗未致ADR患者中,96.67%均给予抗组胺药、糖皮质激素等预防用药。故在使用利妥昔单抗前,尤其是首次用药时,需积极给予预防用药,并关注患者用药前的淋巴细胞水平;输注药物过程中合理控制滴速,密切监护患者的生命体征,一旦出现ADR需及时采取措施。
3.4 ADR累及系统/器官
151例患者中,累及系统/器官以皮肤黏膜居多,主要表现为皮疹、瘙痒等,易被医护人员及患者发现,上报例次数较多。新型抗肿瘤药物致皮肤ADR较常见,主要是由于皮肤组织存在血管内皮生长因子受体及表皮生长因子受体等药物作用靶点[9]。ADR中全身性损害以发热、寒战较多,与单抗类抗肿瘤药物占比高有关。其作用机制可能与使用单抗类抗肿瘤药物后,抗体-抗原相互作用导致细胞因子释放、炎性因子增加有关,更易引起全身性ADR[10]。
3.5 ADR的发生与转归
151例ADR主要发生在用药7 d内。迟发性ADR 22例,提示在使用新型抗肿瘤药物治疗全程均需关注ADR,告知患者在用药中如有不适应及时就医。发生ADR的患者在停药或联合对症治疗7 d内,大部分均可好转或痊愈。
新型抗肿瘤药物致ADR多见于老年患者,可累及多个系统/器官,对患者危害较大。部分为新的及严重ADR,临床使用时应做好防治工作。使用利妥昔单抗尤其是淋巴细胞水平高的患者需加强用药监护,以减少ADR发生,促进新型抗肿瘤药物安全、合理使用。
