鱼类神经坏死病毒研究进展
2023-01-19谢海舟王朝溪欧阳松应
谢海舟,王朝溪,欧阳松应,3
(1.福建师范大学南方生物医学研究中心,福建 福州 350117;2.华中农业大学水产学院,湖北 武汉 430070;3.福建师范大学生命科学学院,福建 福州 350117)
石斑鱼肉质细腻肥美、营养丰富,已成为我国大量养殖的重要经济鱼类之一,2020年养殖量19.2万t,占全国海水鱼养殖总量的11%[1].但石斑鱼养殖过程中面临着重大的风险,石斑鱼为易感染神经坏死病毒(nervous necrosis virus,NNV)的鱼类,病毒主要影响石斑鱼苗种生产期的仔鱼和幼鱼,导致鱼的脑细胞与视网膜坏死产生空泡,继而发病使鱼苗死亡,死亡率最高可达100%[2].2018—2020年我国神经坏死病毒抽查阳性率分别为29%、18.2%与12.3%[3],是我国养殖鱼类病毒中检出率较高的病毒.
NNV属于诺达病毒科β诺达病毒属,为引起石斑鱼的病毒性神经坏死病(viral nervous necrosis,VNN)的病原.NNV于20世纪80年代在澳大利亚发现,病毒形态为无包膜的二十面体,大小约为25 nm,在氯化铯中浮力密度为1.30~1.34 g·cm-3,病毒的遗传物质为RNA,基于上述特点该病毒最早被认为是类小RNA病毒[4].之后在对病毒颗粒以及RNA基因组的鉴定中发现其RNA基因组由两条单链正义RNA组成,分别为2 970 bp的RNA1和1 440 bp的RNA2,且RNA链的3′末端没有poly(A)序列,故将其归类为诺达病毒科,并因为这种病毒主要感染鱼的神经中枢,将其命名为神经坏死病毒[2].
当前主要采用西泽所提出的方法对NNV进行分类,根据神NNV RNA2的同源性,可将NNV分为4类,分别为条斑星鲽神经坏死病毒(barfin flounder nervous necrosis virus,BFNNV)、赤点石斑鱼神经坏死病毒(redspotted grouper nervous necrosis virus,RGNNV)、拟鲹神经坏死病毒(striped jack nervous necrosis virus,SJNNV)与红鳍东方鲀神经坏死病毒(tiger puffer nervous necrosis virus,TPNNV)[5](如图1).此外,也可根据抗原表位的不同分为A、B、C 3种血清型,A型对应SJNNV,B型对应TPNNV,C型对应RGNNV与BFNNV[6].

图1 根据不同基因型病毒株衣壳蛋白序列构建的分子进化树Fig.1 Molecular phylogenetic tree constructed from capsid protein sequences of virus strains of different genotypes
1 NNV基因组与编码的蛋白
NNV的RNA1与RNA2分别编码RNA依赖性的RNA聚合酶(RdRp)与衣壳蛋白(CP),RNA1的3′末端亚基因组中可产生RNA3,RNA3仅存在于病毒感染细胞的过程中,可编译B1与B2两个小蛋白[2,7].
CP蛋白为NNV的唯一结构蛋白,大小约为37 ku,可形成同源三聚体.RGNNV的CP蛋白三维结构可将其分为4个区域:N端的N-arm可以结合病毒的核酸,从而对病毒的遗传物质起到保护作用,S-domain为病毒衣壳的主要组成部分,P-domain是病毒衣壳上的突刺的主要组成部分,linker region连接S-domain与P-domain[8-9](图2a-b).3个CP蛋白共用3个钙离子,钙离子与病毒颗粒的形成、病毒的稳定性与感染力有关.CP蛋白可以与多腺苷酸结合蛋白(PABP)相互作用,降解PABP及抑制细胞内蛋白质翻译[10],CP蛋白的表达还可以激活Caspase-8与Caspase-3,进而最终导致细胞的凋亡[11].RdRp为NNV编码的最大的非结构蛋白,大小约100 ku,在病毒入侵之后定位于宿主线粒体[12],利用宿主核糖体以RNA1为模板进行RdRp的合成,之后RdRp对病毒自身基因组进行复制,并参与病毒基因组RNA 5′端的加帽以及指导病毒的亚基因组RNA3的产生.
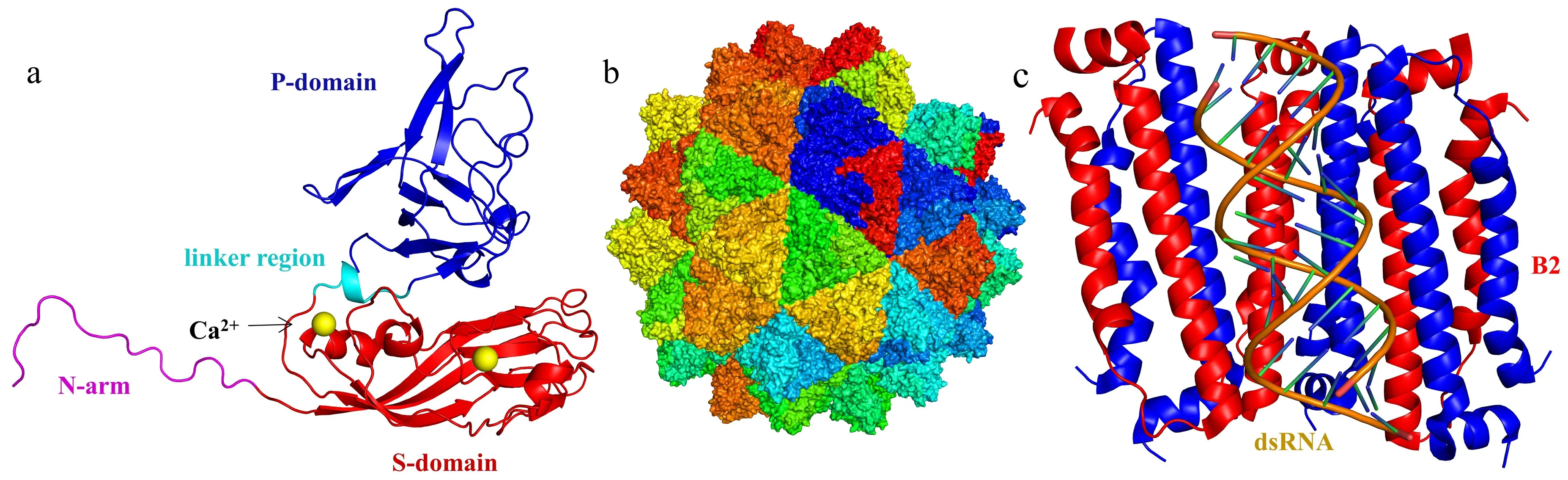
(a)RGNNV CP蛋白三维结构(Cartoon模式):紫色结构域为N-arm,红色结构域为S-domain,青色结构域为linker region,蓝色结构域为P-domain,黄色球状粒子为钙离子;(b)RGNNV病毒样颗粒结构图;(c)B2蛋白(红与蓝)与dsRNA结合模式图图2 RGNNV CP与B2FHV蛋白结构Fig.2 Protein of RGNNV CP and B2FHV
B1蛋白由NNV的RNA1的3’末端的亚基因组中产生的RNA3转录翻译而来,分子质量为12 ku.B1蛋白为感染早期表达的蛋白,从感染之后12 h开始表达,表达之后定位于细胞核中,B1蛋白的表达可以防止受感染细胞的死亡[13],还可以使细胞周期停留于G1/S期,从而短暂的阻止细胞凋亡,为产生新的病毒争取足够的时间[14].B2蛋白由RNA3产生,大小约为8.5 ku,在感染后24 h可检测到B2蛋白的表达.B2蛋白主要存在于细胞核中,细胞质中的B2蛋白主要集中于线粒体中[15-16].在RNA病毒复制过程中,产生的dsRNA会被RNAi途径切割,而B2蛋白可以与dsRNA结合,对RNAi起拮抗作用,从而保护病毒的基因组[15-17].NNV的B2蛋白与dsRNA的结合模式可能类似于α诺达病毒属的FHV(flock house virus)中B2蛋白(B2FHV)与dsRNA的结合模式,B2FHV蛋白自身形成同源二聚体,与dsRNA双螺旋上的大沟相互作用,一条长24 bp的dsRNA可结合三对B2蛋白的同源二聚体,以此保护核酸不受RNAi的影响[17](图2c).线粒体上的B2蛋白可以抑制线粒体电子传递链中的复合体Ⅱ的活性,导致ATP的产生受到抑制与细胞内的活性氧的含量上升,使线粒体发生断裂并触发氧化应激介导的细胞死亡[18-19].
2 NNV受体与诱导的免疫反应
2.1 NNV受体研究
NNV侵入细胞首先需要和细胞膜表面的蛋白相互作用,吸附至细胞膜表面,进而与膜上的受体蛋白相结合,然后通过网格蛋白依赖性的胞吞作用进入细胞中,并且以pH和细胞骨架依赖性的方法进入细胞内[20].使用神经酰胺酶处理后的细胞可以大幅度降低NNV对细胞的附着,说明细胞膜外可能存在某种糖蛋白可以帮助NNV依附于细胞表面,起到富集病毒颗粒的作用[21].目前鉴定的NNV受体蛋白有Nectin4、HSP70与HSP90ab1,对这3个基因的分别敲低均可降低或抑制NNV的感染[22-24].Nectin-4为Nectin家族的成员,在上皮细胞极化过程中参与粘附连接的形成,且可以调节多种细胞活动,包括细胞的运动、极化以及分化[25].HSC70与HSP90ab1在细胞膜外锚定于网格蛋白上,可与NNV形成NNV-GHSC70/HSP90ab1-网格蛋白复合物,之后通过网格蛋白介导的内吞作用进入细胞[24].
2.2 NNV诱导的免疫反应
病毒的感染可以诱导引发宿主的一系列免疫应答,先天免疫为宿主抵御病毒的第一道防线,干扰素(IFNs)与干扰素刺激基因(ISGs)为鱼类先天性免疫的重要组成部分.硬骨鱼中存在Ⅰ型、Ⅱ型与Ⅳ型IFN[26-27].Ⅰ型IFN可分为IFNa、IFNb、IFNc、IFNd、IFNe、IFNf、IFNh等7个亚型,目前报道的I型IFN的异源受体主要组合有细胞因子受体CRFB1/CRFB5和CRFB2/CRFB5;Ⅱ型IFN包括IFN-γ和IFN-γrel,由自然杀伤细胞(NK)与自然杀伤T细胞(NKT)产生,与IFNGR1/IFNGR2受体复合物相互结合;Ⅳ型IFN为IFN-υ,可通过作用于受体IFN-υR1与CRFB4以诱导干扰素刺激基因的表达,使细胞进入抗病毒状态[27].其中Ⅰ型干扰素作为最主要的抗病毒干扰素,与受体结合后形成信号传导复合物,进一步激活JAK/STAT信号通路,最终通过上调细胞核中ISGs的表达,ISGs可进一步发挥抗病毒功能[26].
在感染了NNV的大菱鲆中,IFN-γ引起抗病毒因子Mx蛋白的表达上调,进而引发Ⅰ型IFN的表达升高[28],且Mx蛋白可诱导RdRp的降解[29].在感染了NNV的石斑鱼中发现了Ⅰ型IFN的表达上调[30].感染了RGNNV的石斑鱼脾脏(GS)细胞中检测到了泛素特异性蛋白酶12(USP12)、T细胞胞内抗原(TIA-1)、线粒体抗病毒信号蛋白(MAVS)、肿瘤坏死因子受体相关因子3(TRAF3)等一系列蛋白的表达升高,它们都可作为IFN信号传导的正调节因子,增加IFN相关基因的转录水平[31-34].图3为NNV入侵宿主以及产生相应免疫应答的详细机制图.

① NNV吸附至细胞膜表面,之后与受体Nectin-4、HSC70、HSP90相互作用,进入细胞;② IFN与受体相互作用,激活JAK/STAT信号通路,引起STAT1磷酸化,磷酸化的STAT1与IRF9结合,入核激活ISGs基因的转录;③ Mx与RdRp相互作用,将RdRp引导至细胞核附近的溶酶体中进行降解;④ RLRs识别细胞质中NNV的dsRNA,将信号转导至MAVS,MAVS活化IRF-3/7,促进IFN表达,激活NF-κB信号通路,促进促炎细胞因子的表达;⑤ TNFR被TNFα/β激活,信号转导至TRAF3/NIK复合物,诱导TRAF3降解,引起NIK的积累,NIK激活IKKα,激活NF-κB信号通路图3 NNV入侵宿主以及相关免疫应答机制Fig.3 NNV invasion of host and related immune response mechanism
获得性免疫为机体抵御病毒的第二道防线,包括体液免疫与细胞免疫2个方面.B淋巴细胞为鱼类体液免疫的主要效应细胞,分泌免疫球蛋白IgM对入侵的病毒进行防御,T淋巴细胞为鱼类细胞免疫的主要效应细胞,分泌效应因子杀伤感染病毒的细胞,对抗原进行清除[35].脑是NNV侵染的主要器官,在感染了NNV的石斑鱼脑部可以检测到CD8α与IgM的表达量升高,在受到NNV攻击的石斑鱼脑中还发现了小胶质细胞与NK细胞的标志物,表明获得性免疫在抗病毒过程中同样发挥了重要作用[36].
使用基因表达分析、差异表达分析等一系列转录组学分析可更全面地对病毒感染过程中的免疫反应、细胞凋亡等途径进行分析.对感染了NNV的欧洲鲈鱼脑细胞(DLB-1)进行了差异表达分析,结果显示许多与IFN、热休克蛋白以及细胞凋亡相关的基因表达上调,表明了以IFN为主的免疫反应途径不足以消除NNV的感染,细胞最终凋亡并释放出NNV病毒颗粒[37].miRNA的高通量测序表明120条miRNA的表达存在差异,这些miRNA的靶基因主要对应免疫相关的信号通路,如自噬和TGF-β信号通路[38].在感染了NNV的海鲈鱼中观察到了p53信号通路参与了NNV的感染并且被NNV所抑制,过表达Ljp53基因可以抑制NNV的复制并上调凋亡相关基因的表达,表明了p53信号通路可能促进细胞凋亡以抑制病毒复制[39].在对于感染了NNV的石斑鱼的内质网应激相关通路的分析中发现25个相关基因表达存在上调,表明了NNV的感染可引起内质网应激反应[40].
3 NNV的检测及引起疾病的预防与治疗研究
3.1 NNV的检测技术
NNV可以通过水体传播,一旦鱼种携带病毒,可能危害整个鱼塘,因此对病毒的检测尤为重要.由于实时荧光定量聚合酶链反应技术(RT-PCR)特异性强、灵敏度高的特点,且技术较为成熟,目前市面上销售的NNV检测试剂盒主要为RT-PCR检测试剂盒,许多其他的检测技术也开始应用于NNV的检测中,包括逆转录环介导等温扩增法(RT-LAMP)[41]、胶体金试纸条[42]、夹心酶联免疫吸附剂测定技术(ELISA)[43].
对病毒进行检测的PCR技术有实时荧光定量PCR(RT-PCR)与逆转录环介导等温扩增法(RT-LAMP).根据NNV的RNA2进行RT-PCR引物的设计,最少可检测2个拷贝的病毒载量[44],针对RNA1所设计的RT-PCR程序可以检测最低0.4 TCID50的病毒,且可利用鱼鳍组织进行检测,无需杀死石斑鱼,可应用于平日的检测与早期检测中[45].根据NNV的RNA1序列进行RT-LAMP检测,可在1 h内完成扩增反应,灵敏度较RT-PCR灵敏100倍,反应完成之后阳性样本产生的白色焦磷酸镁沉淀便于直接观察判断结果[46].
侧向流动检测是一种简单、快速的检测方法,只需要少量病毒样品,可在几分钟内实现对病毒的检测.针对于NNV的胶体金试纸条有着与RT-PCR相当的检验特异性与74%的诊断敏感性,检测极限为10-3 TCID 50,可在养殖场环境中对NNV进行快速简便的检测[47].
抗原固定化ELISA可对病毒进行定量检测,但是由于检测NNV的抗体与NNV之间的非特异性反应导致背景较高,使得这种方法重复性较低[48].而使用夹心ELISA法对NNV进行检测可以避免上述问题的发生,且固定过程中NNV的聚集状态的改变使夹心ELISA相比于抗原固定化ELISA有更好的重复性与定量性[49].表1为列举的NNV检测方法及相应特点.

表1 NNV检测方法对比Tab.1 Comparison of NNV detection methods
3.2 神经坏死病的预防与治疗研究
鱼类病毒的预防包括养殖环境的调节、挑选无病毒携带的亲本进行育种以及疫苗接种等方法.养殖环境的调节主要为养殖水体的消杀,包括使用次氯酸钙等化学消毒剂、臭氧消毒、对水体进行加热以及使用紫外线照射水体等手段使NNV完全灭活[50].NNV可通过鱼卵由亲代向子代传播,在鱼卵内部可检测到活病毒的存在,因此在育种时挑选无NNV携带的亲鱼[51]以及对鱼卵使用病毒清洗液进行清洗[52]可较为有效地抑制NNV传播.
使用疫苗为预防病毒感染的一种重要措施,但现阶段国内并未有商业化的疫苗可以售卖,在国外有ALPHA JECT micro® 1 Noda与ICTHIOVAC® VNN这2款注射型疫苗售卖,由于注射型疫苗需要单独对每条鱼进行接种,效率低下,因此更为省时省力的浸泡式疫苗的研发也在不断推进,并且取得了较好的保护效果[53].
灭活NNV疫苗和亚单位疫苗可使接种的鱼产生高滴度的中和抗体,使用灭活的NNV病毒对多种鱼苗进行免疫均显示出了强大的保护能力[54-56].此外,使用热灭活方法对NNV进行灭活无法起到免疫保护效果,原因是在热灭活过程中,NNV表面的突刺结构消失,导致其免疫原性消失[57].
亚单位疫苗是通过对病毒的结构蛋白进行体外重组表达,使其组装形成与野生型病毒高度相似的病毒样颗粒(VLP),为一种免疫原性好且安全性高的疫苗.报道的NNV-VLP已在大肠杆菌[58]、毕赤酵母[59]、本氏烟草[60]以及昆虫细胞[61]中表达成功.使用NNV-VLP对鱼苗进行免疫可以有效地保护鱼苗不受NNV的侵害,且可在疫苗注射后的数月中持续保护鱼苗,降低NNV感染的死亡率[59,62].使用冻干技术对NNV-VLP进行储存可以有效延长疫苗的保质期,相比于水相保存,冻干疫苗无需冷链保存,可大幅度降低疫苗的保存成本[63].
抗体与抗原存在较强的亲合力与特异性,因此可用于防治多种病原性疾病.IgY存在于多种卵生动物的卵黄中,使用含有抗NNV的IgY卵黄处理GF-1细胞表现出了良好的保护作用[64].羊驼纳米抗体(VHH)天然缺失轻链,只由重链构成,体积只有IgG的十分之一,有着体积小、渗透性好以及稳定性高的特点,使用抗NNV的VHH对NNV进行中和也展现了VHH的良好的保护能力[65-66].
使用GF-1细胞对NNV的抑制药物进行筛选,得到了多种有抗病毒效果的药物,包括抗菌药物、神经递质剂与细胞色素P450抑制剂等.细胞色素P450抑制剂——盐酸丙二芬可抑制NNV细胞病变效应(CPE)的形成与病毒RNA的复制[67].金刚烷胺广泛用于治疗中枢神经系统疾病,有抗NNV感染的效果,且金刚烷胺可迅速的从鱼体内排出,无需担心药物残留[68].此外,以单壁碳纳米管做为载体配合抗NNV药物金刚烷胺和靶向配体NNV特异性纳米抗体,构建了纳米体介导的NNV靶向给药平台,此平台可以有效地穿过血脑屏障,有良好的NNV靶向能力,在中枢神经系统病毒性疾病治疗中展现出广阔的前景[69].适体是指通过指数富集配体系统进化(SELEX)筛选得到的短单链DNA或RNA,适体通过特殊的三维结构与目标蛋白结合,形成适体-蛋白复合物,达到对疾病进行治疗的目的[70].对于抗NNV感染的DNA适体的表征显示出了适体具有良好的抗病毒效果[71-73].抗NNV的适体可以和病毒的CP蛋白相互结合进入感染的细胞中,将DNA适体-siRNA进行偶联可递送siRNA进入受感染的细胞内,在细胞内阻止NNV的RNA复制,可有效地阻断NNV的感染[73].
抗菌肽为一种短肽链药物,起到免疫调节与抗细菌感染的作用,可作为抗生素的替代药品[74].罗非鱼铁调素1-5(TH1-5)与环状虾抗脂多糖因子(cSALF)2种抗菌肽可吸附NNV,将病毒粒子凝集成团块状,从而阻止病毒进入细胞;石斑鱼epinecidin-1则可诱导Mx蛋白表达从而起到抗病毒作用[75];抗菌肽NK-lysin由NK细胞或CTLs细胞分泌,在细胞介导的细胞毒性(CMC)中起主要作用,NK-lysin抗菌肽可调节免疫标志物的转录与提高鲈鱼对NNV感染的抗性,大幅提高NNV感染时鲈鱼的存活率,显示出了良好的抗病毒效果[76].表2为列举的NNV预防、治疗方法及其优缺点.

表2 NNV预防与治疗方法对比Tab.2 Comparison of NNV prevention and treatment methods
4 总结与展望
NNV广泛分布于世界各地的海洋之中,可感染以石斑鱼为主的多种鱼类,中国也不例外,NNV的高检出率说明其可能对中国海水鱼养殖行业造成严重的经济损失,所幸的是现在快速准确的检测技术,可对携带NNV的鱼类进行检测.此外,对NNV的治疗药物的开发也在不断进行,虽然还未有商业化产品,但大部分药物都显示出了有较好的治疗效果,具有开发为有效的抗NNV商品化药物的潜力.
在病毒致病机理研究方面,现阶段已经发现一系列ISGs在NNV的入侵过程中发挥了抗病毒作用,诱导机体对病毒入侵做出反应,包括激活TNF信号通路、活化免疫细胞.关于NNV是否存在更多受体值得进一步探讨,对NNV感染过程,深入对NNV与受体结合机制的研究有利于NNV靶向治疗研究的发展.对于NNV的入侵以及致病机制研究的深入可加深对于这类病毒的理解,有利于未来针对NNV的疫苗以及药物设计提供新的思路.
