一株诺西肽产生菌的发掘及发酵条件优化
2023-01-19孙启航徐允聪吴羚锐容佳乐王彦文曹玉丹吴旭日
孙启航,徐允聪,吴羚锐,容佳乐,王彦文,曹玉丹,罗 晨,吴旭日
(中国药科大学生命科学与技术学院生物化学教研室,南京 211198)
抗生素是对抗病原微生物感染的重要武器,为公共健康事业做出了巨大贡献[1-3]。然而,抗生素的滥用使得细菌耐药性传播速度迅速增长[4-5]。因此,寻找具有新骨架、新机制的化合物迫在眉睫。
诺西肽是一种核糖体翻译后修饰肽[6],对革兰氏阳性病原体的各种耐药株,尤其是耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌具有极强的抗菌活性[7-8],由于其抗菌机制新颖受到广泛的关注[9]。但是,因为缺乏体内活性,诺西肽的成药研究一直受到阻碍[10]。然而,同样属于硫肽类抗生素的诺卡沙星Ⅰ则具有较好的体内活性[11],其活性主要归功于结构中的特殊糖基——二甲氨基葡萄糖,该糖基的存在一定程度上增加了溶解度,有助于药物在体内的分布,从而具有较好的体内活性。然而,诺卡沙星Ⅰ的结构稳定性差的缺陷限制了其成药开发[12],尽管对诺卡沙星Ⅰ的结构进行了各种修饰[13-15],但由于诺卡沙星Ⅰ的复杂结构和有限的修饰位点,其成药性差这一难题仍未解决。在比较了诺西肽与诺卡沙星Ⅰ的结构后(图1),诺西肽由于丰富的可修饰位点及良好的结构稳定性使其成为了发现具有体内活性的新类似物的合适模型。

Figure 1 Structural comparison of nosiheptide and nocathiacin I
随着基因组测序技术的快速发展,以及公共数据库中可用基因组数据的增加,生物合成基因簇的挖掘成为了获得新天然产物的常用手段[16-17]。本研究从诺西肽的生物合成基因簇出发,对可能的诺西肽衍生物生物合成基因簇进行搜索,以获得具有更好抗菌活性和理化性质的衍生物。
1 材 料
1.1 试 剂
乙腈(色谱纯,安徽天地高纯溶剂有限公司);甲酸(色谱纯,上海阿拉丁生化科技股份有限公司);甲醇(分析纯,苏州亚盛药业有限公司);其他试剂均为市售分析纯。
1.2 仪 器
LC-MS(日本岛津公司);凝胶成像仪(上海天能生命科学有限公司);ODS色谱柱(250 mm × 4.6 mm,5 µm,日本YMC公司);高速离心机(美国赛默飞世尔公司);Bruker Avance 500MHz 核磁共振波谱仪(德国布鲁克公司);制备液相(美国Waters公司)。
1.3 菌 株
Actinoalloteichussp. AHMU CJ021 购自中国普通微生物菌种保藏中心。
2 方 法
2.1 基因组数据挖掘诺西肽衍生物的生物合成基因簇
将S.actuosusATCC 25421 诺西肽生物合成基因簇中15个核心生物合成基因[18]用作探针在NCBI数据库进行比对,含有13 个或以上相似基因且包含编码诺西肽前体肽的关键基因nosM[19]的生物合成基因簇被用于进行antiSMASH 分析[20]推测可能的代谢产物。
2.2 菌株的发酵
28 ℃条 件 下,Actinoalloteichussp. AHMU CJ021 培养于ISP2 固体培养基以产生孢子。将孢子悬浮液50 µL 接种到液体ISP2 培养基50 mL 中,28 ℃、220 r/min 下培养2 d 以产生种子培养物。将种子培养液1 mL 分别接种于50 mL 发酵培养基SM1(大豆粉10 g/L、葡萄糖18 g/L、Na2SO41 g/L、CaCO30.2 g/L)、SM5(蛋白胨20 g/L、牛肉浸膏8 g/L、葡萄糖15 g/L、甘油10 g/L、CaCO30.2 g/L、)、SM25(蛋白胨10 g/L、麦芽浸膏21 g/L、甘油40 g/L)、SM27(可溶性淀粉15 g/L、K2HPO40.4 g/L、蛋白胨4 g/L、NaCl 0.4 g/L、牛肉浸膏1 g/L、MgSO40.6 g/L、KNO31 g/L、FeSO40.01 g/L)和SM31(酵母提取物9 g/L、蛋白胨1.8 g/L、葡萄糖20 g/L、K2HPO41 g/L、MgSO40.5 g/L、pH 4.5),进行单菌多次级代谢产物(one strain many compounds,OSMAC)策略分析。
2.3 发酵产物的分离与鉴定
发酵7 d后,加入等体积甲醇,0.22 µm有机滤膜过滤后进行LC-MS 检测。以10% ~ 90%的乙腈洗脱25 min,流速1.0 mL/min,柱温30 ℃,紫外检测波长190 ~ 330 nm。MS 检测参数为:负电离模式,接口温度295 °C,保护气12 L/min,干燥气体氮气流量8 L/min,雾化器压力206.85 kPa,喷嘴电压1.5 kV,毛细管电压4 kV,扫描范围m/z100 ~ 2 000。用Waters 制备液相对目标化合物进行纯化,制备30 mg 纯品(纯度> 99.7%)后在核磁共振波谱仪上进行分析。
2.4 转录调控蛋白NocP的引入
利用特异性引物从Nocardiasp. ATCC 202099扩增转录调控蛋白NocP的基因nocP,PCR 产物用NdeⅠ和EcoRⅤ双酶切并连接到pSET152E 载体(pSET152E为带有红霉素启动子的pSET152载体)上。将重组质粒通过结合转移[21]导入Actinoalloteichussp.AHMU CJ021中。
2.5 单因素分析确定发酵培养基成分
Actinoalloteichussp. AHMU CJ021 原发酵培养基成分为20 g/L 蛋白胨、8 g/L 牛肉浸膏、15 g/L 葡萄糖、10 g/L 甘油和0.2 g/L CaCO3。用单一的碳源、氮源、无机盐和氨基酸替换原发酵培养基成分,并通过HPLC 检测诺西肽产量。替换的6 种碳源为麦芽糖、葡萄糖、乳糖、可溶性淀粉、玉米淀粉和甘油,质量浓度为40 g/L。氮源为牛肉浸膏、蛋白胨、酵母提取物、大豆粉、玉米浆和(NH4)2SO4,质量 浓 度 为20 g/L。无 机 盐 为CaCl2、FeSO4、KCl、MgCl2、MgSO4和ZnCl2,质量浓度为0.2 g/L。氨基酸为精氨酸、组氨酸、丝氨酸、苏氨酸、酪氨酸和谷氨酸,质量浓度为0.2 g/L。
2.6 Plackett-Burman实验
对单因素实验中获得的5种最佳营养成分进行了12 组5 因素2 水平的Plackett-Burman 实验,利用Design Expert 10.0 软件分析实验结果,确定对诺西肽产量有显著影响的成分,所有实验重复3次。
2.7 中心组合设计响应面法(CCD)优化培养基
通过20 次3 因素5 水平的CCD 实验对Plackett-Burman 实验得出的对诺西肽产量有显著影响的营养成分进行优化。利用Design Expert 10.0 软件分析实验结果,计算各营养成分的最佳浓度,所有实验重复3次。
3 结 果
3.1 诺西肽类似物的生物合成基因簇
经过序列比对发现共有5 个菌株中含有13 个及以上的诺西肽核心生物合成基因,且包含编码诺西肽前体肽的关键基因nosM。同时用antiSMASH 定位这些菌株中的诺西肽生物合成基因簇并分析其中是否含有糖基转移酶NocS1 的相似蛋白。符合条件的基因簇及其宿主菌见表1。
结果显示,仅有Actinoalloteichussp. AHMU CJ021 基因簇中的ctg1-102与糖基转移酶NocS1 的氨基酸序列具有43.3%的同源性,且该基因簇包含诺西肽生物合成的15 个关键生物合成基因(表2)。推测该菌株具有产生糖基化诺西肽的潜力,该糖基化衍生物可能具有与诺卡沙星Ⅰ相似的较好的体内活性。
3.2 Actinoalloteichus sp. AHMU CJ021 发酵产物的检测
使用SM1、SM5、SM25、SM27和SM31发酵培养基对Actinoalloteichussp. AHMU CJ021 进行发酵,利用LC-MS 对发酵产物进行检测。结果见图2。结果表明5 种培养基的提取物在15.1 min 时都产生了与诺西肽标准品相对应的峰(化合物1)以及分子离子峰m/z1 220.139 2(M-H)-。该产物在SM5 发酵培养基中产率最高,达到了8.23 mg/L。核磁共振分析表明,化合物1与诺西肽具有一致的结 构[22],为 同 一 物 质,证 明Actinoalloteichussp. AHMU CJ021为一株诺西肽产生菌。然而,尽管存在糖基转移酶基因ctg1-102,却并没有在发酵产物中检测到糖基化诺西肽。通过RT-PCR对Actinoalloteichus sp. AHMU CJ021 诺西肽生物合成基因簇中各基因的转录分析发现,所有与诺西肽生物合成有关的基因,包括存在其簇内的糖基转移酶基因ctg1-102均能正常转录,从而排除了因糖基转移酶基因沉默导致的糖基化诺西肽缺失。

Table 1 AntiSMASH analysis of screened strains by genome mining

Table 2 Deduced functions of genes in the predicted glycosylated nosiheptide biosynthetic gene cluster of Actinoalloteichus sp.AHMU CJ021
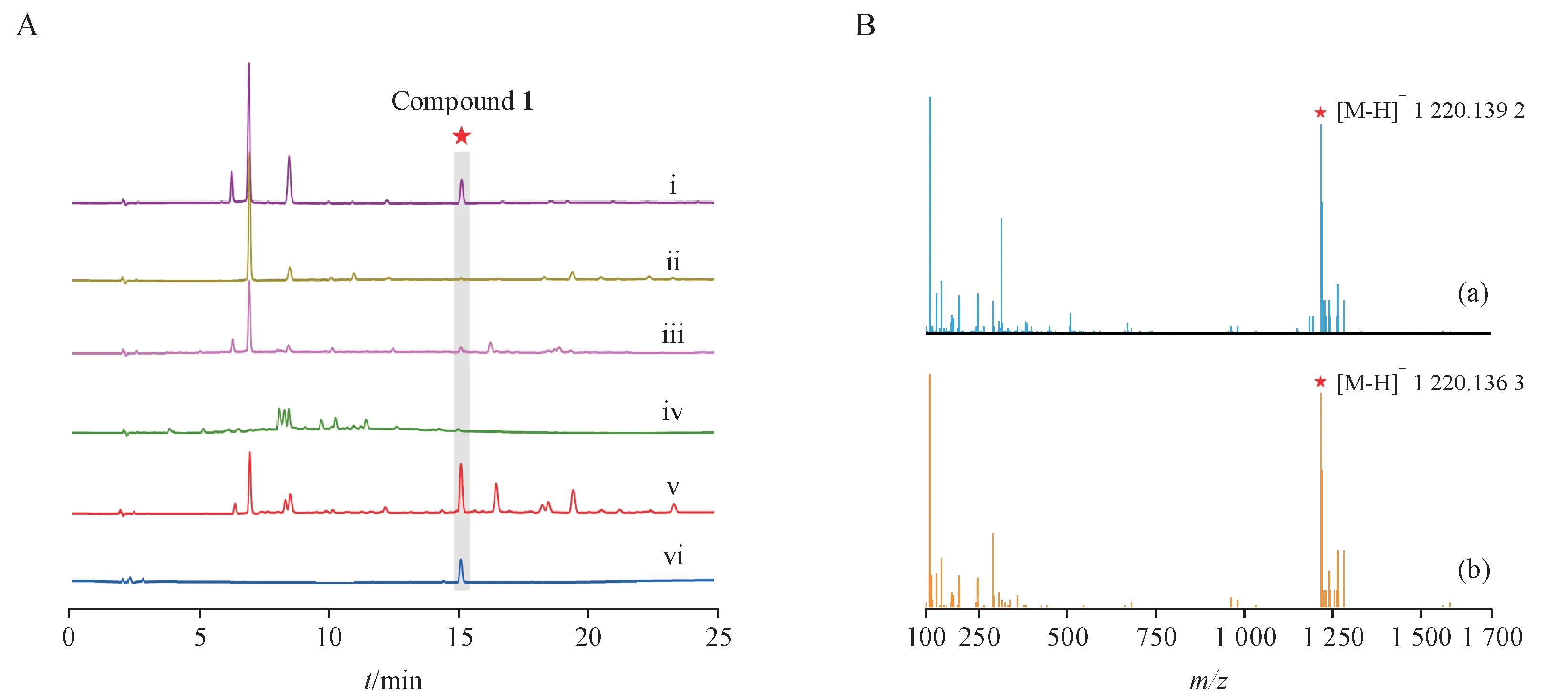
Figure 2 OSMAC strategy for the fermentation of Actinoalloteichus sp. AHMU CJ021
3.3 转录调控蛋白NcoP的调控效应
nosP在S. actuosusATCC 25421 的诺西肽生物合成基因簇中编码SARP家族转录调节因子NosP,可激活簇内各基因的转录[23-24]。在诺卡沙星Ⅰ的生物合成基因簇中,NocP 作为NosP 的同源物,发挥同样的转录激活功能[25]。因此推测存在于Actinoalloteichussp. AHMU CJ021 诺西肽生物合成基因簇中的糖基转移酶基因ctg1-102可能无法被NosP 有效激活,但由于ctg1-102与nocS1较高的相似性,ctg1-102的激活可能受到NocP 调控。因此,将NocP 在Actinoalloteichussp. AHMU CJ021 中 异源表达可能会激活糖基化诺西肽的产生。然而,通过穿梭载体pSET152E 将nocP导至Actinoalloteichussp. AHMU CJ021 异源表达后仍未产生糖基化诺西肽(图3-A)。
尽管预期的糖基化诺西肽没有产生,但是在比较Actinoalloteichussp. AHMU CJ021 与S. actuosusATCC 25421 的诺西肽生产情况时发现,Actinoalloteichussp. AHMU CJ021 发酵得到的诺西肽具有更高的纯度(图3-B),其发酵过程中产生的副产物,一种末端脱氢丙氨酸缺失的诺西肽类似物[26],含量仅为2.8%(保留时间14.3 min),远低于S. actuosusATCC 25421(28.63%)。因此该菌株可作为生产高纯度诺西肽的生产菌株。

Figure 3 Effects of NocP on fermentation extractive of Actinoalloteichus sp. AHMU CJ021 and S. actuosus ATCC 25421
3.4 发酵培养基成分的单因素分析
不同的营养成分对代谢产物的产生具有较大影响[27-28]。本研究采用单因素法研究了不同碳源、氮 源、无 机 盐、氨 基 酸 对Actinoalloteichussp. AHMU CJ021 诺西肽产量的影响。图4 表明,4 类营养因素中适合诺西肽发酵的成分为葡萄糖、酵母提取物、牛肉膏、酪氨酸及KCl。
3.5 基于Plackett-Burman 实验和响应面法的诺西肽发酵培养基优化
Plackett-Burman 实验[11,29]被用于确定对诺西肽产量有显著影响的营养成分。在对单因素分析筛选出的营养成分进行了12 组5 因素2 水平的Plackett-Burman实验。结果显示,诺西肽的最低产量和最高产量分别为3.26 和59.57 mg/L(表3)。且葡萄糖(P< 0.01)、牛肉浸膏(P< 0.05)和酵母提取物(P< 0.05)对诺西肽的产量有显著影响。
通过CCD对PB实验中得出的3种营养成分进行了3因素5水平的20组实验[30-31],结果如表4。
拟合的二阶回归方程为:

其中,Y表示诺西肽的产量(mg/L),A、B 和C 分别表示葡萄糖、牛肉浸膏和酵母提取物的质量浓度(g/L)。
采用ANOVA 评价CCD 产生的模型的合理性,R2为0.99 表明该模型的结果可信度为99%。其他相关参数例如PredR2(0.98)、AdjR2(0.94)和Adeq 精度(27.34 > 4)均表明二阶回归方程及其应用模型的合理性。同时,F检验计算出该模型的P< 0.001,表明该模型在统计分析中具有显著性。为了验证各变量统计学意义,对葡萄糖(A)、牛肉浸膏(B)以及酵母提取物(C)进行F检验。如图5所示,葡萄糖和牛肉浸膏具有极显著的线性和平方效应(P< 0.001)。酵母提取物的平方效应C2(P< 0.001)具有显著性,而交互组AB、AC、BC 的显著性不明显,在二阶回归方程中可以忽略。因此,葡萄糖、牛肉浸膏和酵母提取物是影响诺西肽产生的重要因素,对于Actinoalloteichussp. AHMU CJ021诺西肽的产生有重要影响。

Figure 4 Effects of nutritional factors on the production of nosiheptide (± s, n = 3)

Table 3 Effects of variables on nosiheptide production using P-B design

Table 4 Experimental design and results of central composite design

Figure 5 Response surface plots for optimized nosiheptide production
3.6 诺西肽最优发酵培养基的验证
通过回归方程计算出诺西肽理论最高产量为56.84 mg/L,对应的葡萄糖质量浓度为28.16 g/L,牛肉浸膏质量浓度为21.43 g/L,酵母提取物质量浓度为19.87 g/L。用该培养基进行发酵后,得到的诺西肽为58.73 mg/L,副产物含量仅0.96%,与理论值相近,比原始发酵培养基SM5 的产量提高了约6倍。
4 讨 论
尽管异源表达调控蛋白NocP,通过基因组数据挖掘定位的Actinoalloteichussp.AHMU CJ021 仍未产生预期的糖基化诺西肽。在排除基因沉默的情况下,可能负责糖基模块生物合成的基因与该基因簇的调控系统不兼容,因此异源表达不起作用。然而,本研究发现该菌株所产生的诺西肽在纯度方面优于诺西肽产生菌S. actuosusATCC 25421。通过响应面法优化发酵条件后,产量提高了约6倍。在细菌耐药性传播如此严重的时代,这为研究诺西肽类似物以解决其水溶性和体内活性较差的问题奠定了研究基础。
5 结 论
虽然预期的糖基化衍生物无法获得,但是由于Actinoalloteichussp.AHMU CJ021 发酵生产诺西肽的副产物含量远低于常用的诺西肽生产菌株S. actuosusATCC 25421。通过响应面法优化后,诺西肽产量达58.73 mg/L,副产物含量仅0.96%,本研究认为该菌可以成为工业化生产高纯度诺西肽的合适候选菌株。
