右胫骨上段Rosai-Dorfman病一例并文献复习
2023-01-18陈浩斌姚孟宇张驰曾龙辉黄文汉雷泽华詹昭颖张余
陈浩斌,姚孟宇,张驰,曾龙辉,黄文汉,雷泽华,詹昭颖,张余
1.广东省人民医院(广东省医学科学院)骨肿瘤,广东 广州 510080;
2.南方医科大学第二临床医学院,广东 广州 510515
罗道病(Rosai-Dorfman disease,RDD)又称窦组织细胞增生伴巨大淋巴结病,是一种系统多发的、病因不明确的、罕见的良性组织增生性疾病[1],由Dorfman和Rosai在1969年将其正式命名为Rosai-Dorfman Disease[2]。该病可累及人体各系统器官,目前在神经系统、消化系统及生殖系统等有个案报道。RDD多见于青少年患者,平均年龄31岁,在性别上差异不明显[1,3]。该病发病率极低,国内外RDD相关个案报道仅1 200余例,国内80余例[4]。2000年以来涉及骨骼系统RDD国内报道仅20例[5],本研究分析1例经病理科确诊的骨骼系统RDD,结合文献综述以提高对RDD的认识。
1 病例简介
1.1 病例资料患者,女,52岁,因“右胫骨上段肿痛4个月余”于2021年12月入院。患者4个月前因运动后出现右胫骨上段肿痛,进行性加重。既往有甲状腺亢进症病史10年,规律服用优甲乐,4个月前已停药。査体:体温(T)36.5℃,心率(P)70次/min,呼吸(R)20次/min,血压(BP)125/70 mmHg(1 mmHg=0.133 kPa),神志清楚,检查合作,皮肤黏膜色泽、温度正常,全身浅表淋巴结未触及肿大。专科査体:右小腿上段触及大小约3 cm×2 cm肿块,质稍硬,不易推动,皮肤无发红,无破溃及瘘道形成,轻度压痛,四肢肌力Ⅴ级,四肢肌张力、感觉和循环正常,双侧膝关节及踝关节活动未见异常,生理反射存在,病理症阴性。2021年12月31日行右胫腓骨X线片(图1A、图1B),提示右胫骨上段骨质破坏。2021年12月30日行右小腿MRI(图1C、图1D),考虑骨髓炎可能性大。2021年12月29日行右小腿PET-CT(图1E、图1F),不除外骨恶性肿瘤可能。结合病史、体格检查及辅助检查,考虑患者抵抗力较强,脓肿被包围在骨质内,且常发生于胫骨上下端,起病时一般无明显症状,仅于数月或数年后第一次发作时才有局部红肿和疼痛,临床初步诊断右胫骨局限性慢性骨髓炎,需排除肿瘤性病变。
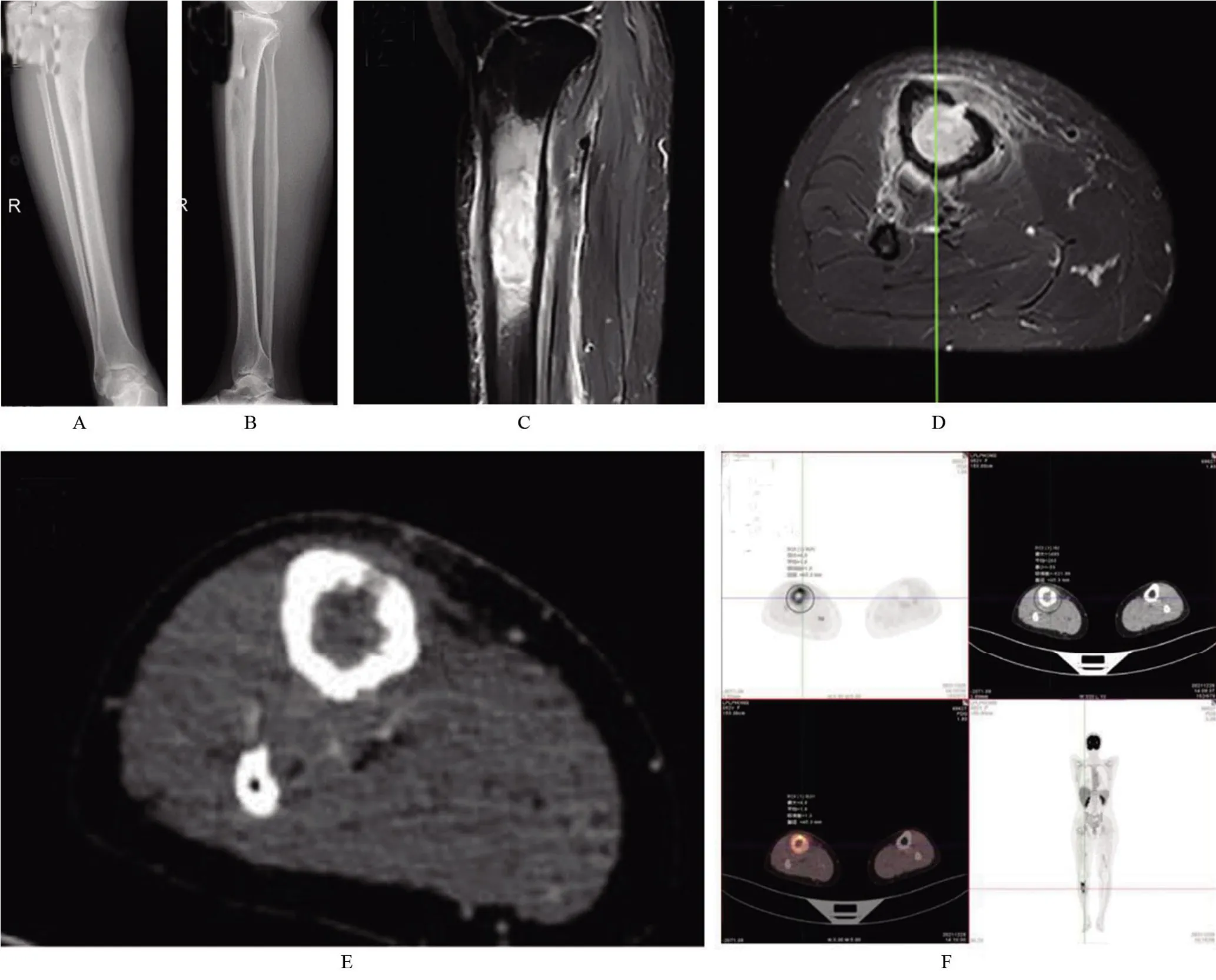
图1 术前影像学检查Figure1 Preoperativeimaging examination
1.2 手术方法本例患者首选诊断为慢性骨髓炎,因未能完全排除肿瘤性病变可能,手术方式采取为:首先术中取病理行术中冰冻病理诊断,排除肿瘤病变后按慢性骨髓炎处理,既病灶清除+冲洗引流,二期闭合创面。2021年12月31日行右胫骨开窗引流术并行术中冰冻病理活检:C臂定位病灶后取右胫骨近端前外切口,长约12 cm,逐层切开皮肤、皮下组织、筋膜,显露右胫骨近端;探查右胫骨近端,可见灰黄组织,质中,4.6 cm×3.7 cm×1.4 cm大小,侵蚀胫骨近端;彻底刮除病灶,至胫骨正常松质骨组织,取部分病灶送冰冻病理检查,其余标本送细菌、真菌培养和普通石蜡病理检查,术中冰冻提示需鉴别慢性炎症性病变与交界性或低级别间叶源性肿瘤,因术中冰冻取材和制片的局限性,最终诊断需待石蜡,反复冲洗创口后行负压吸引,术后行抗生素治疗。排除感染和恶性肿瘤病变后,二期闭合伤口,术后放置引流管。
1.3 病理、免疫组化及细菌、真菌培养检查病灶细菌和真菌培养为阴性;术后巨检:(右胫骨)灰黄灰红组织一堆,4.6 cm×3.7 cm×1.4 cm大小,切面灰黄灰红,质中(图2 A);镜检(图2 B)示:送检骨组织及纤维组织内可见呈片状增生的组织细胞样细胞,低倍镜见淡染区与深染区交替分布,浅染区由大量增生的组织细胞样细胞构成,伴中性粒细胞、浆细胞及淋巴细胞浸润;深染区为丰富的淋巴细胞和浆细胞;间质纤维组织增生。加做免疫组化显示:CK(-),S100(+),CD68(广 泛+),CD163(广 泛+),CD1a(-),Langerin(-),CD138(部分+),CD38(部分+),Kappa(部分+),Lambda(部分+),IgG4(+),IgG(+)。特殊染色结果:PAS(-),PM(六胺银染色)(-),抗酸(显示结核菌、麻风菌)(-),革兰氏染色(-)。综合细胞形态、免疫组化和特殊染色分析,病变符合(右胫骨)Rosai-Dorfman病。结合PET-CT检查结果,排除多器官累及的Rosai-Dorfman病,仅有(右胫骨)病灶,符合结外孤立性Rosai-Dorfman病。
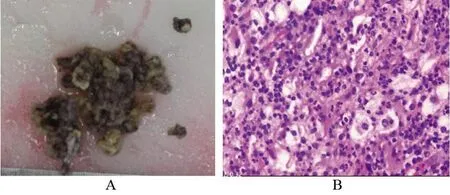
图2 右胫骨术后病理Figure2 Pathology of the right tibia after surgery
1.4 治疗效果患者二期闭合伤口后3 d拔除引流管后下床活动,无不适,四肢肌力正常,未出现功能障碍。术后随访2个月,患者右侧小腿未诉不适,复查右侧胫腓骨正侧位X片未见复发(图3)。
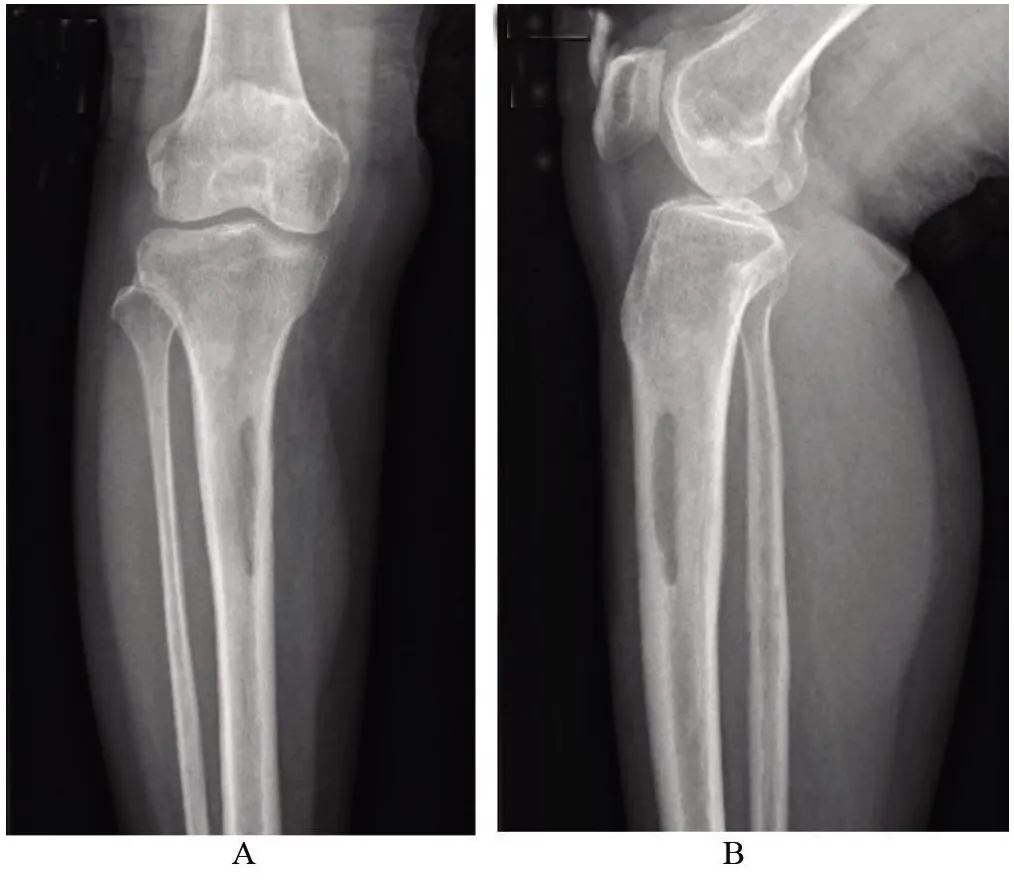
图3 术后2个月复查胫腓骨正侧位X片Figure 3 Review of the frontal and lateral X-rays of the tibia and fibula 2 monthsafter theoperation
2 讨论
2.1 临床表现RDD发病机制尚未明确,可能与免疫系统功能失调、患者基因变异及病毒感染有关[6-8]。RDD常见首发的临床表现是双侧颈部淋巴结无痛性肿大[9],约一半的患者存在淋巴结外症状,主要累及皮肤、鼻旁窦[10]、中枢神经系统及消化系统[11]等。本病例中骨骼系统RDD较为罕见,不足RDD的2%,骨骼系统RDD常发生于胫骨,呈慢性病程[8,12]。RDD主要的临床症状包括肿胀和疼痛[3],可出现血沉增快、发热、白细胞增高等表现[9,13],但不具备特异性。本病例结合病史、体格检查及辅助检查,临床初步诊断考虑为右胫骨局限性慢性骨髓炎,需排除肿瘤性病变,需进一步检查明确诊断。
2.2 影像学表现骨骼系统的RDD影像学不作为确诊依据,X线的典型表现主要为溶骨性破坏,轮廓不规则,边界模糊,少数患者可伴有周围硬化[3];在CT上可见不连续的孤片状钙化影,增强后病变部位可见明显强化;在MRI上常表现T1WI为等信号,T2WI为高信号[14]。鉴于该病可累及于全身各部位,PET-CT是一种非常有效的辅助诊疗手段,可用于辅助临床明确RDD的累及范围,是RDD的疾病分期、疗效及随访评估的重要辅助检查[15]。影像学上易与朗格汉斯细胞组织细胞增生症、嗜酸性肉芽肿或其他淋巴细胞增生性疾病相混淆[16-17]。本例患者X线检查提示右胫骨上段低密度影、边界不清、骨皮质变薄、边缘毛糙;MRI提示病灶范围呈T1WI等信号,T2WI高信号,增强后环形强化,符合文献报道。患者PET-CT提示患者只有胫骨出现病灶,其余地方无累及,结合病理结果考虑为结外孤立性病灶。
2.3 病理特征及免疫组化目前诊断RDD的金标准是病理学特征及免疫组化。RDD在镜下特征性改变为组织细胞样细胞弥漫性增生,胞质空泡内的淋巴细胞在组织细胞的细胞核周围呈花环样排列,称为emperipolesis现象或伸入运动[18]。免疫组织化学染色中,有助于与朗格汉斯细胞组织细胞增生症等疾病相鉴别的是S-100蛋白阳性、CD-68阳性和CD-1a阴性,但有研究表明部分RDD患者中出现CD-1a弱阳性且CD-68阴性[19],因此S-100蛋白阳性在诊断上是可能更具有准确性及特征性。本病例患者通过病理检查及免疫组化可见大量组织细胞样细胞增生,淡染区与深染区交替分布,浅染区由大量增生的组织细胞样细胞构成,伴中性粒细胞、浆细胞及淋巴细胞浸润。免疫组化:S-100阳性,CD68阳性,CD163阳性,IgG阳性,IgG4阳性,CD1a阴性,诊断为RDD。
2.4 鉴别诊断本病例中的骨骼系统RDD,因其影像学表现与骨骼肌系统肿瘤、增生病变相似,需与以下疾病鉴别:(1)朗格汉斯组织细胞增生症(langerhans cell histiocytosis,LCH),影像学与RDD相似,主要依靠病理检查及免疫组化鉴别。镜下LCH以朗格汉斯细胞增生为主,无伸入运动,S-100蛋白与特异性标志物CD1a阳性,电镜检查可见Birbeck颗粒[20]。(2)Erdheim-Chester病,组织学特征是病变主要由泡沫组织细胞和Touton巨细胞组成,免疫组织化学与RDD相似,但影像学表现特殊,为双侧长骨对称的斑块状或弥漫性的髓腔硬化,无边界,并且常累及全身多个器官[21]。(3)嗜酸性肉芽肿,又称局限性朗格汉斯细胞组织细胞增生症,常见的部位是股骨,其次是肱骨和胫骨,X线和CT均显示表现为溶骨性破坏并伴有边缘硬化,边界清楚,晚期可见骨皮质增厚,骨质硬化,骨膜反应呈层状或葱皮样。实验室检查可见嗜酸性粒细胞或白细胞明显增高,病理检查无emperipolesis现象[22]。(4)慢性骨髓炎,好发于胫骨和股骨,起病缓慢,以红肿、疼痛及窦道形成为主。影像学主要表现为非特异性骨膜反应、骨质破坏、髓腔内死骨形成和骨包壳[23]。(5)骨肉瘤,好发于儿童青少年干骺端,临床表现为局部疼痛、肿块,夜间痛明显,X线主要特性表现为骨质破坏、软组织块形成、骨膜反应和Codman三角等,确诊靠病理学检查和免疫组化[24]。(6)孤立性浆细胞瘤,好发于中老年患者,且胫骨是浆细胞瘤的罕见部位之一,胫骨X线显示广泛的骨质破坏,可见Codmann三角和骨膜反应,骨髓穿刺和活检可确诊该病[25]。(7)骨转移癌,患者一般有原发肿瘤,转移部位最常见为长骨如股骨和肱骨,影像学上多表现为多发或单发小的虫蚀样溶骨性破坏,可形成大片骨质破坏区,易导致病理性骨折发生,一般无骨膜增生[26]。(8)骨巨细胞瘤,好发年龄为20~40岁,主要病变部位在骨骺已闭合的四肢长骨骨端,以股骨下端和胫骨上端最为常见,主要表现为局部疼痛、肿胀和病理性骨折,典型X线表现为偏心性、肥皂泡样膨胀性骨质破坏[27]。(9)骨淋巴细胞瘤,多发生于45~60岁,男性发病率略高于女性,主要表现为局部的疼痛和肿胀。在X线和CT上常见溶骨性骨质破坏、病理性骨折等。大多数病例诊断为弥漫性大B细胞淋巴瘤,少数为滤泡性淋巴瘤,流式细胞显示B细胞标志物包括CD45、CD20、CD21、CD45和CD79a呈阳性[28]。
2.5 治疗方法及随访RDD属于良性组织细胞增生性疾病,部分患者可自愈。当RDD未累及重要组织、器官和系统或未出现临床症状时,可暂时给予观察和定期随访[29]。伴有症状的骨骼肌系统RDD可采用手术直接切除、病灶刮除术以及刮除术结合放疗、化疗等方法治疗,对于孤立性病灶主要以手术切除为主。糖皮质激素、免疫抑制剂、化疗及靶向药物主要用于患者进行全身治疗[30-31]。RDD患者手术后愈合情况大多良好,极少复发。本病例中患者采用“右胫骨开窗引流术并术中冰冻病理活检+右胫骨清创缝合术”后,随访2个月,患者未诉右侧胫骨不适,术后2个月复查右侧胫腓骨X线,无复发征象。
2.6 小结骨骼肌系统RDD的临床表现及影像学均无明确特异性,易与多种疾病相混淆,结合临床表现及多种影像学检查手段不能排除本病,本案例中由开始诊断局限性慢性骨髓炎,到术后病理确诊为孤立性RDD,提醒我们遇到胫骨病变时,需考虑此病的存在。最终确诊须依靠病理学检测与免疫组化,镜下特征性的Emperipolesis现象以及免疫组化中S-100、CD68阳性和CD1a阴性。对于需要治疗的患者,手术切除或者病灶刮除是治疗的主要方法,且预后良好。
