寒痹康汤通过Notch调控PI3K/Akt/mTOR信号通路及调节T细胞糖代谢治疗RA的作用机制研究
2023-01-18庞学丰韦夏惠黄政治冯玉青吴燕红王思思廖家瑜李玉玲
庞学丰,林 菊,韦夏惠,黄政治,冯玉青,吴燕红,王思思,廖家瑜,李玉玲
(广西中医药大学附属瑞康医院,广西 南宁 530011)
类风湿关节炎(rheumatoid arthritis,RA)是一种难以治愈的慢性自身免疫性疾病,其致残率高,未经系统治疗者后期常出现关节畸形和功能丧失,迄今为止仍无根治性药物[1]。RA的发生、发展涉及包括PI3K/Akt信号通路在内的多种信号通路。研究表明糖代谢影响T细胞的功能,与RA的发病密切相关。甲氨蝶呤治疗RA效果明显,二甲双胍对RA模型小鼠关节症状具有改善作用,也具有治疗RA的功效[2]。本研究采用CⅡ乳剂进行皮下注射诱导胶原诱导性关节炎(CIA)大鼠模型,分别予不同剂量的寒痹康汤提取物药液进行灌胃,并与甲氨蝶呤、二甲双胍进行对照,观察寒痹康汤通过Notch调控PI3K/Akt/mTOR信号通路,进而调节T细胞糖代谢的变化情况。
1 实验材料
1.1 动物清洁级Wistar雌性大鼠140只,体质量为(100±10)g,购于长沙市天勤生物技术有限公司[动物许可证号SCXK(湘)2019-0013],放置于广西中医药大学动物实验中心进行喂养。
1.2 试药本研究造模所用的弗氏不完全佐剂和牛Ⅱ型胶原蛋白从美国Chondrex公司购买;甲氨蝶呤片(国药准字H22022674)为通化茂祥制药有限公司产品;二甲双胍片(国药准字H13021647)为河北天成药业股份有限公司产品;寒痹康汤提取物由我院新药研发中心制备成浸膏,按照本实验的设计要求,于大鼠灌胃时,临用前将浸膏加入溶液(由乙醇和生理盐水按比例组成)中进行溶解,配制成实验所需浓度为2×10-7g/L的溶液。
1.3 试剂单克隆抗体Notch1蛋白(Cell Signaling Technology);单克隆抗体Hes1蛋白(武汉博士德生物工程有限公司,批号:BST17494488);单克隆抗体Jagged1蛋白[赛默飞世尔科技(中国)有限公司,批号:XF3828084];单克隆抗体PI3K蛋白(批号:10016961)、单克隆抗体Akt蛋白(批号:10022173)、单克隆抗体mTOR蛋白(批号:10018370)、单克隆抗体β-肌动蛋白(β-actin,批号:10024215)、单克隆抗体Glut1蛋白(批号:21829-1-AP)、单克隆抗体c-Myc蛋白(批号:10828-1-AP)均购于武汉三鹰生物技术有限公司;单克隆抗体HIF1蛋白(Affinity Biosciences,货号:70h9774);多克隆抗体己糖激酶(HK,批号:00107731)、多克隆抗体葡萄糖激酶(GK,批号:00023801)和多克隆抗体磷酸果糖激酶(PFK,批号:00082470)均购于武汉三鹰生物技术有限公司;逆转录试剂盒:thermo scientific RevertAid First Strand cDNA Synthesis Kit[赛默飞世尔科技(中国)有限公司,批号:01182505];上机试剂盒:Hieff qPCR SYBR Green Master Mix[翌圣生物科技(上海)股份有限公司,批号:H2102161]。
1.4 主要仪器328041H01型超低温冰箱(Thermo Fisher Scientific);JXFSTPRP-CL型全自动样品冷冻研磨仪(上海净信实业发展有限公司);高速冷冻离心机(Thermo Fisher Scientific);全波长酶标仪(BioTek Instruments);五段程控金属浴(天根生化科技有限公司);BIO-RAD电泳仪(Mini-Protean Tetra Cell);WI53711型超微量分光光度计(Thermo Fisher Scientific);荧光定量PCR仪(LightCycler 96 Instrument);Amersham ImageQuant 800型超灵敏多功能成像仪(ChemiDoc MP);2J3181型荧光正置显微镜(Olympus BX53F)。
2 实验方法
2.1 造模及分组将140只清洁级Wistar雌性大鼠置于专用饲养笼中进行喂养,观察其适应性饲养7 d后无异常,随机选取出20只作为空白组,剩余的120只大鼠则参照文献[3]中的方法给予注射CⅡ乳剂进行造模:将弗氏不完全佐剂和牛Ⅱ型胶原蛋白按实验配制方法充分混匀,制成符合标准的CⅡ乳剂(混匀后液体滴入水中呈油包水状)并保存于4℃冰箱备用。在进行大鼠造模时,分别在大鼠的颈部和背部注射0.2 ml的CⅡ乳剂,间隔14 d后再次按照此前的注射方法和剂量进行注射1次。按照文献[3]的标准对造模是否成功进行判断,造模成功的判断标准:大鼠四肢的足爪已经出现严重肿胀,并且踝关节直径经测量发现其增长幅度≥2 mm者,则评为4分,≥4分则表明造模成功。由本研究组两位成员进行观察判断,并进行详细记录。造模成功后,再通过随机数字表法分为模型组、甲氨蝶呤组、二甲双胍组、寒痹康汤提取物低剂量组、寒痹康汤提取物中剂量组、寒痹康汤提取物高剂量组,每组20只。本实验研究按实验动物伦理学的相关要求处理所用大鼠。
2.2 给药按实验要求进行,模型组大鼠按20 ml/kg予生理盐水进行灌胃,每天1次;甲氨蝶呤组大鼠灌服浓度为13.5 mg/kg的甲氨蝶呤药液,每周1次;二甲双胍组予1.35 g/kg浓度的二甲双胍药液进行灌胃,每天2次;而寒痹康汤提取物低、中、高剂量组大鼠分别灌胃给予不同剂量的寒痹康汤提取物(28.13 g/kg、56.25 g/kg、112.5 g/kg),每天2次;低、中、高剂量根据文献[4]进行计算得出:即按70 kg人体质量与200 g大鼠的换算系数进行计算。空白组大鼠则任其自由饮水、进食与活动。
2.3 标本采集和相关指标的检测给药治疗36 d后,各组大鼠均用水合氯醛进行麻醉,充分麻醉后于无菌条件下采集大鼠膝关节滑膜,其中一部分立即放入冻存管并置于液氮罐保存,后移置于-80℃冰箱保存,留待以RT-PCR、Western blot法进行相关指标检测;另取一部分置于10%中性福尔马林液浸泡保存,留待以免疫组织化学法检测相关指标,所有检测均按照试剂盒说明按步骤进行。
2.4 RT-PCR法检测各组大鼠滑膜组织Notch1、Hes1、Jagged1、PI3K、Akt、mTOR及Glut1、HIF1、c-Myc mRNA的基因表达取各组大鼠滑膜组织分别放入1.5 ml离心管,加入无酶研磨珠及1 ml Trizol溶液,置低温研磨机中研磨3 min。将研磨好的组织匀浆取出后室温静置10 min,离心(4℃,12 000 rpm)5 min。再加入200 μl的Buffer EX,快速颠倒混匀,室温静置3 min。离心(4℃,12 000 rpm)15min,用移液枪吸取中上层水相约450 μl至新的1.5 ml离心管中。加入同体积预冷的异丙醇,室温静置10 min。离心(4℃,12 000 rpm)10 min,弃上清液。加入1 ml预冷的75%乙醇(无菌无酶水配制)洗涤沉淀。离心(4℃,7 500 rpm)5 min,弃去上清液,室温静置10 min以去除残余乙醇。加入20 μl的无菌无酶水溶解Total-RNA,用超微量分光光度计检测RNA浓度及纯度。Notch1、Hes1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF1、c-Myc特异性引物设计及合成根据NCBI GenBank已公布的大鼠Notch1、Hes1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF、c-Myc和GAPDH、cDNA序列,利用PrimerPremier 5.0软件分别设计10对特异性引物,交由上海捷瑞生物工程有限公司合成,合成引物序列见表1。

表1 合成引物序列表
2.5 Western blot法检测各组大鼠滑膜组织Notch1、Hes1、Jagged1、PI3K、Akt、mTOR及Glut1、HIF1、c-Myc的蛋白表达取各组大鼠的滑膜组织样本,分别放入预先加入PMSF的RIPA裂解液中进行提取滑膜组织中的总蛋白,通过BCA蛋白浓度测定试剂盒测定总蛋白浓度后,加入蛋白上样缓冲液,在100℃条件下变性;分别使用7.5%和10%PAGE凝胶电泳分离等量的总蛋白质(电压80~120 v,90 min),然后在低温条件下电转移到聚偏二氟乙烯膜上(电流350 mA,50~150 min);在室温下使用无蛋白快速封闭液将膜浸润10 min;使用1×TBST溶液洗膜后分别使用相应蛋白的一抗、β-actin一抗(稀释比例均为1∶5 000)于4℃孵育12 h;TBST洗膜后加入HRP标记的山羊抗兔/大鼠IgG二抗(稀释比例1∶5 000)于室温孵育1 h;膜上加入超灵敏化学ECL检测试剂盒中1∶1的A、B液避光反应1 min后,使用超灵敏多功能成像仪将膜显影成像。使用Image J软件测定各蛋白条带的灰度值,以β-actin作为内参检测各蛋白的表达水平。
2.6 免疫组化法检测各组大鼠滑膜组织HK、GK、PFK蛋白表达取10%中性福尔马林液固定的大鼠膝关节滑膜组织,常规石蜡包埋切片,常规脱蜡脱水,PBS液浸泡,一抗孵育过夜,PBS冲洗,标记二抗,缓冲液冲洗后DAB显色,纯水充分冲洗,复染,脱水,透明干燥,封片。光镜下拍摄免疫组化染色图片,采用Image Pro Plus 6.0图像分析软件进行半定量分析,将图片灰度值转换成光密度值,通过测量检测区域的面积(Area)、累积光密度(integrated optical density,IOD),计算平均光密度(mean optical density,MOD)值,MOD=IOD/Area,MOD值作为滑膜组织的蛋白表达量。
2.7 统计分析所有数据统计分析采用Image J软件读取蛋白条带灰度值,以灰度值作为蛋白的表达量,然后计算蛋白的相对表达量,采用GraphPad Prism 9.4.1统计软件进行分析及制图。P<0.05表示差异有统计学意义。
3 结果
3.1 RT-PCR法检测治疗前后各组大鼠滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1、c-Myc基因表达情况与空白组比较,模型组大鼠滑膜中Notch1、Hes1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF1、c-Myc的基因表达水平均显著升高(P<0.05);治疗后,与模型组比较,甲氨蝶呤、二甲双胍及寒痹康汤提取物低、中、高剂量组Notch1、Hes1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF1、c-Myc基因的表达水平均下降(P<0.05);寒痹康汤提取物低、中、高剂量组与甲氨蝶呤、二甲双胍组比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠膝关节滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1和c-Myc基因表达比较(±s)
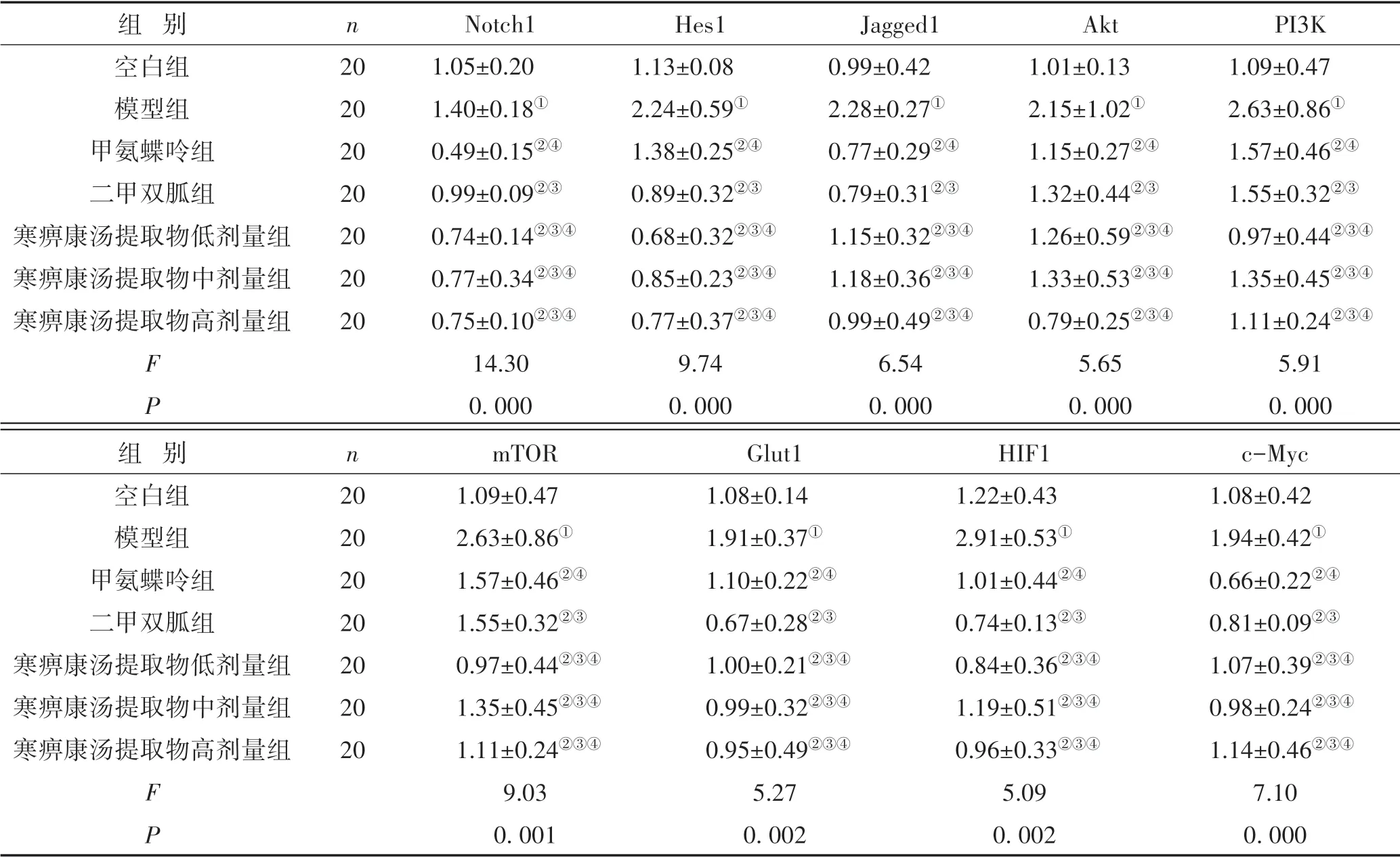
表2 各组大鼠膝关节滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1和c-Myc基因表达比较(±s)
注:与空白组比较,①P<0.05;与模型组比较,②P<0.05;与甲氨蝶呤组比较,③P>0.05;与二甲双胍组比较,④P>0.05;所有比较均经过Bonferroni校正
组 别空白组模型组甲氨蝶呤组二甲双胍组寒痹康汤提取物低剂量组寒痹康汤提取物中剂量组寒痹康汤提取物高剂量组FP n 20 20 20 20 20 20 20 Notch1 1.05±0.20 1.40±0.18①0.49±0.15②④0.99±0.09②③0.74±0.14②③④0.77±0.34②③④0.75±0.10②③④14.30 0.000 Hes1 1.13±0.08 2.24±0.59①1.38±0.25②④0.89±0.32②③0.68±0.32②③④0.85±0.23②③④0.77±0.37②③④9.74 0.000 Jagged1 0.99±0.42 2.28±0.27①0.77±0.29②④0.79±0.31②③1.15±0.32②③④1.18±0.36②③④0.99±0.49②③④6.54 0.000 Akt 1.01±0.13 2.15±1.02①1.15±0.27②④1.32±0.44②③1.26±0.59②③④1.33±0.53②③④0.79±0.25②③④5.65 0.000 PI3K 1.09±0.47 2.63±0.86①1.57±0.46②④1.55±0.32②③0.97±0.44②③④1.35±0.45②③④1.11±0.24②③④5.91 0.000组 别空白组模型组甲氨蝶呤组二甲双胍组寒痹康汤提取物低剂量组寒痹康汤提取物中剂量组寒痹康汤提取物高剂量组FP n 20 20 20 20 20 20 20 mTOR 1.09±0.47 2.63±0.86①1.57±0.46②④1.55±0.32②③0.97±0.44②③④1.35±0.45②③④1.11±0.24②③④9.03 0.001 Glut1 1.08±0.14 1.91±0.37①1.10±0.22②④0.67±0.28②③1.00±0.21②③④0.99±0.32②③④0.95±0.49②③④5.27 0.002 HIF1 1.22±0.43 2.91±0.53①1.01±0.44②④0.74±0.13②③0.84±0.36②③④1.19±0.51②③④0.96±0.33②③④5.09 0.002 c-Myc 1.08±0.42 1.94±0.42①0.66±0.22②④0.81±0.09②③1.07±0.39②③④0.98±0.24②③④1.14±0.46②③④7.10 0.000
3.2 Western blot法检测治疗前后各组大鼠滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1、c-Myc蛋白表达情况与空白组比较,模型组大鼠滑膜中Notch1、Hes1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF1、c-Myc的蛋白表达水平均显著升高(P<0.05);治疗后,与模型组比较,甲氨蝶呤、二甲双胍及寒痹康汤提取物低、中、高剂量组Notch1、Hes 1、Jagged1、PI3K、Akt、mTOR、Glut1、HIF1、c-Myc蛋白的表达水平均下降(P<0.05);寒痹康汤低、中、高剂量组与甲氨蝶呤、二甲双胍组比较,差异无统计学意义(P>0.05)。见图1、表3。

图1 各组大鼠滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1、c-Myc蛋白表达条带图
表3 各组大鼠膝关节滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1和c-Myc蛋白表达比较(±s)
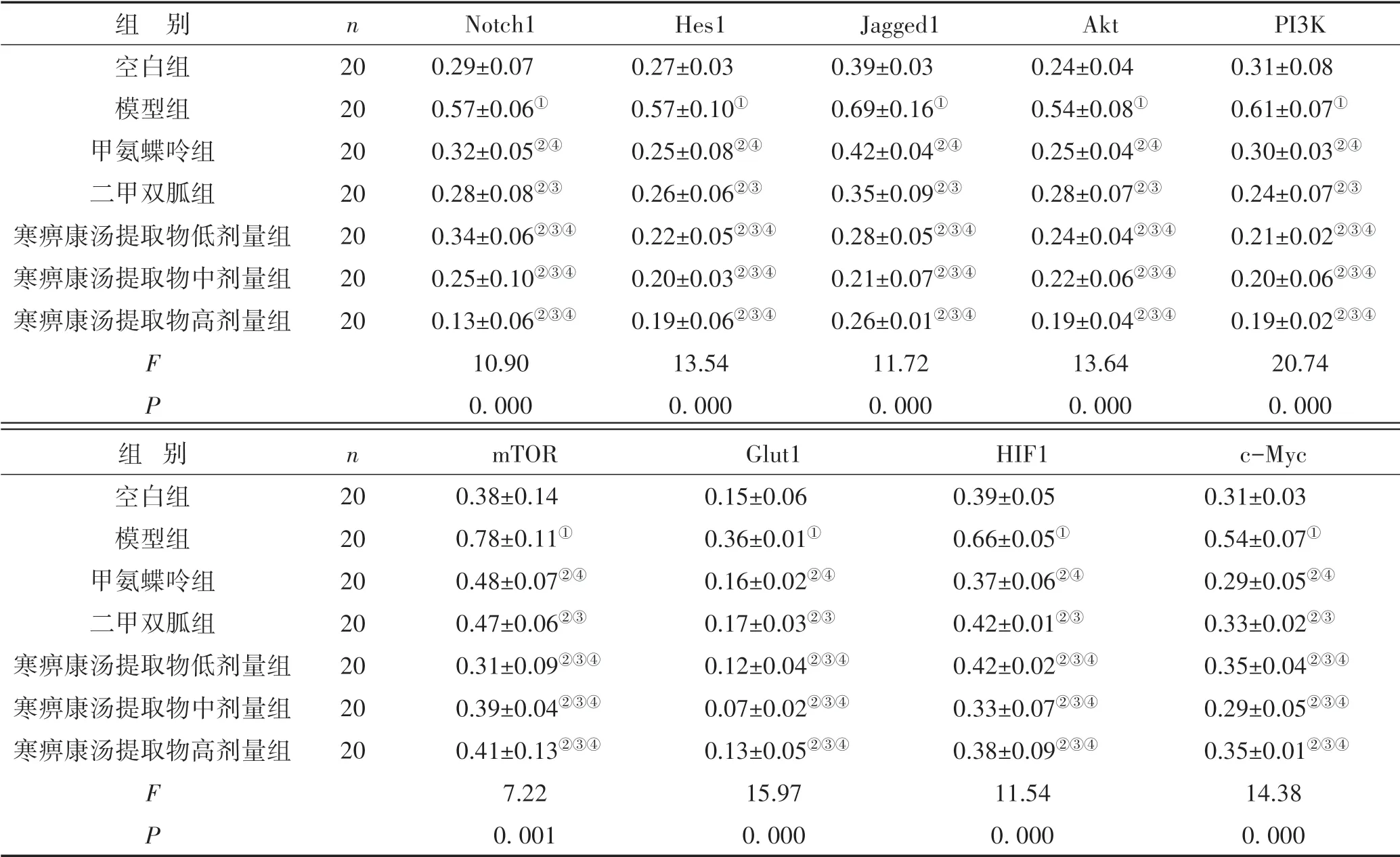
表3 各组大鼠膝关节滑膜组织Notch1、Hes1、Jagged1、Akt、PI3K、mTOR、Glut1、HIF1和c-Myc蛋白表达比较(±s)
注:与空白组比较,①P<0.05;与模型组比较,②P<0.05;与甲氨蝶呤组比较,③P>0.05;与二甲双胍组比较,④P>0.05;所有比较均经过Bonferroni校正
组 别空白组模型组甲氨蝶呤组二甲双胍组寒痹康汤提取物低剂量组寒痹康汤提取物中剂量组寒痹康汤提取物高剂量组FP n 20 20 20 20 20 20 20 Notch1 0.29±0.07 0.57±0.06①0.32±0.05②④0.28±0.08②③0.34±0.06②③④0.25±0.10②③④0.13±0.06②③④10.90 0.000 Hes1 0.27±0.03 0.57±0.10①0.25±0.08②④0.26±0.06②③0.22±0.05②③④0.20±0.03②③④0.19±0.06②③④13.54 0.000 Jagged1 0.39±0.03 0.69±0.16①0.42±0.04②④0.35±0.09②③0.28±0.05②③④0.21±0.07②③④0.26±0.01②③④11.72 0.000 Akt 0.24±0.04 0.54±0.08①0.25±0.04②④0.28±0.07②③0.24±0.04②③④0.22±0.06②③④0.19±0.04②③④13.64 0.000 PI3K 0.31±0.08 0.61±0.07①0.30±0.03②④0.24±0.07②③0.21±0.02②③④0.20±0.06②③④0.19±0.02②③④20.74 0.000组 别空白组模型组甲氨蝶呤组二甲双胍组寒痹康汤提取物低剂量组寒痹康汤提取物中剂量组寒痹康汤提取物高剂量组FP n 20 20 20 20 20 20 20 mTOR 0.38±0.14 0.78±0.11①0.48±0.07②④0.47±0.06②③0.31±0.09②③④0.39±0.04②③④0.41±0.13②③④7.22 0.001 Glut1 0.15±0.06 0.36±0.01①0.16±0.02②④0.17±0.03②③0.12±0.04②③④0.07±0.02②③④0.13±0.05②③④15.97 0.000 HIF1 0.39±0.05 0.66±0.05①0.37±0.06②④0.42±0.01②③0.42±0.02②③④0.33±0.07②③④0.38±0.09②③④11.54 0.000 c-Myc 0.31±0.03 0.54±0.07①0.29±0.05②④0.33±0.02②③0.35±0.04②③④0.29±0.05②③④0.35±0.01②③④14.38 0.000
3.3 免疫组织化学法检测治疗前后各组大鼠滑膜组织HK、GK、PFK蛋白表达情况与空白组比较,模型组大鼠滑膜中HK、GK和PFK的蛋白达水平均显著升高(P<0.05);治疗后,与模型组比较,甲氨蝶呤、二甲双胍及寒痹康汤提取物低、中、高剂量组HK、GK和PFK蛋白的表达水平均下降(P<0.05);寒痹康汤提取物低、中、高剂量组与甲氨蝶呤、二甲双胍组比较,差异无统计学意义(P>0.05)。见图2、表4。

图2 各组大鼠滑膜组织免疫组织化学染色结果(苏木素色,×200,棕黄色代表阳性表达颗粒),标尺=50μm
表4 各组大鼠膝关节滑膜组织HK、GK和PFK蛋白表达比较 (±s)
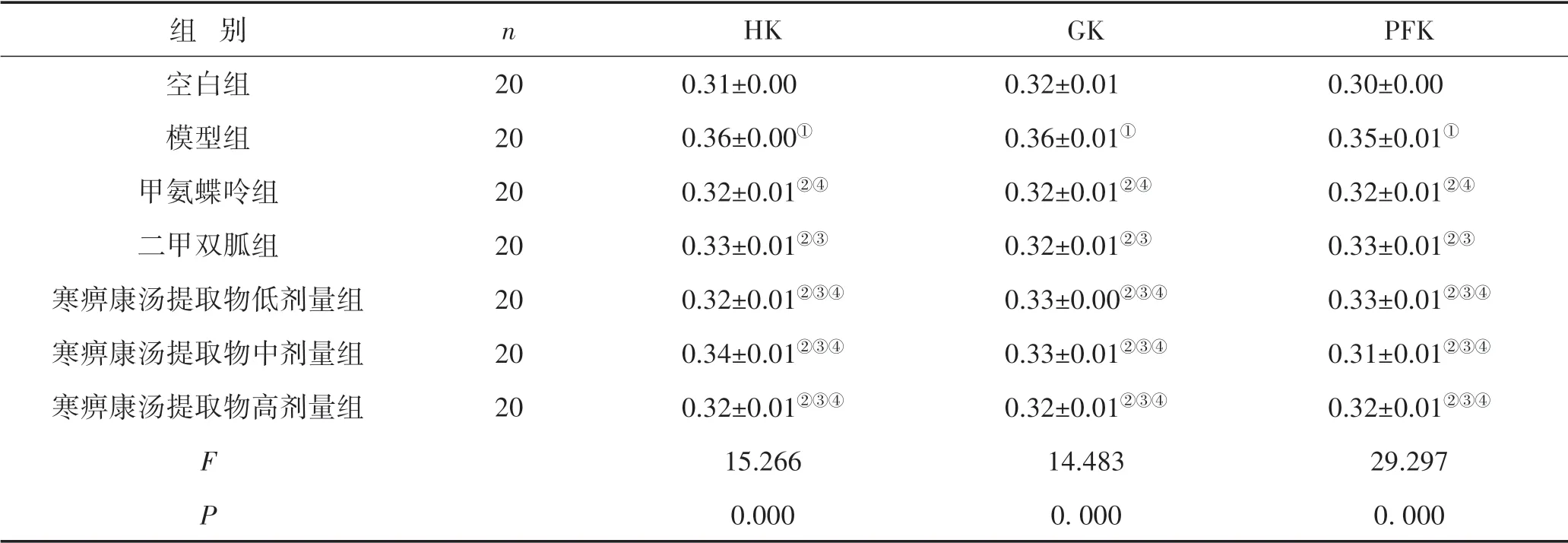
表4 各组大鼠膝关节滑膜组织HK、GK和PFK蛋白表达比较 (±s)
注:与空白组比较,①P<0.05;与模型组比较,②P<0.05;与甲氨蝶呤组比较,③P>0.05;与二甲双胍组比较,④P>0.05;所有比较均经过Bonferroni校正
组 别空白组模型组甲氨蝶呤组二甲双胍组寒痹康汤提取物低剂量组寒痹康汤提取物中剂量组寒痹康汤提取物高剂量组FP n 20 20 20 20 20 20 20 HK 0.31±0.00 0.36±0.00①0.32±0.01②④0.33±0.01②③0.32±0.01②③④0.34±0.01②③④0.32±0.01②③④15.266 0.000 GK 0.32±0.01 0.36±0.01①0.32±0.01②④0.32±0.01②③0.33±0.00②③④0.33±0.01②③④0.32±0.01②③④14.483 0.000 PFK 0.30±0.00 0.35±0.01①0.32±0.01②④0.33±0.01②③0.33±0.01②③④0.31±0.01②③④0.32±0.01②③④29.297 0.000
4 讨论
中医学把RA归属于“痹病”“尪痹”等范畴,认为其发病的内因是人体正气亏虚,外因是风寒湿之邪内袭,扶正祛邪为其基本治则,临床上应在此基础上进行辨证论治以及随症加减用药。寒痹康汤是笔者治疗RA的临床经验方,由秦艽、黄芪、防风、熟附子、麻黄、当归、青风藤、淫羊藿、狗脊组成,内含补肾和抗风湿药;课题组成员多年来开展了寒痹康汤治疗寒湿型RA的临床研究,结果表明其副作用少、疗效较显著[5]。
RA的病因迄今未明,其发生、发展过程以及出现的骨质破坏和由此破坏产生的功能障碍,存在多种信号通路和炎性因子的共同参与,其中PI3K/Akt/mTOR信号通路在其中发挥着重要的作用。PI3K是一种胞内磷脂酰肌醇激酶,其由调节亚基PIK3R、p85及催化亚基PIK3C、pIIO等共同组成,这些酶与下游的Akt和mTOR在细胞分化、代谢、存活和增殖过程中起到重要的作用[6]。Liu等[7]研究提示,酒精可激活PI3K/Akt/mTOR信号通路的下游分子P70S6K,下调Runx2,减少骨髓间充质干细胞(BMMSCs)的成骨分化,上调过氧化物酶增殖物激活受体γ(PPARγ),增加BMMSCs的成脂分化,从而引起骨质疏松。研究发现PI3K/Akt通路在RA滑膜细胞中广泛存在并处于异常激活的状态,并且与RA患者的成纤维样滑膜细胞(FLS)凋亡异常密切相关[8]。进一步的研究证实,RA患者的滑膜细胞中存在Akt过度表达,PI3K可以活化Akt,而Akt能磷酸化多种靶蛋白产生抑制细胞凋亡的效应;抑制异常活化的PI3K/Akt通路可以诱导RA患者FLS的凋亡,从而起到显著的治疗RA作用。
研究结果证实不同的淋巴细胞在RA中具有不同的功能,现在已经明确了辅助性淋巴细胞(helper T cells,Th)-1、Th17等T细胞在RA的发病中起到重要作用。研究表明,糖代谢可影响T细胞的功能,与RA的发病密切相关,而糖代谢紊乱与RA的发病具有密切的联系,在RA的滑膜组织和血浆中,葡萄糖转运体1(glucose transporter 1,Glut1)和糖酵解活性均有提高[9-11]。在RA滑膜组织和血浆中,醛缩酶、烯醇化酶、磷酸己糖异构酶及葡萄糖6磷酸酶等代谢失调可以诱导免疫细胞的活化和一些炎症因子(如IL-17、TNF-α、IFN-γ)、自身抗体的产生,造成慢性炎症反应以及骨质破坏[12-13]。RA中T细胞的分化增殖与糖代谢也具有密切的联系,Th17细胞分化需要IL-6刺激,IL-6能够活化mTOR,进而导致缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)和糖酵解关键酶的过表达,糖酵解增强,表明上调T细胞糖酵解活性是Th17细胞分化的关键[14]。
转录因子c-Myc(c-Myc)能够促进T细胞的活化,并且能够激活糖酵解中的关键酶,缺乏c-Myc的T细胞中多种糖酵解关键酶水平下降,从而阻碍了T细胞的生长和繁殖[15]。Glut1是c-Myc的一个重要靶点,静息状态下T细胞中Glut1的表达水平较低,活化的T细胞通过丝氨酸-苏氨酸蛋白激酶(serine-threonine kinase,Akt)途径迅速转录,使糖酵解加速,增加了己糖激酶(hex-okinase,HK)和磷酸果糖激酶(phosphofruetokinase,PFK)的活性。葡萄糖激酶(GK)是HK家族的一种亚型,是人体内唯一可以作为葡萄糖传感器的HK,而HK是细胞内葡萄糖摄取和利用过程中不可缺少的关键酶,是维持促进葡萄糖进入细胞所需的梯度浓度的重要因素。所以说Glut1是支持效应T细胞功能的关键酶。Macintyre等[16]研究发现Glut1是T细胞活化的关键,Glut1的缺乏可以导致效应T细胞的分化受限。
Akt的下游基因是哺乳动物雷帕霉素靶点(mTOR),而mTOR信号通路能上调氨基酸转运载体的表达,并且能激活糖酵解途径[17-18]。已有资料指出,Notch可以诱导PI3K/Akt通路的激活,而此通路对糖代谢和有氧糖酵解的调控作用是已经明确且被领域所公认[19]。Maekawa等[19]报道Glut1参与调控记忆性CD4+T细胞的免疫活性,Akt磷酸化水平的降低导致Glut1的低表达,而Akt磷酸化水平受Notch调控,因此Notch信号通路可能参与了调控记忆性CD4+T细胞的免疫功能。Notch信号通路调节成骨细胞和破骨细胞的分化与功能,从而参与了骨重建过程[21]。应用Notch信号通路调节剂介导骨生成可以治疗骨质疏松等骨病[22]。
甲氨蝶呤治疗RA疗效明确,是公认的锚定药和临床常用药,且常被选为实验研究的对照组用药。二甲双胍治疗RA获得较好效果的研究时有报导,如Fan等[23]通过实验研究发现二甲双胍通过抑制小鼠全身炎症和滑膜炎,进而抑制软骨层基质降解、破骨细胞形成以及软骨细胞凋亡,从而达到骨保护作用。郑魏等[24]在临床研究中发现二甲双胍能够促进RA患者外周血CD4+T淋巴细胞中Treg细胞增长,降低Th17/Treg比值并维持平衡状态,能缓解患者病情,其副作用少、安全性高。基于对以上理论和研究进展的认识和了解,我们开展了寒痹康汤治疗RA的研究,并选择甲氨蝶呤和二甲双胍作为对照药物,观察寒痹康汤提取物对CIA大鼠有关指标的影响,并与两个对照药物进行比较。
本实验观察寒痹康汤提取物对CIA大鼠相关指标的影响,研究结果表明寒痹康汤能通过Notch调控PI3K/AKT/mTOR信号通路,从而调节T细胞糖代谢达到治疗RA的作用,此为寒痹康汤提取物治疗RA的机制之一。
