离线和在线固相萃取-液相色谱-质谱法测定污水中5种芬太尼类物质及其代谢物
2023-01-18张婷婷花镇东
张婷婷, 黄 钰, 丁 艳, 陈 捷, 花镇东
(公安部禁毒情报技术中心,毒品监测管控与禁毒关键技术公安部重点实验室,北京 100193)
近年来,合成阿片类物质在世界范围内的滥用呈显著上升趋势[1,2],与吗啡、海洛因等天然和半合成阿片类物质相比,该类物质不依赖植物种植,制造更为容易,品种层出不穷,为此国际麻醉品管制局已专门设立OPIOIDS Project项目[3],对其生产和分销情况进行监测。芬太尼类物质是合成阿片类物质中的一个重要类别,作为强效麻醉镇痛剂在医疗中发挥重要作用的同时,也出现了严重的滥用情况,特别是在阿片类物质成瘾人群比例较高的北美地区[4,5],已成为药物滥用致死的主要因素。为预防该类物质可能产生的社会危害,我国已于2019年5月1日起将芬太尼类物质整类列入《非药用类麻醉药品和精神药品管制品种增补目录》。
由于吸毒行为的隐蔽性,毒品滥用监测一直是禁毒工作的重点和难点问题。近期逐步发展起来的基于污水流行病学原理的毒情监测技术具有客观、定量、实时、快速和简便等优点,我国[6]及欧洲[7 - 9]、加拿大[10]、澳大利亚[11,12]等国家和地区已广泛采用该方法监测可卡因、大麻、海洛因、冰毒、摇头丸和氯胺酮等常见毒品的滥用情况。然而,芬太尼及其类似物作为新近流行的毒品,污水中相关原体及代谢物的检测方法尚未建立,限制污水检测技术在其滥用情况监测中的应用。为此,本研究以芬太尼类物质中最为常见的芬太尼(Fentanyl)和乙酰芬太尼(Acetyl fentanyl)为对象,建立了污水中2种物质原型及3种主要代谢物去苯乙基芬太尼(Norfentanyl)、去苯乙基乙酰芬太尼(Acetyl norfentanyl)和4-苯胺基-N-苯乙基哌啶(4-ANPP)的离线和在线固相萃取检测方法(化学结构见图1),并将其用于全国大型城市生活污水样品的检测,为了解芬太尼类物质的实际滥用情况提供了新的思路和手段。

图1 5种目标化合物化学结构图Fig.1 Chemical structures of five target compounds
1 实验部分
1.1 仪器及试剂
超高效液相色谱-三重四极杆质谱仪(ACQUITY UPLC,Waters,美国;Triple QuadTM6500,SCIEX,美国);配备在线固相萃取AOE模块的超高效液相色谱-三重四极杆质谱仪(LCMS-8050,SHIMADZU,日本);全自动固相萃取仪(SPE-432,北京普立泰科仪器有限公司);真空离心浓缩仪(CV200,北京吉艾姆科技有限公司);超纯水装置(Milli-Q advantage A10,Merck,德国);固相萃取柱Oasis®PRiME HLB柱和Oasis®PRiME MCX柱(60 mg,3CC,Waters,美国)。
甲醇和乙腈(均为HPLC级)购自Fisher Scientific(美国);氨水(HPLC级,含量大于25%)购自上海安谱实验科技股份有限公司;芬太尼,去苯乙基芬太尼,乙酰芬太尼,去苯乙基乙酰芬太尼,4-苯胺基-N-苯乙基哌啶(4-ANPP),芬太尼-D5,去苯乙基芬太尼-D5,乙酰芬太尼-13C6,去苯乙基乙酰芬太尼-13C6,4-苯胺基-N-苯乙基哌啶-D5(4-ANPP-D5)标准物质溶液(溶剂均为甲醇,浓度100 μg/mL)均购自Cerilliant(美国)。
1332份污水样品来自国家禁毒办污水监测项目,于2020年第2季度采集自全国125个城市的生活污水处理厂,混合空白污水基质使用10份来自不同城市的空白污水样品混合制成。
1.2 离线固相萃取分析方法
1.2.1 样品处理污水样品用浓HCl调节pH至小于2,加入混合内标溶液使各同位素内标浓度为50 ng·L-1,玻璃纤维滤膜过滤后移取50 mL滤液,以1 mL·min-1流速加载至PRiME MCX固相萃取柱中,甲醇4 mL淋洗后真空抽固相萃取柱至干燥,再用含5%氨水/甲醇溶液(体积比5∶95)4 mL洗脱,洗脱液使用真空浓缩仪于45 ℃浓缩至干,加入0.1%甲酸水溶液250 μL复溶,0.2 μm滤膜过滤后供仪器检测。使用PRiME HLB固相萃取柱的实验条件与上述基本相同,不同之处在于污水样品pH值调节至7,上样后使用纯水淋洗,洗脱液为甲醇。
1.2.2 超高效液相色谱-三重四极杆质谱仪分析条件色谱柱:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相:A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液;流速:0.4 mL·min-1;洗脱梯度程序:0.0~6.0 min(5%~25%B),6.0~9.0 min(25%~50%B),9.0~9.2 min(50%B~100%B),9.2~11.0 min(100%B),11.0~11.2 min(100%~5%B),11.2~14.0 min(5%B);柱温:40 ℃;进样量:5 μL。质谱分析:电喷雾离子源正离子模式(ESI+);毛细管电压:3 kV;离子源温度:550 ℃;雾化气压强:50 psi;辅助加热气压强:50 psi;气帘气压强:35 psi;碰撞气为氮气;采集模式为多反应监测(MRM)。
1.3 在线固相萃取分析方法
1.3.1 样品处理污水样品加入混合内标溶液使各同位素内标浓度为50 ng·L-1,使用甲酸或氨水调节pH至7,混匀后用0.2 μm滤膜过滤后供仪器检测。
1.3.2 在线固相萃取-超高效液相色谱-三重四极杆质谱仪分析条件固相萃取柱:Oasis HLB Direct Connect HP(2.1 mm×30 mm,20 μm);色谱柱:ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);进样量:3 mL;在线固相萃取采取双柱模式;固相萃取流速:3 mL·min-1;固相萃取程序:0.0~3.0 min超纯水,3.0~5.0 min 50%甲醇水溶液,5.0~7.0 min甲醇/乙腈/异丙醇混合溶液(体积比1∶1∶1),7.0~16.0 min超纯水,其中2.8 min进行柱切换,将已加载样品的固相萃取柱切换至液相色谱流路,同时将前序完成样品洗脱的固相萃取柱切换至固相萃取流路进行清洗和平衡;液相色谱流动相:A为0.1% 甲酸水溶液,B为0.1%甲酸乙腈溶液;流速:0.4 mL·min-1;洗脱梯度程序:0.0~2.8 min(5%B),2.8~8.4 min(5%~30%B),8.4~13.9 min(30%~100%B),13.9~15.9 min(100%B),15.9~16.0 min(100%~5%B);柱温:40 ℃。质谱分析:电喷雾离子源正离子模式(ESI+);毛细管电压:0.5 kV;加热模块温度:400 ℃;DL温度:250 ℃;雾化气流速:3 L·min-1;加热气流速:10 L·min-1;干燥气流速:10 L·min-1;碰撞气为氩气;采集模式为多反应监测(MRM)。
1.4 回收率和基质效应评价
离线固相萃取法:使用0.1%甲酸水溶液配制浓度分别为0.2、2、20 ng·mL-1的目标物标准溶液直接进样分析,每个浓度重复测定6次得到的峰面积平均值为A;混合空白基质进行固相萃取,洗脱液吹干后分别加入含0.2、2、20 ng·mL-1目标物的0.1%甲酸水溶液250 μL复溶后进样分析,每个浓度重复测定6次得到的峰面积平均值为B;使用混合空白基质配制浓度分别为1、10、100 ng·L-1的基质添加样品后进行固相萃取,每个浓度重复测定6次得到的峰面积平均值为C;提取回收率=C/B,基质效应=B/A,整体回收率=C/A。在线固相萃取法:使用纯水配制浓度分别为1、10、100 ng·L-1的标准溶液,每个浓度重复测定6次得到的峰面积平均值为A;使用混合空白基质配制浓度分别为1、10、100 ng·L-1的基质添加样品,每个浓度重复测定6次得到的峰面积平均值为C;整体回收率=C/A。
2 结果与讨论
2.1 质谱条件的优化
目标物使用液相色谱-三重四极杆质谱仪(LC-TQ-MS)在多反应监测(MRM)模式下进行检测。由于离线和在线固相萃取法使用不同的质谱仪,因此分别优化了5种目标物及相应同位素内标的母离子、子离子和碰撞能量,结果见表1。芬太尼、乙酰芬太尼及4-ANPP在两台仪器上响应最强的两个子离子均为188.1和105.1,前者由氨基与哌啶环之间的C-N断裂生成,后者由哌啶环氮原子与苯乙基之间的C-N断裂生成(图2A)。去苯乙基芬太尼在使用碰撞气为氮气的Triple Quad 6500时响应最强的两个子离子为150.1和84.1,二者均由氨基与哌啶环之间的C-N断裂生成;使用碰撞气为氩气的LCMS-8050时响应最强的两个子离子为84.1和56.0,前者由氨基与哌啶环之间的C-N断裂生成,后者由哌啶环碎裂生成(图2B)。去苯乙基乙酰芬太尼的情况与去苯乙基芬太尼类似。

表1 5种目标化合物及其同位素内标MRM质谱采集参数

续表1
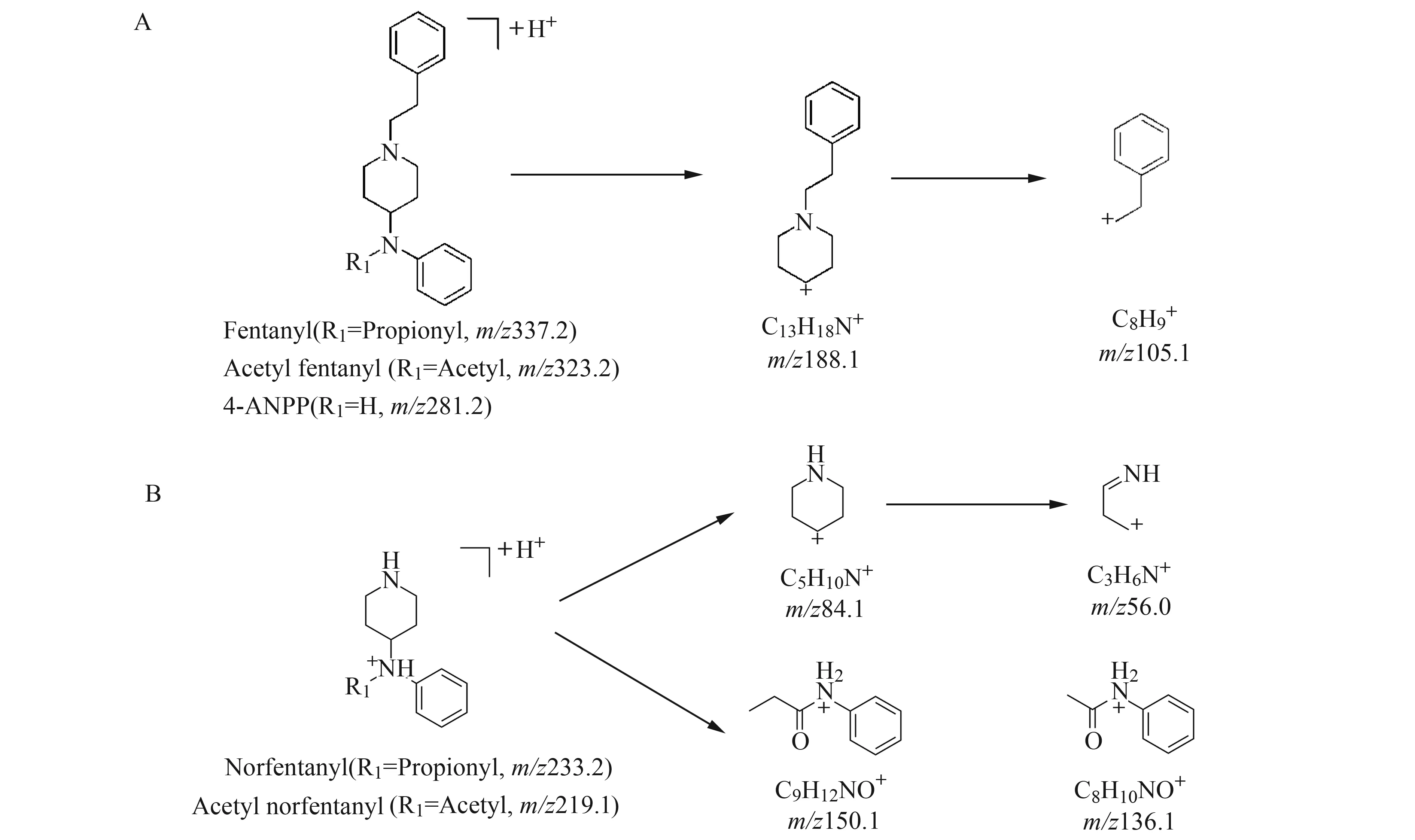
图2 5种目标化合物子离子裂解途径Fig.2 Proposed fragmentation pathways of product ions for five target compounds
2.2 色谱条件的优化
鉴于目标物使用电喷雾离子源在正离子模式下进行检测,色谱梯度洗脱的水相选择0.1%甲酸水溶液以提高离子化效率,有机相经测试乙腈较甲醇响应更强且柱压更低,因而使用前者。色谱分离尝试了ACQUITY UPLC BEH C18 色谱柱(2.1 mm×100 mm,1.7 μm)和ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)两种色谱柱,使用离线固相萃取法时前者峰形更佳,使用在线固相萃取法时由于目标物在固相萃取柱上洗脱后直接进入色谱柱,后者对极性化合物保留更强,能在初始流动相下更好进行柱头富集从而获得更好的峰形。最终离线固相萃取法和在线固相萃取法优化条件下的色谱图见图3,5种目标物均得到有效分离。

图3 5种目标化合物TIC色谱图Fig.3 TIC chromatograms of five target compounds
2.3 前处理方法的比较
固相萃取是分析污水中痕量有机物质最常用的前处理方法。由于污水样品基质差异较大,本研究使用来自不同城市且经测试不含5种目标物的10份污水样品,等比例混合制成混合空白污水基质,并分别添加了1、10、100 ng·L-1的目标物,考察了离线和在线两种不同固相萃取模式的提取和净化效果。
离线固相萃取使用全自动固相萃取仪进行,50 mL污水样品经上样、淋洗和洗脱后,洗脱液浓缩至干再加入250 μL溶剂复溶,LC-TQ-MS进样5 μL检测,实际进样量相当于1 mL污水样品。鉴于5种目标物全部为碱性有机物,固相萃取柱选择了PRiME MCX和PRiME HLB进行测试,该系列固相萃取柱不需活化和平衡步骤,能节省时间和溶剂消耗。PRiME MCX基于阳离子交换模式,上样时将污水样品pH调节至小于2以保证目标物充分质子化,洗脱时则使用5%氨水甲醇溶液将目标物去质子化;PRiME HLB基于反相保留模式,上样时将污水样品pH调节至中性,洗脱时使用纯甲醇。根据表2结果,PRiME MCX对于5种目标物的提取回收率均大于80%,而PRiME HLB对于强极性的去苯乙基乙酰芬太尼的提取回收率仅有约40%,对去苯乙基芬太尼和4-ANPP的提取回收率也低于80%,且重复性较差。同时,由于污水中存在大量干扰物,所有目标物均存在较为严重的基质效应,但除去苯乙基乙酰芬太尼外的4种目标物使用PRiME MCX时基质干扰更弱。综合提取回收率和基质效应可见,PRiME MCX对于所有目标物的整体回收率均优于PRiME HLB,这与以往相关研究结论一致[13],即提取污水中碱性化合物时阳离子交换模式的选择性更好,因此后续实验中离线固相萃取均使用PRiME MCX柱。
在线固相萃取使用带有固相萃取模块的LC-TQ-MS进行,首先由固相萃取流路加载3 mL污水样品至在线固相萃取柱并淋洗,再将在线固相萃取柱切换至分析流路,由流动相将其洗脱至色谱柱进行分离和检测。该模式下洗脱液直接进入色谱柱,限制了需要强碱或强酸性洗脱条件的离子交换固相萃取柱的使用,因而只选择了反相保留机理的HLB Direct Connect HP,上样时将污水样品调节至中性;同时由于提取和分析步骤同时在线进行,无法进行空白基质提取后的添加实验,未能对提取回收率和基质效应进行单独评价。根据表2结果,HLB Direct Connect HP的整体回收率高于PRiME HLB而低于PRiME MCX,说明其选择性仍差于阳离子交换模式,但与填料成分相同的PRiME HLB相比,在线固相萃取可保证所有被保留的组分均被洗脱进入色谱柱,避免了离线固相萃取时洗脱、浓缩和复溶步骤可能带来的损失,因而能获得相对更高的回收率。鉴于在线固相萃取操作简便且所需污水样品体积小,适用于大批量实际样品的检测,虽然效果较PRiME MCX差,后续也对该方法进行了详细评价。

表2 不同固相萃取条件下的基质效应、提取回收率和整体回收率比较
2.4 离线和在线固相萃取法方法的验证
2.4.1 检出限、定量限与线性范围使用混合空白污水基质配制范围为0.1~500 ng·L-1的不同浓度梯度的基质添加样品进行测试,检出限(LOD)和定量限(LOQ)分别以3倍信噪比和10倍信噪比确定。以目标物峰面积与相应同位素内标峰面积的比值(Y)与目标物质量浓度(X,ng/L)进行线性回归运算(权重系数:1/X),得到标准曲线方程和相关系数,结果见表3。
两种前处理方法对所有目标物的定量线性范围均为0.5~200 ng·L-1,标准曲线相关系数均在0.995以上,可满足实际污水样品测定的要求。前处理方法研究中离线固相萃取整体回收率优于在线固相萃取,但前者进样量仅相当于1 mL污水样品,而后者进样量为3 mL,实际检测的污水体积更大,因此最终两种方法的效果相当。

表3 方法检出限、定量限、线性范围、准确度和精密度
2.4.2 准确度与精密度使用混合空白污水基质分别配制浓度为1、10、100 ng·L-1的基质添加样品,每种浓度每天进行6次测试,连续3天重复操作评价准确度、日内精密度和日间精密度,准确度以测试结果平均值与添加值的相对误差(RE)表示,精密度以相对标准偏差(RSD)表示。结果见表3。所有目标物在3个添加浓度水平下的定量误差均小于10%,日内和日间RSD均小于6%,表明两种方法的准确度和精密度均符合要求。值得注意的是,无论是离线还是在线固相萃取中4-ANPP都受到了严重的基质干扰,整体回收率仅有20%左右,但通过同位素内标校准后仍可获得较为满意的定量结果。
2.4.3 目标物稳定性分别将混合空白污水基质配制的质控样品调节至pH 2和pH 7,考察不同存储条件下的稳定性,结果显示两种pH条件下,4 ℃冷藏1周以内以及-20 ℃冷冻2个月以内,5种目标物的浓度变化均小于15%,说明稳定性良好,污水采样后无需进行特别的预处理。
2.5 方法的实际应用
使用本研究建立的离线固相萃取法和在线固相萃取法,对2020年第二季度采集的1332份污水样品进行了分析,结果均未检出5种目标物,且同位素内标均正常出峰,说明样品前处理及仪器检测过程可靠。与相应含量同位素内标溶液直接进样结果相比,污水样品中同位素内标峰面积受到明显抑制,二者峰面积比值主要分布于20%至80%区间(表4),说明实际污水的基质干扰复杂,不同样品间存在较大差异,因此必须使用同位素内标进行校正才能获得准确的定量结果。

表4 实际污水样品中同位素内标峰面积抑制情况分布(%)
我国已于2019年5月1日起将芬太尼类物质整类列入管制,本研究针对的芬太尼和乙酰芬太尼是最为常见的芬太尼类物质,去苯乙基芬太尼和去苯乙基乙酰芬太尼是二者的主要代谢产物,4-ANPP是多种芬太尼类物质的制造原料和代谢产物,本次在来自125个主要城市的实际样品中均未检出这5种物质,说明我国对芬太尼类物质的管控效果较好,不存在规模性滥用。
3 结论
本研究建立了两种同时测定污水中5种芬太尼类物质及其代谢物的分析方法,分别基于离线和在线固相萃取技术,其中离线固相萃取的整体回收率高于在线固相萃取,但使用后者时污水样品仅需过滤即可上样,操作更为简便。验证结果显示,通过同位素内标校正后,两种方法均能对污水中的5种目标物进行准确定量分析,线性范围宽,准确度和精密度较好,可用于实际污水样品的检测,从而评估相关区域内芬太尼类物质的滥用情况,提升毒情监测预警能力。
