白藜芦醇对饥饿条件下厚壳贻贝(Mytilus coruscus)抗氧化能力的影响*
2023-01-17陈传悦孙闻婧严小军张晓林
陈传悦 谢 兵 孙闻婧 廖 智 严小军 张晓林①
白藜芦醇对饥饿条件下厚壳贻贝()抗氧化能力的影响*
陈传悦1, 2谢 兵1孙闻婧1廖 智1严小军1, 2张晓林1①
(1. 浙江海洋大学海洋科学与技术学院 浙江舟山 316022; 2. 宁波大学海洋学院 浙江宁波 315211)
饥饿胁迫引起的肥满度下降及收割延迟是导致贻贝养殖产量下降的主要原因之一。探究白藜芦醇(Resveratrol, RES)对饥饿条件下贻贝抗氧化能力的影响, 揭示贻贝对饥饿胁迫的响应机制, 对指导贻贝健康养殖具有重要意义。在饥饿胁迫条件下, 分别采用10、20、50、100 μmol/L RES处理厚壳贻贝, 9 d后采集贻贝组织样品并进行氧化应激指标检测。结果表明, 饥饿胁迫显著增加厚壳贻贝组织中丙二醛(MDA)含量, 同时显著降低过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性和还原性谷胱甘肽(GSH)含量。RES处理后, 厚壳贻贝组织中MDA含量显著降低, 但随着RES浓度的增加显著升高; 性腺和鳃中CAT、SOD、GSH-PX、AKP、ACP活性和GSH水平、后闭壳肌中CAT、AKP活性和GSH水平以及外套膜中CAT、SOD、GSH-PX、ACP活性和GSH水平均随着RES处理浓度的增加先升高后降低。此外, 10或20 μmol/L RES处理能显著减轻饥饿胁迫引起的贻贝性腺中滤泡降解、配子退化及鳃丝纤毛脱落及结构受损; 且各组贻贝后闭壳肌和外套膜组织形态学无明显变化。研究结果表明饥饿胁迫能显著抑制厚壳贻贝的抗氧化能力, 但10或20 μmol/L RES处理可减轻饥饿胁迫诱导的脂质过氧化和组织氧化应激损伤, 且厚壳贻贝对饥饿胁迫诱导的氧化应激损伤表现出一定的组织差异性。
厚壳贻贝; 饥饿胁迫; 氧化应激; 酶活性; 组织损伤
饥饿胁迫和食物限制会引起水生动物生理机能的变化, 主要表现为增加动物体内活性氧(Reactive oxygen species, ROS)的释放, 从而破坏生物膜中的多不饱和脂肪酸, 刺激有毒醛类代谢物如丙二醛(Malondialdehyde, MDA)的产生, 引起脂质过氧化(Yang, 2019; Zengin, 2021)。正常情况下, 生物体内ROS的产生会受到各种还原酶的控制, 例如超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)和总抗氧化力(Total antioxidant capacity, T-AOC) (Tsikas, 2017), 从而维持了体内的氧化-还原平衡。但生物体内的还原体系无法控制ROS水平的升高时, 将导致一系列氧化应激反应, 引起细胞膜、蛋白质和核酸等损伤, 最终导致组织器官损伤(Filho, 2007; Lee, 2019)。白藜芦醇(Resveratrol, RES)是一种天然多酚类化合物, 广泛存在于虎杖、桑葚、花生、葡萄和浆果类等植物果实中, 具有抗炎、抗氧化、抗癌、抗病毒及免疫调节等多种生物学功能(Galiniak, 2019; Huang, 2021; Ren, 2021)。近年来, 利用RES通过调节新陈代谢和免疫应答以及抑制炎症反应, 以此改善水产动物因摄食不足而产生的品质下降已逐渐受到人们的重视, 相关研究也日益增多。现有的研究结果表明, 在饲料中添加RES能够提高鱼类的生长率, 增加血清和组织中抗氧化酶和免疫因子水平, 从而增加生物体抗氧化和免疫应答能力(Jia, 2019a; Tian, 2021)。例如, RES可以显著减轻豆粕替代鱼粉引起的大菱鲆肝脏和肠道组织中的氧化应激损伤(Tan, 2019)。此外, 在大西洋鲑和虹鳟等海水鱼类细胞的体外研究中也证实RES具有免疫调节以及抗氧化应激的作用(Terech-Majewska, 2018; Holen, 2019)。目前RES在水产动物中的免疫、抗炎和抗氧化等作用相关研究主要集中在鱼类, 而对同样具有重要经济价值的贝类而言, 相关研究尚未见报道。
厚壳贻贝()作为典型的海洋双壳类物种, 因其个体较大, 肉肥味美, 营养价值较高, 已成为中国东部海域最重要的海产贝类养殖品种之一(Li, 2020)。目前厚壳贻贝养殖主要集中在黄海和东海海域, 其中浙江省嵊泗列岛是我国最大的厚壳贻贝养殖基地。贻贝是典型的滤食性生物, 主要以海洋环境中的有机颗粒和藻类为食, 因此, 其生长繁殖极易受到现有养殖模式造成的饵料分布不均或由于气候、季节变化引起的饵料不足的影响。已有研究证实, 饵料限制引起的饥饿胁迫是引起高密度养殖区域贻贝肥满度下降的主要原因(Orban, 2002)。但是目前针对贻贝养殖过程中其对饥饿胁迫响应机制的研究较少, 对于高密度养殖条件下如何改善贻贝的生长和产品质量仍缺乏有效思路。因此, 探究饥饿胁迫下贻贝的生理生化变化以及RES对贻贝饥饿状态下的生理改善, 对贻贝的健康养殖具有重要指导意义。
本研究以厚壳贻贝为研究对象, 通过饥饿胁迫以及不同浓度RES处理, 分析厚壳贻贝不同组织中氧化应激指标的变化。研究结果将为探讨贻贝对饥饿胁迫的响应以及RES在饥饿胁迫贻贝中的作用机制奠定基础, 为RES在贻贝养殖业中的应用提供新的思路和科学依据。
1 材料与方法
1.1 实验动物
成年厚壳贻贝(壳长60~70 mm)采集自浙江省嵊泗枸杞岛贻贝养殖场。采集后的贻贝置于300 L玻璃缸中暂养7 d, 暂养期间水温(20 ± 2) °C、盐度28 ± 1。
1.2 饥饿胁迫与RES处理
将36只厚壳贻贝随机分为6组, 每组6只: 正常饲养组(Con)、饥饿胁迫组(STA)和不同浓度RES处理组(RES10、RES20、RES50、RES100)。Con组每天正常投喂螺旋藻粉2次; STA组在实验期间进行饥饿处理; 不同RES处理组贻贝在饥饿胁迫的同时分别使用10、20、50、100 μmol/L RES处理。每天更换含有对应浓度RES的海水一次, 处理9 d后, 取贻贝的性腺、鳃、外套膜、后闭壳肌组织经液氮速冻后–80 °C保存备用。
1.3 氧化应激相关指标检测
将各组组织样品于液氮研磨后, 根据质量体积比加入9倍预冷的PBS缓冲液, 旋涡振荡器充分混匀, 制备组织匀浆液。冰上静置5 min后, 3 000 r/min、4 °C离心10 min, 取上清液用于后续检测。使用BCA试剂盒(TaKaRa, 货号: T9300A)测定上清液中的蛋白浓度。
使用南京建成生物研究所的试剂盒检测各组贻贝性腺、鳃、后闭壳肌、外套膜组织中的氧化应激相关指标, 包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-px)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性, 以及丙二醛(MDA)和还原型谷胱甘肽(GSH)含量。
1.4 组织学检测
取贻贝性腺、鳃、后闭壳肌、外套膜组织, 并用4%多聚甲醛固定。将组织从固定液中取出, 用乙醇进行脱水, 二甲苯透明10 min, 石蜡包埋, 切片厚度6 μm, 二甲苯脱蜡, 苏木精-伊红染色, 二甲苯透明, 树胶封片。
1.5 数据处理
所有实验数据均以平均值±标准差(mean±SD)表示。使用SPSS 22.0软件进行数据的统计学分析, 并使用单因素方差分析(One-way ANOVA)中的Duncan’s进行多重比较,<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度RES对饥饿胁迫厚壳贻贝MDA水平的影响
饥饿胁迫及不同浓度RES处理对厚壳贻贝组织中MDA水平的影响见图1。结果表明, 与Con组比较, 饥饿胁迫9 d后(STA组), 厚壳贻贝性腺、鳃、后闭壳肌组织中的MDA含量均显著增加(<0.05), 但外套膜中MDA含量无显著变化(>0.05)。与STA组比较, 厚壳贻贝的性腺和外套膜组织中MDA含量在RES10、RES20、RES50组中均显著降低(<0.05); 鳃和后闭壳肌组织中MDA含量在RES10、RES20组中显著降低(<0.05); 然而100 μmol/L RES处理显著增加了性腺和鳃组织中MDA水平(<0.05)。
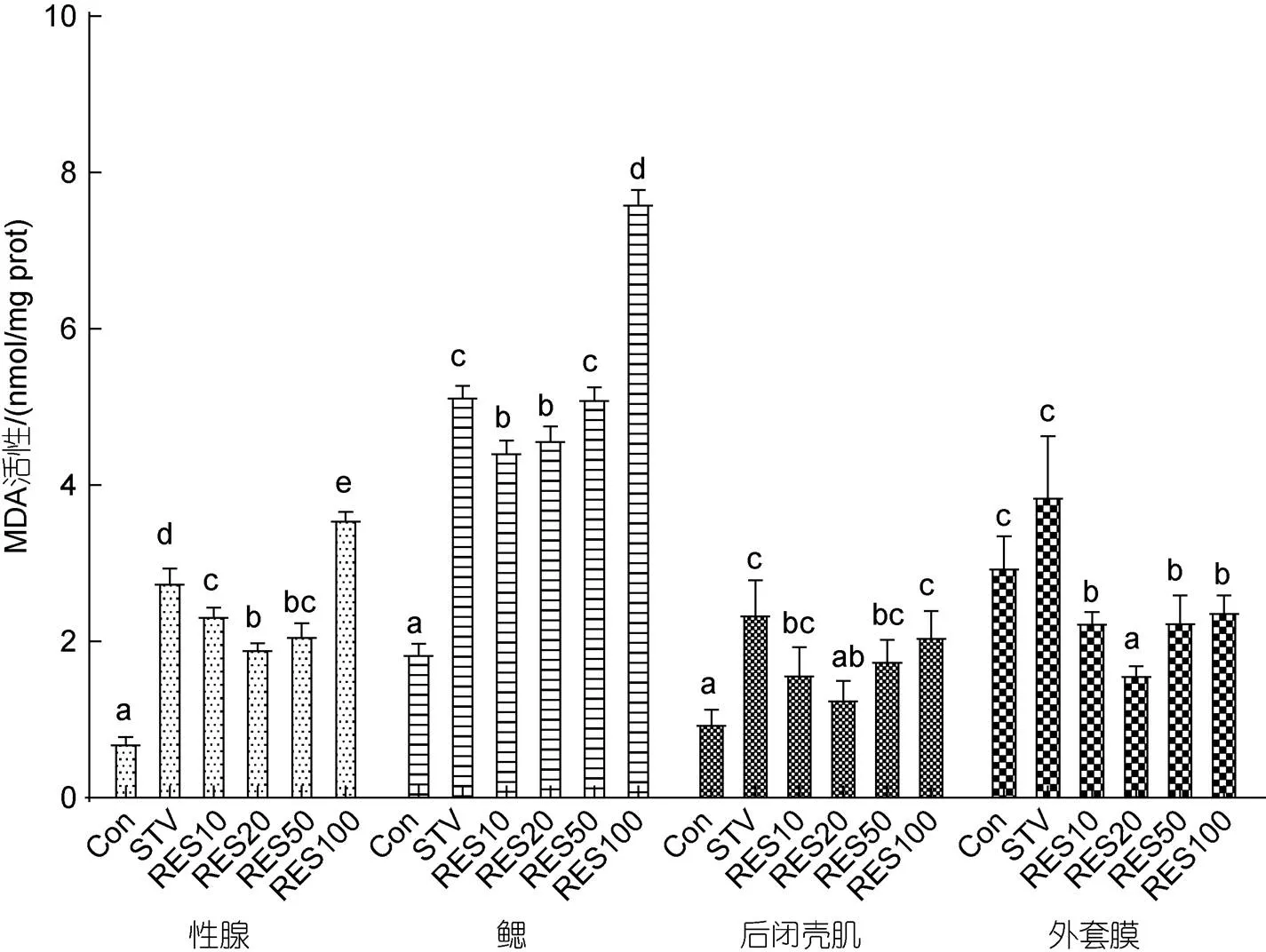
图1 RES对饥饿胁迫厚壳贻贝MDA水平的影响
注: 不同字母表示组间显著性差异(<0.05)。Con: 对照组; STV: 饥饿胁迫组; RES10: 10 μmol/L RES处理组; RES20: 20 μmol/L RES处理组; RES50: 50 μmol/L RES处理组; RES100: 100 μmol/L RES处理组。下同
2.2 不同浓度RES对饥饿胁迫厚壳贻贝CAT和SOD活性的影响
饥饿胁迫及不同浓度RES处理对厚壳贻贝组织中CAT和SOD活性影响见图2。结果表明, 与Con组相比, 饥饿胁迫9 d后, 厚壳贻贝性腺、鳃、外套膜组织中CAT和SOD活性及外套膜中CAT活性均显著降低(<0.05)。与STA组比较, 厚壳贻贝鳃、后闭壳肌、外套膜组织中CAT活性在RES10、RES20、RES50组均显著升高(<0.05), 性腺组织中CAT活性在RES10和RES20组显著升高(<0.05)。与STA组比较, 厚壳贻贝性腺中SOD活性在RES20组中显著升高(<0.05), 其他RES处理组无显著性变化(>0.05), 鳃组织中SOD活性在RES10、RES20、RES50组中均显著升高(<0.05), 但RES100组中显著降低(<0.05), 外套膜组织中SOD活性在RES20、RES50组中显著升高(<0.05), 但RES100组显著降低(<0.05); 在后闭壳肌组织中, RES100组SOD活性显著低于Con组(<0.05), 其他组中SOD活性变化均无显著性差异(>0.05)。且后闭壳肌和外套膜组织中SOD的活性均显著高于性腺和鳃组织(<0.05)。

2.3 不同浓度RES对饥饿胁迫厚壳贻贝GSH水平和GSH-PX活性的影响
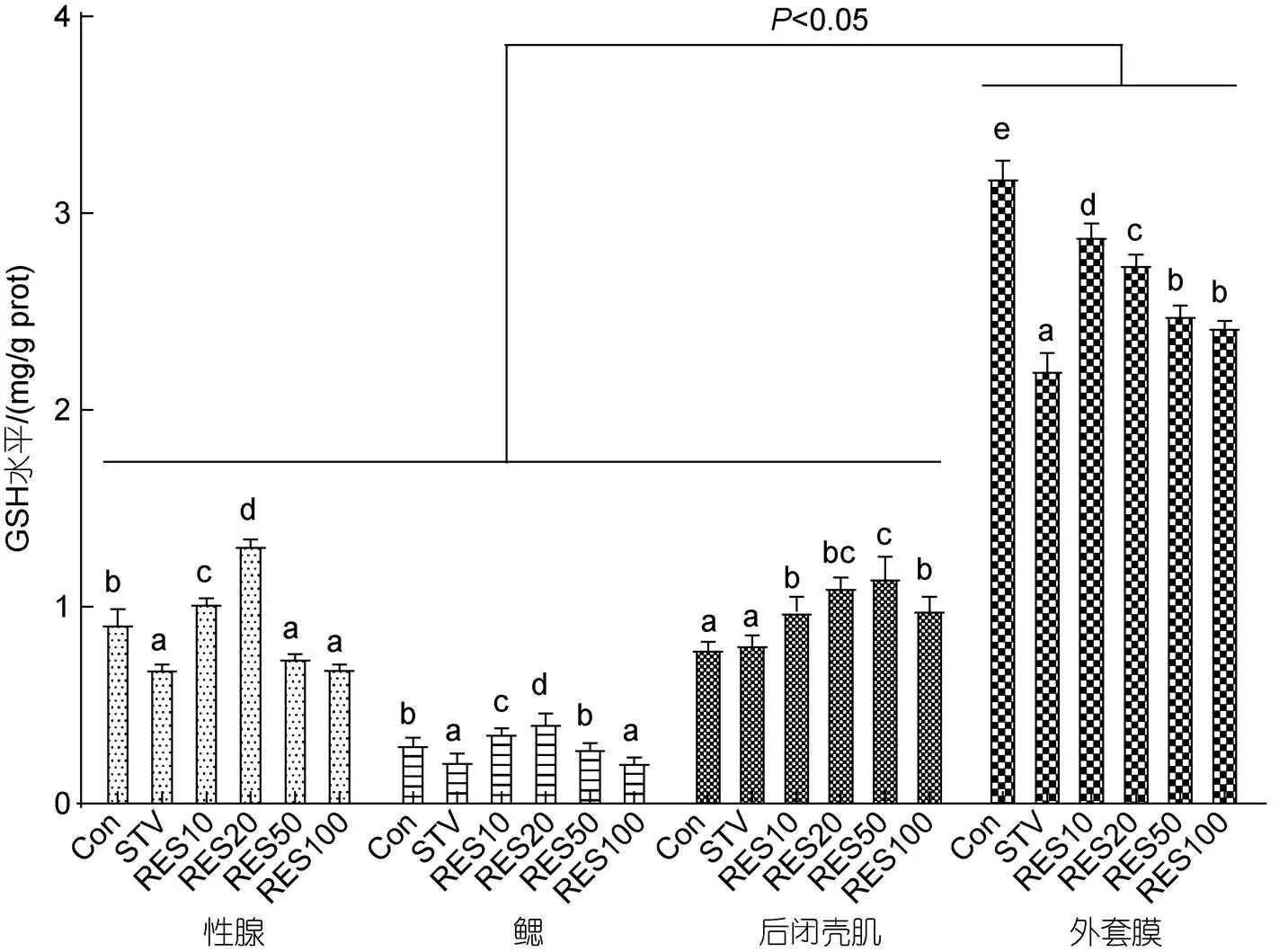
厚壳贻贝组织中GSH水平和GSH-PX活性变化如图3所示。与Con组相比, 饥饿胁迫9 d后厚壳贻贝性腺、鳃、外套膜组织中GSH水平均及性腺、鳃、后闭壳肌、外套膜组织中GSH-PX活性均显著降低(<0.05), 后闭壳肌中的GSH水平无明显变化(>0.05)。与STA组比较, 性腺中GSH水平和GSH-PX活性在RES10和RES20组显著升高(<0.05), 鳃组织中GSH水平在RES10、RES20和RES50组均显著升高(<0.05), 鳃和外套膜组织中GSH-PX活性在RES20组显著升高(<0.05), 后闭壳肌和外套膜组织中GSH水平在所有RES组中均显著升高(<0.05), 后闭壳肌中GSH-PX活性在所有RES组无明显变化(>0.05)。外套膜组织中GSH水平显著高于其他组织(<0.05)。
2.4 不同浓度RES对饥饿胁迫厚壳贻贝AKP及ACP活性的影响
厚壳贻贝组织中AKP和ACP活性变化如图4所示。与Con组相比, 饥饿胁迫9 d后厚壳贻贝性腺和鳃组织中AKP活性及性腺、鳃、外套膜组织中ACP活性均显著降低(<0.05)。性腺组织中AKP活性在RES20和RES50组显著低于Con组, 但是显著高于STA组(<0.05)。鳃组织中AKP活性在RES20、RES50和RES100组均显著高于Con和STA组(<0.05)。后闭壳肌中AKP活性在RES10和RES20组显著高于STA组, 在RES50和RES100组显著低于Con组(>0.05)。外套膜中AKP活性在所有处理组中均无明显变化(>0.05), 但显著低于其他组织(<0.05)。与STA组比较, 性腺组织中ACP活性在RES20、RES50、RES100组显著升高(<0.05), 鳃组织中ACP活性在RES10、RES20、RES50组显著升高(<0.05), 外套膜中ACP活性在RES20组显著升高。后闭壳肌中ACP活性在所有处理组中无明显变化(>0.05)。
2.5 不同浓度RES对饥饿胁迫厚壳贻贝组织病理变化影响
HE染色观察厚壳贻贝性腺、鳃、后闭壳肌、外套膜组织病理变化, 结果见图5。Con组贻贝性腺开始发育, 结缔组织大量减少, 可见椭圆形滤泡, 滤泡壁上出现卵原细胞和初级卵母细胞, 滤泡腔内包含许多游离的卵母细胞; STA组、RES50和RES100组贻贝性腺组织滤泡膜降解, 滤泡腔内的卵母细胞退化; 与STA组比较, RES10和RES20组贻贝性腺滤泡及配子退化程度显著减轻。Con组贻贝鳃丝结构完整, 纤毛清晰可见, 鳃丝之间由纤毛盘相互连结; STA组、RES50和RES100组贻贝鳃丝纤毛柱状细胞变形萎缩, 鳃丝形态结构受损、结构模糊, 纤毛脱落, 鳃丝细胞自溶; RES10和RES20组贻贝鳃丝损伤有所减轻。贻贝后闭壳肌肌细胞形态呈多边形, 排列整齐紧密; 饥饿胁迫后贻贝后闭壳肌肌纤维束间的空隙增大, 其他无明显变化。贻贝外套膜有内、外两侧上皮层和结缔组织及少量肌纤维组成; 上皮细胞间分布大量的黏液细胞, 具有分泌功能, 可以分泌大量的黏液物质; STA组和RES100组贻贝外套膜结缔组织中空泡细胞增多, 且黏液分泌也显著增多, 其他无明显变化。
3 讨论
水生动物在自然生长繁殖过程中, 时常因饵料短缺或环境变化等导致个体面临饥饿胁迫(Yang, 2020)。在饥饿状态下, 生物体主要依靠自身营养物质的消耗以及改变各种酶的活性来调节代谢水平和能量分配, 以适应食物短缺造成的威胁, 从而维持机体正常生理活动。饥饿胁迫不仅会增加动物组织中ROS的积累, 诱发氧化应激损伤, 还会引起机体生理生化指标的变化(Włodarczyk, 2019)。因此, 研究饥饿胁迫后氧化应激相关指标变化, 对解析水生动物饥饿胁迫的生理响应、指导养殖生产具有参考意义。

图4 RES对饥饿胁迫厚壳贻贝AKP及ACP活性的影响

注: 标尺: 50 μm。黑色箭头: 配子退化; 黑色三角: 滤泡降解; 红色箭头: 纤毛脱落; 红色三角: 纤毛盘溶解; 红色椭圆: 鳃丝细胞溶解; 黑色星号: 肌纤维束间距增大; GC: 杯状细胞; MU: 黏液层; MC: 黏液细胞; VC: 空泡细胞
MDA是脂质过氧化反应的分解终产物, 能够引起核酸、蛋白质等生物大分子的交联聚合, 具有一定的细胞毒性, 其在组织中的含量可以反应机体脂质过氧化的严重程度以及氧化应激的水平(Janero, 1990; Martínez, 2017)。SOD和CAT是动物体内重要的抗氧化酶, SOD可以加速自由基转化为H2O2, CAT能够将H2O2分解成水, 从而清除氧自由基, 减少机体氧化应激损伤(Fakhereddin, 2021; Sharma, 2021)。本研究发现饥饿胁迫9 d后, 厚壳贻贝性腺和鳃组织中的MDA含量显著升高, SOD和CAT活性显著降低, 说明饥饿胁迫诱导了厚壳贻贝组织发生脂质过氧化, 组织细胞受到自由基的破坏。该结果与此前在鱼类以及甲壳类动物中的研究结果类似。例如, Liu等(2018)研究发现饥饿胁迫能够引起虹鳟肝脏、胃、肠道组织损伤, 组织中的MDA水平增加, 组织中SOD活力降低, 最终激活氧化应激。赵旺等(2021)发现, 饥饿胁迫下, 猛虾蛄组织中SOD和CAT的活性呈先增高后降低的变化, 说明机体在饥饿胁迫早期会产生积极的免疫防御, 但长时间饥饿胁迫使机体能量不断消耗, 导致免疫防御能力下降。此外, 本研究还发现, 低浓度RES处理能显著降低厚壳贻贝组织中的MDA水平及增加SOD和CAT活性, 但高浓度RES反而增加了饥饿胁迫引起的MDA在厚壳贻贝组织中的积累, 说明低浓度RES可有效的减轻饥饿胁迫贻贝组织的脂质过氧化, 但高浓度RES加剧了贻贝组织脂质过氧化。已有研究证实酚类抗氧化剂能够与金属离子结合, 诱导活性氧的生成(王占洋等, 2015)。这可能也是本研究中高浓度RES加剧饥饿胁迫诱导贻贝组织损伤的主要原因, 说明抗氧化剂在一定条件下也会起到促氧化作用。Tian等(2021)的研究也证实饲料中添加一定剂量的RES可以通过增加组织中CAT和SOD的活性提高乌鳢的抗氧化能力。此外, 董婧等(2016)在对斑马鱼的研究中发现, 饲喂RES强化卤虫可显著降低斑马鱼肠道中MDA的含量,但是随着RES强化剂量的增加, 斑马鱼肠道中的MDA含量呈先下降后升高的趋势, 这与本研究结果一致。
GSH-PX是动物体内广泛存在的催化过氧化物分解的酶, 能够特异性地催化GSH与H2O2的反应, 具有保护细胞膜结构和功能完整性的作用(Anjum, 2012)。在鱼类中, 已有研究证实GSH-PX活性和GSH含量可受饥饿胁迫的影响。例如, 吴晓雲等(2021)研究报道, 饥饿胁迫可显著降低长江鲟肝脏、肌肉和肠道组织中的GSH-PX活性和GSH含量, 从而抑制鱼体抗氧化能力。Varju等(2018)研究表明饥饿胁迫引起梭鲈体内缺乏氨基酸供应, 导致GSH合成收到干扰, 从而引起GSH-PX活性下降。本研究发现, 饥饿胁迫显著降低了厚壳贻贝组织中GSH-PX活性和GSH含量, 说明饥饿胁迫后, 贻贝同样表现出承受氧化应激的能力显著减弱。但RES处理可显著增加饥饿胁迫贻贝组织中GSH-PX活性和GSH含量, 说明RES增强了饥饿胁迫贻贝的抗氧化能力, 但随着RES处理浓度的增加GSH-PX活性和GSH水平呈先升高后降低的趋势, 这与之前鱼类中的相关研究结果具有一致性。例如, Jia等(2019b)对尼罗罗非鱼的研究中发现RES能够增加肝脏组织中SOD和CAT活性以及GSH水平, 从而减轻H2O2诱导的氧化应激和脂质过氧化损伤。上述研究表明, 贝类和鱼类在饥饿胁迫下, 有着类似的生理响应过程。
非特异性免疫系统在机体对环境变化的响应过程中发挥重要作用。其中, AKP和ACP是非特异性免疫系统中重要的水解酶家族, 在动物体内参与磷酸基团的转移和代谢, 具有促进血细胞吞噬、降解异物的作用(Poelstra, 1997; He, 2017; Xia, 2018)。此外, AKP与水生动物的生长密切相关, 在营养物质的摄取和利用, 甚至蛋白质的制备中起着至关重要的作用。因此, 较高的ACP和AKP活性表明水生动物对不利环境, 如重金属污染、外源病原体和微生物入侵、饥饿胁迫等, 产生了抗性(De Mora, 2004; 杜启艳等, 2008; Wu, 2021)。本研究中饥饿胁迫显著降低了厚壳贻贝组织中AKP和ACP的活性, 说明饥饿胁迫可引起贻贝免疫力降低, 且AKP活性的降低也说明贻贝组织细胞的生理活动维持在较低水平以适应饥饿状态(赵旺等, 2021)。RES处理后贻贝组织中AKP和ACP含量显著升高, 但随着RES浓度的增加, AKP和ACP含量表现为显著下降, 说明RES处理在一定浓度范围内能够提高饥饿胁迫贻贝的免疫功能。在鱼类中, RES已被证明可提高其免疫能力。例如, 在饲料中添加不同浓度的RES可以提高乌克兰鳞鲤AKP和ACP的活力(高妍等, 2015)。李开放等(2019)研究发现饲料中添加160 mg/kg RES能够显著提高松浦镜鲤AKP和ACP活性, 但400 mg/kg RES添加组无此作用, 这与本研究结果相似。
饥饿胁迫对贻贝组织病理变化未见相关文献报道。本研究中, 组织学结果发现饥饿胁迫引起贻贝性腺中滤泡及配子降解, 破坏贻贝鳃丝结构、诱导鳃丝纤毛脱落, 但贻贝后闭壳肌和外套膜组织形态学无明显病理变化。这可能与贻贝不同组织中MDA水平及抗氧化酶活性变化有关。本研究发现厚壳贻贝对饥饿胁迫诱导的氧化应激及抗氧化酶活具有组织特异性。饥饿胁迫引起MDA在贻贝性腺和鳃组织中的增加水平高于后闭壳肌和外套膜组织。饥饿胁迫贻贝外套膜中的AKP活性均显著低于其他组织, 但GSH含量显著高于其他组织。性腺和鳃组织中的SOD含量均显著低于后闭壳肌和外套膜组织。因此, 我们推测厚壳贻贝闭壳肌和外套膜组织在饥饿胁迫下的抗氧化能力高于性腺和鳃组织, 这与本研究中厚壳贻贝组织学变化结果是一致的。江天棋等(2020)在高温胁迫厚壳贻贝中也发现其代谢酶和免疫酶活具有组织特异性, 这可能与不同组织器官在机体中的作用以及不同组织中存在不同的同工酶有关(陈坤等, 2021)。
4 结论
本文初步探讨了RES在饥饿胁迫厚壳贻贝中的作用, 证实适宜浓度的RES处理能够降低饥饿胁迫贻贝组织中的MDA水平以及提高抗氧化酶活性, 增强贻贝的抗氧化能力, 在一定程度上缓解饥饿胁迫诱导的组织氧化应激损伤。本研究为探究厚壳贻贝对饥饿胁迫的响应机制提供了新的理论依据。同时也为RES在改善厚壳贻贝养殖过程中的饥饿胁迫问题、促进贻贝养殖产业持续健康发展提供理论基础。
王占洋, 邱理红, 李雅娟, 等, 2015. 白藜芦醇对CdCl2暴露所致斑马鱼胚胎发育毒性干预作用及机制的初步研究[J]. 石河子大学学报: 自然科学版, 33(4): 465-470.
江天棋, 张扬, 姜亚洲, 等, 2020. 高温胁迫对厚壳贻贝摄食、代谢和相关酶活性的影响[J]. 生态学杂志, 39(9): 3048-3056.
杜启艳, 王萍, 王友利, 等, 2008. 长期饥饿和再投喂对泥鳅不同组织糖原、酸性磷酸酶和碱性磷酸酶的影响[J]. 江西师范大学学报(自然科学版), 32(4): 488-493.
李开放, 徐奇友, 2019. 白藜芦醇对松浦镜鲤生长性能、肠道消化酶活性、肝脏抗氧化指标和血清生化指标的影响[J]. 动物营养学报, 31(4): 1833-1841.
吴晓雲, 陈叶雨, 赖见生, 等, 2021. 饥饿复投喂对长江鲟肝脏、肠道和肌肉抗氧化功能的影响[J]. 南方农业学报, 52(11): 3157-3165.
陈坤, 孙敬锋, 韩卓然, 等, 2021. 建鲤肠道中4种胞内酶和黏液细胞的分布及组织化学定位[J]. 大连海洋大学学报, 36(5): 760-766.
赵旺, 温为庚, 谭春明, 等, 2021. 饥饿胁迫对猛虾蛄不同组织免疫酶活性的影响[J]. 中山大学学报(自然科学版), 60(4): 26-33.
高妍, 方珍珍, 朱国霞, 等, 2015. 不同水平白藜芦醇对乌克兰鳞鲤部分生化指标的影响[J]. 饲料工业, 36(2): 25-29.
董婧, 王洋, 郭锦晓, 等, 2016. 白藜芦醇强化卤虫对斑马鱼肠道的形态结构和抗氧化能力的影响[J]. 沈阳农业大学学报, 47(4): 488-492.
ANJUM N A, AHMAD I, MOHMOOD I,, 2012. Modulation of glutathione and its related enzymes in plants’ responses to toxic metals and metalloids-a review [J]. Environmental and Experimental Botany, 75: 307-324.
DE MORA S, SHEIKHOLESLAMI M R, WYSE E,, 2004. An assessment of metal contamination in coastal sediments of the Caspian Sea [J]. Marine Pollution Bulletin, 48(1/2): 61-77.
FAKHEREDDIN T, DOĞAN D, 2021. Pro-oxidant potency of clothianidin in rainbow trout[J]. Archives of Industrial Hygiene and Toxicology, 72(2): 164-172.
FILHO D W, 2007. Reactive oxygen species, antioxidants and fish mitochondria [J]. Frontiers in Bioscience-Landmark, 12(4): 1229-1237.
GALINIAK S, AEBISHER D, BARTUSIK-AEBISHER D, 2019. Health benefits of resveratrol administration [J]. Acta Biochimica Polonica, 66(1): 13-21.
HE W Q, RAHIMNEJAD S, WANG L,, 2017. Effects of organic acids and essential oils blend on growth, gut microbiota, immune response and disease resistance of Pacific white shrimp () against[J]. Fish & Shellfish Immunology, 70: 164-173.
HOLEN E, ARAUJO P, XIE S W,, 2019. Resveratrol inhibited LPS induced transcription of immune genes and secretion of eicosanoids in Atlantic salmon (), comparing mono-, co- and a novel triple cell culture model of head kidney leukocytes, liver cells and visceral adipocyte tissue [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 224: 108560.
HUANG Y J, XIA Y, TAO Y Z,, 2021. Protective effects of resveratrol against the cardiac developmental toxicity of trichloroethylene in zebrafish embryos [J]. Toxicology, 452: 152697.
JANERO D R, 1990. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury [J]. Free Radical Biology and Medicine, 9(6): 515-540.
JIA E T, YAN Y N, ZHOU M,, 2019a. Combined effects of dietary quercetin and resveratrol on growth performance, antioxidant capability and innate immunity of blunt snout bream () [J]. Animal Feed Science and Technology, 256: 114268.
JIA R, LI Y, CAO L P,, 2019b. Antioxidative, anti-inflammatory and hepatoprotective effects of resveratrol on oxidative stress-induced liver damage in tilapia () [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 215: 56-66.
LEE J W, CHOI H, HWANG U K,, 2019. Toxic effects of lead exposure on bioaccumulation, oxidative stress, neurotoxicity, and immune responses in fish: a review [J]. Environmental Toxicology and Pharmacology, 68: 101-108.
LI R H, ZHANG W J, LU J K,, 2020. The whole-genome sequencing and hybrid assembly of[J]. Frontiers in Genetics, 11: 440.
LIU X, HEGAB I M M, SU J H,, 2018. Effects of different durations of fasting/re-feeding bouts on growth, biochemical and histological changes in the digestive tract of Gansu golden trout () [J]. Czech Journal of Animal Science, 63(10): 389-398.
MARTÍNEZ M L, PIOL M N, SBARBATI NUDELMAN N,, 2017. Tributyltin bioaccumulation and toxic effects in freshwater gastropodsafter a chronic exposure: field and laboratory studies [J]. Ecotoxicology, 26(5): 691-701.
ORBAN E, DI LENA G, NEVIGATO T,, 2002. Seasonal changes in meat content, condition index and chemical composition of mussels () cultured in two different Italian sites [J]. Food Chemistry, 77(1): 57-65.
POELSTRA K, BAKKER W W, KLOK P A,, 1997. Dephosphorylation of endotoxin by alkaline phosphatase[J]. The American Journal of Pathology, 151(4): 1163-1169.
REN B X, KWAH M X Y, LIU C L,, 2021. Resveratrol for cancer therapy: challenges and future perspectives [J]. Cancer Letters, 515: 63-72.
SHARMA R, JINDAL R, FAGGIO C, 2021. Impact of cypermethrin in nephrocytes of freshwater fish[J]. Environmental Toxicology and Pharmacology, 88: 103739.
TAN C, ZHOU H H, WANG X,, 2019. Resveratrol attenuates oxidative stress and inflammatory response in turbot fed with soybean meal based diet [J]. Fish & Shellfish Immunology, 91: 130-135.
TERECH-MAJEWSKA E, SIWICKI A K, HERMAŃSKA S,, 2018. Influence of trans-resveratrol on macrophage and lymphocyte activity in rainbow trout () -study [J]. Central European Journal of Immunology, 43(3): 241-247.
TIAN J X, HAN G H, LI Y,, 2021. Effects of resveratrol on growth, antioxidative status and immune response of snakehead fish () [J]. Aquaculture Nutrition, 27(5): 1472-1481.
TSIKAS D, 2017. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: analytical and biological challenges [J]. Analytical Biochemistry, 524: 13-30.
VARJU M, MÜLLER T, BOKOR Z,, 2018. The effects of excessive starvation on antioxidant defence and lipid peroxidation in intensively reared, commercial-size pikeperch (L.) [J]. The Egyptian Journal of Aquatic Research, 44(4): 349-352.
WŁODARCZYK A, WILCZEK G, WILCZEK P,, 2019. Relationship between ROS production, MnSOD activation and periods of fasting and re-feeding in freshwater shrimp(Crustacea, Malacostraca) [J]. PeerJ, 7: e7399.
WU P, XU X H, YU T, 2021. Dietary watermelon residue influencing the nonspecific immunity of juvenile[J]. Fish & Shellfish Immunology, 118: 421-425.
XIA Z Q, WU S J, 2018. Effects of glutathione on the survival, growth performance and non-specific immunity of white shrimps () [J]. Fish & Shellfish Immunology, 73: 141-144.
YANG S, HE K, YAN T,, 2019. Effect of starvation and refeeding on oxidative stress and antioxidant defenses in Yangtze sturgeon () [J]. Fish Physiology and Biochemistry, 45(3): 987-995.
YANG W X, SHI W Z, QU Y H,, 2020. Research on quality changes of grass carp () during short-term starvation [J]. Food Science & Nutrition, 8(2): 1150-1161.
ZENGIN H, 2021. The effects of feeding and starvation on antioxidant defence, fatty acid composition and lipid peroxidation in rearedfry [J]. Scientific Reports, 11(1): 16716.
EFFECTS OF RESVERATROL ON ANTIOXIDANT CAPACITY OFUNDER STARVATION STRESS
CHEN Chuan-Yue1, 2, XIE Bing1, SUN Wen-Jing1, LIAO Zhi1, YAN Xiao-Jun1, 2, ZHANG Xiao-Lin1
(1. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan 316022, China; 2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
The starvation stress ofdecreases the fatness and delays the harvest time, which is a main reason for the decline ofaquaculture yield. To explore the effects of resveratrol (RES) on the antioxidant capacity ofunder starvation stress, and reveal the response mechanism of the mussels to starvation stress and the role of RES in starvation-stressed mussels for healthy mussel farming,were experimental studied in treatment groups at 10, 20, 50, and 100 μmol/L RES levels under starvation stress. The treated samples were collected after 9 days of treatment and oxidative stress indicators were detected. Results show that starvation stress significantly increased malondialdehyde (MDA) content, and significantly decreased catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase (GSH-PX), alkaline phosphatase (AKP) and acid phosphatase (ACP) activities, and glutathione (GSH) levels in mussel tissues. RES significantly decreased the MDA levels in mussel tissues. However, the MDA level increased significantly with the increase of RES treatment concentration. Furthermore, the activities of CAT, SOD GSH-PX, AKP, and ACP, and the GSH levels in gonad and gill, those of CAT and AKP, and the GSH level in adductor muscle and mantle, and those of SOD and GSH-PX in mantle were increased first and then decreased with the increase of RES concentration. In addition, 10 or 20 μmol/L RES treatment significantly slowed down the degradation of follicular and gamete in mussel gonad and the losing of gill filaments of mussels caused by starvation stress. There were no obvious pathological changes in the adductor muscle and mantle tissue of mussels in each group. These results indicate that starvation stress inhibited the antioxidant capacity of. 10 or 20 μmol/L RES might alleviate the lipid peroxidation and oxidative stress damage due to starvation. However, starvation stress-induced oxidative stress and antioxidant enzyme activities are tissue-specific in
; starvation stress; oxidative stress; enzymatic activity; tissue damage
P735
10.11693/hyhz20220500140
*舟山市科技局项目, 2019F71053号; 国家自然科学基金委重点国际(地区)合作与交流项目, 42020104009号。陈传悦, 博士研究生, E-mail: chenchuanyue1991@sohu.com
张晓林, E-mail: zhangxiaolin@zjou.edu.cn
2022-05-25,
2022-06-29
