柠檬色百合实时荧光定量PCR内参基因筛选
2023-01-17徐雷锋毕蒙蒙唐玉超郝泽慧刘一洁杨盼盼
梁 蕤 徐雷锋 毕蒙蒙 王 静 唐玉超 郝泽慧,4 刘一洁,5 杨盼盼 明 军* 杜 方
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.山西农业大学 城乡建设学院,山西 太谷 030801; 3.中国农业科学院 蔬菜花卉研究所,北京 100081; 4.北京农学院 园林学院,北京 102206; 5.青岛农业大学 园林与林学院,山东 青岛 266109)
花色是观赏园艺植物最重要的观赏性状之一,其主要由类黄酮、类胡萝卜素、甜菜色素和叶绿素这4大类化合物构成,其中,类黄酮和类胡萝卜素是百合花色的主要呈色物质[1]。相比于类黄酮代谢研究,类胡萝卜素代谢研究较少[2-3],且类胡萝卜素代谢更为复杂。类胡萝卜素既作为色素在花和果实中积累呈色,也参与光合作用,参与植物生长发育和调控激素水平[4]。产自日本的柠檬色百合(Liliumleichtlinii)属于百合科百合属,其花被片背景富含类胡萝卜素呈柠檬黄色,花1~5朵下垂,开放时花被片向上反卷,具有极高的观赏价值,是研究百合类胡萝卜素花色呈色机理的优选材料[5]。
在以柠檬色百合为试验材料揭示百合类胡萝卜素分子调控机理的过程中,检测类胡萝卜素代谢关键基因表达是必不可少的环节。常规检测基因表达的方法有Northern杂交(Northern blotting)、半定量RT-PCR(Semi-quantitative reverse transcription polymerase chain reaction)、实时荧光定量PCR(Reverse transcription real-time polymerase chain reaction, qRT-PCR)、微阵列分析(Microarrays analysis)、转录组测序(RNA sequencing)和原位杂交(In situ hybridization, ISH)等[6-7]。其中qRT-PCR技术凭借其高准确度、高灵敏度、高通量和操作方便等优点被广泛应用[8],该技术支持绝对定量分析和相对定量分析。绝对定量常用来探究单个样品的本质属性,相对定量常用来比较多个样本间某一特定性质[6,9]。试验中通常运用相对定量探究不同样本间同一基因表达情况。相对定量分析的准确性受到RNA质量和完整性、反转录效率和扩增效率等因素的影响[10]。因此,需要使用1个或多个稳定内参基因(Reference genes)对目的基因的表达进行均一化[11-13]。
内参基因指的是在各个样品中表达恒定的基因[14],其稳定性和可靠性直接关系到目的基因表达检测结果的准确性和整体试验研究的可靠性。在不同百合种(品种)、花发育过程、花被片不同部位、不同器官及不同处理下,大多使用Actin或GAPDH(Glyceraldehyde-3-phosphatedehydrogenase)作为内参基因[15-20];在研究百合体细胞胚的生长发育过程时也用到FP(F-boxfamilyprotein)作为内参基因[21]。但几种常用内参基因在百合不同组织器官间、花发育过程、花遮光处理及叶、鳞片和根胁迫处理中的稳定性是可能变化的。因此,具体百合种(品种)及研究条件下仍需重新筛选稳定适宜的内参基因[22-23]。
本研究根据前期建立的转录组数据库和已报道的百合内参基因,选取了9个候选内参基因,使用geNorm、NormFinder、ΔCT、Bestkeeper程序和RefFinder网站比较分析这9个候选内参基因在柠檬色百合花被片发育过程和不同器官间的表达情况,并对候选内参基因稳定性进行评估排序。为检验内参基因评估的准确性,本研究以筛选出最稳定的内参基因和最不稳定的内参基因作为参照,检测了八氢番茄红素酶基因PSY(Phytoenesynthase)表达情况。PSY作为类胡萝卜素代谢途径的第1个限速酶,在植物花、叶、果实和根等不同器官中PSY基因表达的情况直接决定总类胡萝卜素含量的积累[16,24-27]。因此,本试验将PSY基因在柠檬色百合花被片发育过程和不同器官间表达情况与对应的总类胡萝卜素含量变化趋势结合,用来验证候选内参基因的稳定性。本研究旨在综合多个程序网站评估候选内参基因稳定性,通过检测总类胡萝卜素积累和PSY基因表达验证内参基因稳定性,最终确定柠檬色百合花被片发育过程和不同器官间适宜稳定的内参基因,以期为百合类胡萝卜素的研究提供理论基础。
1 材料与方法
1.1 试验材料
以柠檬色百合(L.leichtlinii)为试验材料,种植于中国农业科学院蔬菜花卉研究所资源圃内。依照花蕾颜色变化和花被片发育2项指标进行取材。花被片发育第1时期(S1):花色转变前期,花蕾长约5.5 cm,整体呈绿色,取其绿偏黄色内花被片作为试材;花被片发育第2时期(S2):花开放前一天,花蕾整体柔软、不紧实,呈鲜艳柠檬黄色,花蕾中部膨大,有张开趋势,取其柠檬黄色内花被片作为试材;花被片发育第3时期(S3):花开放当天,花被片向上反卷,取其反卷的柠檬黄色内花被片作为试材(图1(a)~(c))。同时,取开放当天内花被片、叶、茎、鳞片和根作为不同器官试验材料(图1(d)~(h))。每个样品设3个生物学重复,样品经液氮速冻后存于-80 ℃超低温冰箱备用。

(a)第1时期,花色转变前期;(b)第2时期,花开放前一天;(c)第3时期,花开放当天;(d)花;(e)叶;(f)茎;(g)外层鳞片;(h)根。标尺=2 cm。(a) Stage 1, early phase of color transition; (b) Stage 2,the day before anthesis; (c) Stage 3, 0 day post-anthesis; (d) Flower; (e) Leaf; (f) Stem; (g) The outer scale; (h) Root. Scale=2 cm.图1 柠檬色百合不同发育时期的花和不同器官Fig.1 Flowers in different developmental stages and different tissues of Lilium leichtlinii
1.2 总类胡萝卜素含量测定
将超低温保存的柠檬色百合内花被片、叶、茎、鳞片和根样品冷冻干燥后用研磨仪研磨,称取0.015 g干样溶于1 mL提取液(V(正己烷)∶V(丙酮)∶V(乙醇)=2∶1∶1),包含质量浓度为0.01%的2,6-二叔丁基对甲酚(BHT))中,涡旋30 s,置于25 ℃超声波清洗仪振荡20 min;之后4 ℃离心5 min(12 000 r/min),收集上清避光保存。对沉淀重复上述步骤,收集上清,用提取液定容至5 mL,用0.22 μm有机滤膜过滤后,取3 mL于紫外分光光度计440、645和663 nm波长下检测吸光值,每个样品3个生物学重复[28]。总类胡萝卜素含量根据莫玉楠等[29]的方法进行计算。
1.3 候选内参基因选择及引物序列
文献检索分析Li等[22]和Xu等[23]合成的百合内参基因引物:AP-4complexsubunit(AP4)(NCBI登录号:KP861878)、Beta-tubulin1(β-TUB)(NCBI登录号:KP861875)、Cyclophilin(CYP)、Eukaryoticinitiationfactor1(eIF)(NCBI登录号:KP861874)、Glyceraldehyde-3-phosphatedehydrogenase1(GAPDH)(NCBI登录号:KP179417.1)、DEADboxRNAhelicase(RH2)(NCBI登录号:KP861880)和18SRibosomalRNA(18S)(NCBI登录号:AY684927.1)。同时在已有柠檬色百合转录组数据库中对所有Unigene不同样本的fpkm值进行标准差分析,在fpkm值高且标准差小的Unigene中搜索常用内参基因,最终筛选出Actin2(Actin)(NCBI登录号:OP539310)和Ubiquitin-conjugatingenzymeE22(UBC)(NCBI登录号:OP539311)2个常用内参基因,所有内参基因引物序列如表1所示。PSY引物序列参照Wang等[16]的设计(F:CCAGAGTCCC-GTGCATCGAC;R:ATATCGTCCTCTGAAAG-GCC)。引物由上海生工生物工程股份有限公司合成。
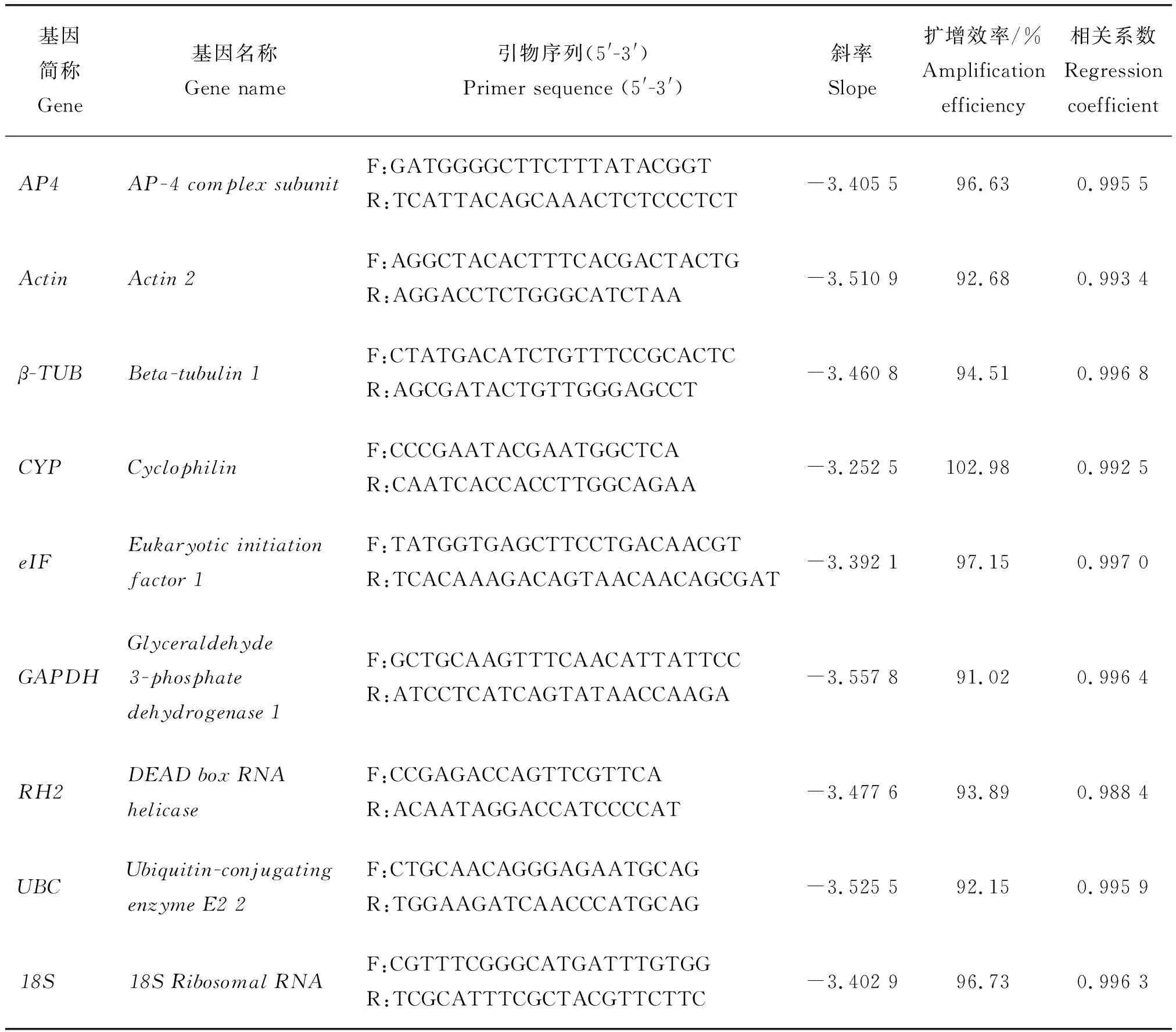
表1 候选内参基因qRT-PCR的引物序列和扩增参数Table 1 Primer sequences and amplification parameters for candidate reference genes
1.4 总RNA提取和cDNA第1链合成
使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化有限公司)提取柠檬色百合内花被片、叶、茎、鳞片和根的RNA,并将不同样本的RNA均稀释为相同浓度(110.0 ng/μL),使用Hifair®II 1 st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)(翊圣生物科技股份有限公司)进行反转录,用EASY Dilution(for Real Time PCR)(Takara)进行cDNA稀释。为检测引物扩增效率,将叶的cDNA原液依次稀释5倍并设置5个浓度梯度,分别为叶cDNA原液的5-1、5-2、5-3、5-4和5-5倍。将不同样本cDNA原液稀释5倍使用,每个样本均为3个生物学重复。
1.5 候选内参基因RT-PCR扩增和qRT-PCR反应
以柠檬色百合叶cDNA为模板,进行RT-PCR扩增。扩增体系为:总体积10.0 μL,其中2×Taq PCR MasterMix 5.0 μL,primer-F(10 μM)0.5 μL,primer-R(10 μM)0.5 μL,cDNA 1.0 μL,ddH2O 3.0 μL。反应条件为:94 ℃初始变性5 min,94 ℃变性30 s,56 ℃退火30 s;72 ℃延伸20 s,35个循环,72 ℃最后延伸10 min。得到的PCR产物经2.0%琼脂糖凝胶电泳检测,在BIO-RAD凝胶成像仪观察拍照。
以柠檬色百合叶5个浓度梯度的cDNA及不同样本cDNA为模板,在BIO-RAD CFX96实时荧光定量PCR仪中对不同内参基因及PSY基因进行三步法荧光定量。扩增体系:总体积20.0 μL,其中qPCR SYBR®Green Master Mix 10.0 μL,primer-F(10 μM)0.4 μL, primer-R(10 μM)0.4 μL,cDNA 2.0 μL,ddH2O 7.2 μL。反应条件为:95 ℃预变性5 min,95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸30 s,40个循环。熔解曲线程序为:65 ℃~95 ℃每5 s升温0.5 ℃。
反应结束后由CFX Manager软件生成熔解曲线,根据熔解曲线分析候选内参基因引物特异性。根据各内参基因在不同柠檬色百合叶cDNA梯度下CT值绘制标准曲线并计算斜率(k)、扩增效率(E)和线性相关系数(R2),利用CFX Manager软件Gene Study程序中Pfaffl方法计算基于单个内参基因的PSY相对表达量,运用Vandesomple方法计算基于多个内参基因的PSY相对表达量,使用SPSS分析PSY相对表达情况与总类胡萝卜素积累间斯皮尔曼相关性。
1.6 数据分析及候选内参基因稳定性评价
整理全部样本中候选内参基因CT值,使用geNorm、NormFinder、ΔCT、Bestkeeper 程序和RefFinder网站(https:∥www.heartcure.com.au/reffinder/?type=reference)分析柠檬色百合花被片发育过程和不同器官间候选内参基因的表达稳定性。
geNorm程序将循环数转换为基因相对表达量,即将所有CT值转换为2ΔCT(ΔCT=各CT值-最小CT值),通过计算候选内参基因表达稳定值(M)来评估。M值与稳定性呈负相关,M值越小,稳定性越高,若M值超过1.5即认定该基因不适合作内参基因。之后计算出标准化所需的最佳内参基因数量,程序默认值为Vn/(n+1)=0.15,当Vn/(n+)<0.15,选择n个内参基因用于标准化[30]。
NormFinder与geNorm相似,根据表达稳定值进行稳定性排序,但只能选出1个稳定内参基因[31]。
ΔCT方法是比较成对基因在不同样本中ΔCT值,若在所有样本中这2个基因ΔCT值保持不变,则认为这2个基因在这些样本中稳定表达;若ΔCT变化,则表明其中1个基因或2个基因都表达不稳定。如此计算,最终根据结果进行稳定性排序[32]。
Bestkeeper程序首先根据标准偏差(SD)和变异系数(CV)对内参基因表达稳定性进行评估,从低到高依次进行稳定性排序。其中SD>1即视为不稳定内参基因,同时将所有输入候选内参基因组成1个Bestkeeper指数,计算每个候选内参基因和Bestkeeper指数之间的相关性,通过皮尔逊相关系数(r)、决定系数(r2)和显著水平P值(P)描述候选内参基因与Bestkeeper指数之间的关系[14]。
最后依托RefFinder在线网站基于以上4个程序结果,给每个候选内参基因分配1个适当权重,并计算它们权重的几何平均值,以获得最终的整体排名[33]。
2 结果与分析
2.1 总类胡萝卜素含量
在柠檬色百合花被片中,随着生长发育,花被片背景颜色由绿变黄,积累的总类胡萝卜素含量增加(图2(a));柠檬色百合叶子为绿色,茎和鳞片表面附着浅紫色,根为乳白色,总类胡萝卜素在不同器官间积累依次为:花被片>叶>茎>根>鳞片,且根和鳞片中含量极少(图2(b))。
2.2 引物特异性及扩增效率
以柠檬色百合叶cDNA为模板,用9个候选内参基因的引物进行RT-PCR扩增,电泳图显示片段大小正确,条带单一,均无引物二聚体(图3(a))。以5个浓度梯度的柠檬色百合叶cDNA 为模板,进行qRT-PCR反应,结果显示,熔解曲线均为单一信号峰,且同一样品重复性好,表明9个候选内参基因引物特异性高(图3(b)~(j))。根据qRT-PCR反应所得CT值绘制标准曲线,9个候选内参基因的相关系数R2介于0.988 4~0.997 0之间,扩增效率介于91.02%~102.98%之间(表1)。
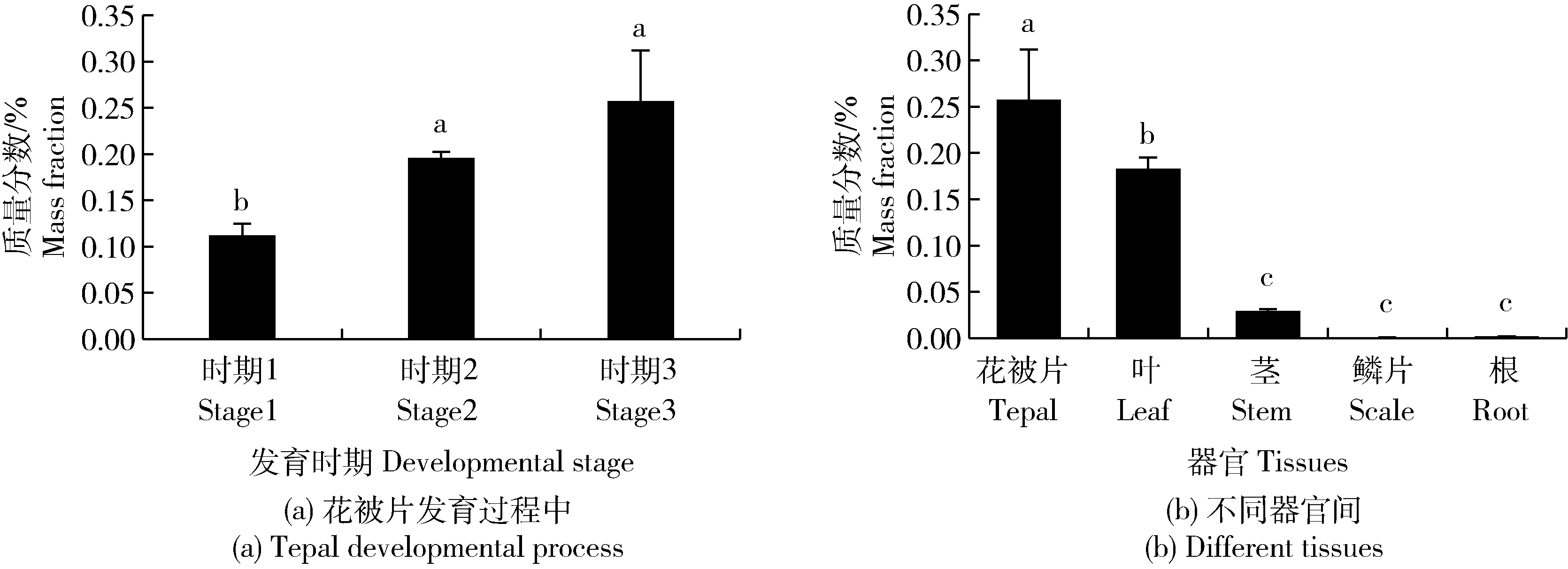
同一图中不同字母表示差异显著(P<0.050),相同字母表示差异不显著(P>0.050)。 Within the same graph, different letters represent significant differences (P<0.050), while the same letters represent no significant differences (P>0.050).图2 总类胡萝卜素含量Fig.2 Total carotenoid content
2.3 表达水平分析
利用所有样本中得到的CT值可以预测9个候选内参基因的表达水平。CT值越低,表达丰度越高,9个候选内参基因在花被片发育过程和不同器官间的CT值分布见图4。结果表明:18S表达丰度最高,eIF和UBC的表达水平变异最小。
2.4 稳定性分析
将geNorm和NormFinder结果按照M值排序,ΔCT结果按照平均标准偏差排序。Bestkeeper结果中,按SD从小到大、CV从低到高依次进行稳定性排序,同时考虑候选内参基因与Bestkeeper指数间r和P值。若2个内参基因间SD值相近、CV值也相近,则将r值低的内参基因排在后面;若候选内参基因SD>1则视为不稳定内参基因,候选内参基因与Bestkeeper指数间P>0.05也视为不稳定内参基因(表2)。
由于不同程序算法不同,所得结果并不一致,用RefFinder网站对上述程序结果进行综合分析确定最终内参基因稳定性排序。
2.4.1柠檬色百合花被片发育过程中候选内参基因稳定性分析
柠檬色百合花被片发育过程所得Bestkeeper结果中,虽然UBC的SD最小,CV最低,但其与相应Bestkeeper指数相关系数的P值为0.507,远大于0.050,表明UBC与Bestkeeper指数不相关;而其余8个候选内参基因与Bestkeeper指数相关系数的P值均为0.001,r值在0.876~0.996之间,表明这8个候选内参基因与Bestkeeper指数间相关性强且呈极显著相关。说明在柠檬色百合花被片发育过程中,UBC与其它候选基因存在较大差异,不适合作内参基因。CYP的SD值>1.00,为不稳定内参基因(表2)。
geNorm计算最稳定的内参基因为AP4和β-TUB(图5(a)),NormFinder计算最稳定的内参基因为β-TUB(图5(c)),ΔCT计算最稳定的内参基因为Actin(图5(d)),Bestkeeper计算最稳定的内参基因为eIF(表2),综合以上4个程序的结果判断最不稳定的内参基因为UBC。geNorm程序默认Vn/(n+1)=0.15,柠檬色百合花被片发育过程中计算得V2/3配对变异系数为0.06,小于0.15,故柠檬色百合花被片发育过程中荧光定量标准化所需的最佳内参基因数为2(图5(b))。RefFinder综合以上4个程序分析结果,计算得柠檬色百合花被片发育过程最稳定的内参基因为Actin和AP4(表3)。
2.4.2柠檬色百合不同器官间候选内参基因稳定性分析
柠檬色百合不同器官间所得Bestkeeper计算结果中,9个候选基因与相应Bestkeeper指数间显著相关。β-TUB和18S的SD>1.00,为不稳定内参基因(表2)。geNorm计算最稳定的内参基因为AP4和Actin(图6(a)),NormFinder和ΔCT计算最稳定的内参基因为eIF(图6(c)和(d)),Bestkeeper计算最稳定的内参基因为AP4(表2)。geNorm程序计算的V2/3配对变异系数为0.15,故至少需要2个内参基因用于柠檬色百合不同器官间标准化(图6(b))。根据RefFinder综合分析,计算得柠檬色百合不同器官间最稳定的内参基因为eIF和AP4,最不稳定的内参基因为18S(表3)。

RFU:相对荧光定量值。RFU: Relative fluorescence units.图3 候选内参基因引物特异性Fig.3 Amplification specificity of primers

中间横线表示中位数。 The middle horizontal line is the median.图4 9个候选内参基因的CT值分布图Fig.4 Distribution of CT values of candidate reference genes in all samples
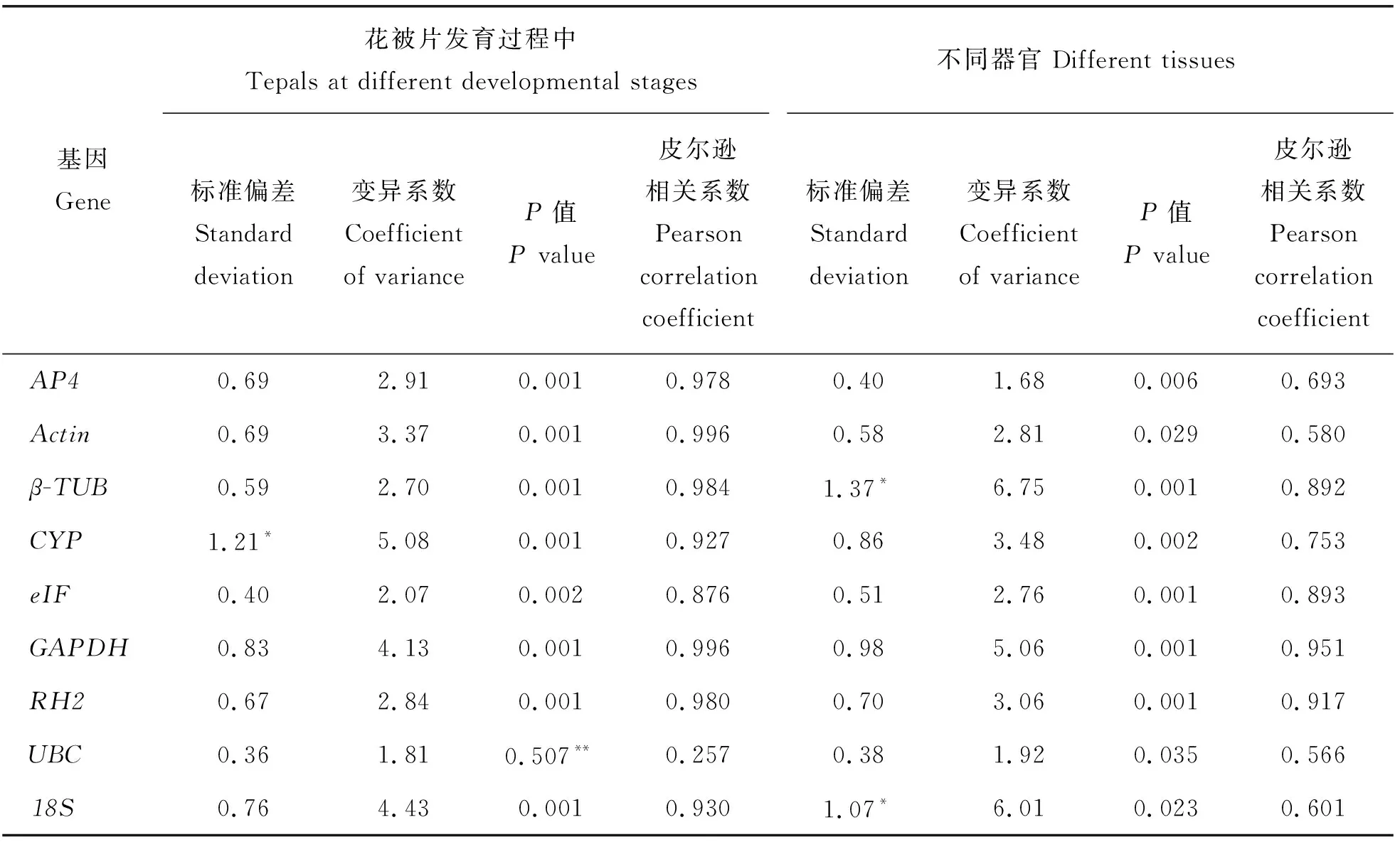
表2 Bestkeeper分析候选内参基因稳定性Table 2 Expression stability values of candidate reference genes calculated by Bestkeeper
将以上程序和网站计算的9个候选内参基因在柠檬色百合花被片发育过程与不同器官间表达稳定性由高到低排序(表3)。
2.5 检测PSY基因表达验证内参基因稳定性
在柠檬色百合花被片发育过程中,以稳定的Actin和AP4分别或共同作为内参基因对PSY基因相对表达量进行计算(图7(a)~(c))。结果表明,随着花被片发育,PSY基因表达逐渐升高,变化趋势和总类胡萝卜素含量变化趋势一致。而以最不稳定的UBC作为内参基因计算时,在S1中,PSY基因表达最高且S3中PSY表达最低,与以Actin和AP4作为内参基因计算的结果相反(图7(d))。该结果再次证实柠檬色百合花被片发育过程中UBC不适合作为内参基因。
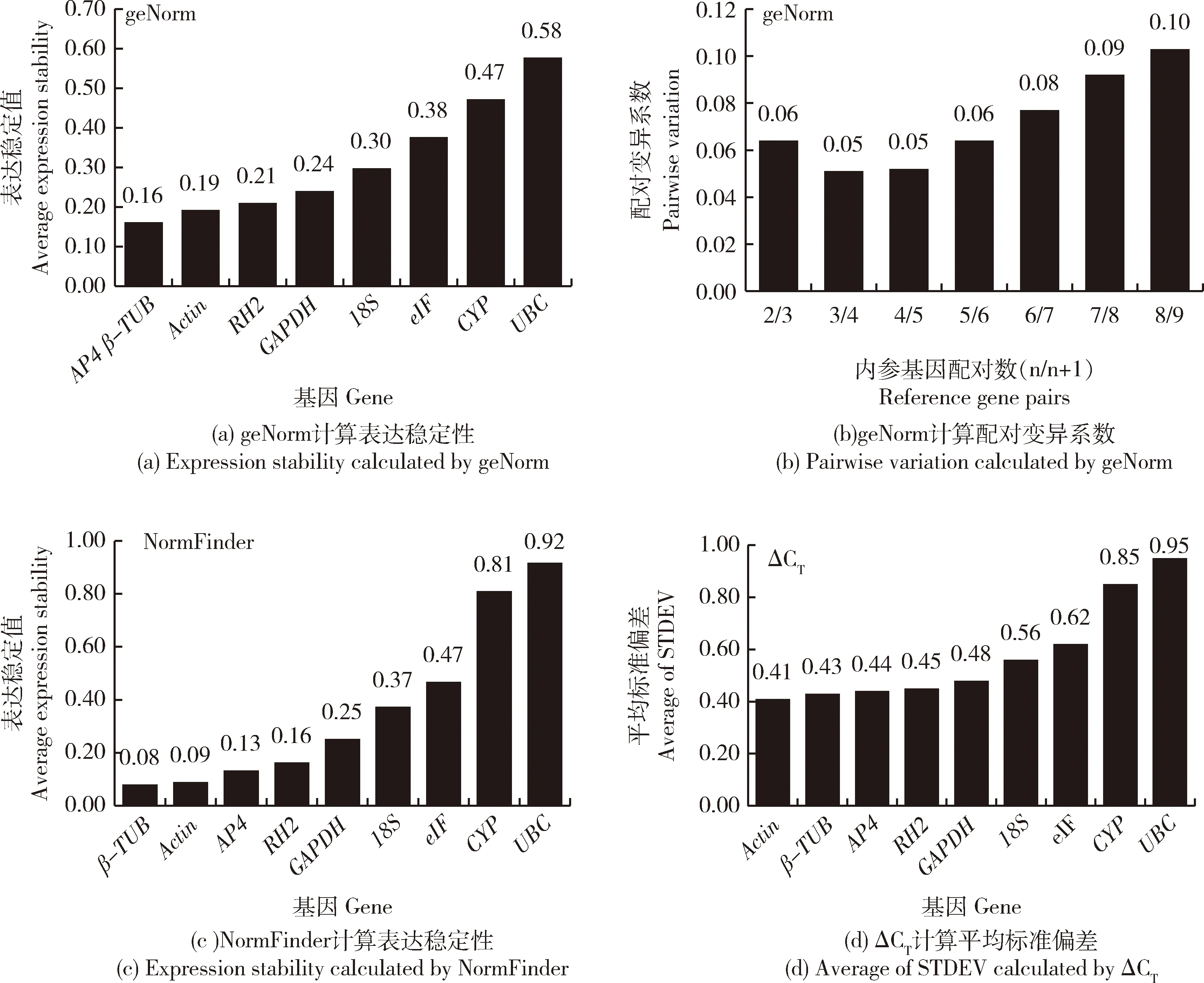
图5 不同程序分析花被片发育过程中候选内参基因稳定性Fig.5 Expression stability values of candidate reference genes analyzed by different applications in tepals at different developmental stages
在柠檬色百合不同器官间,以表达稳定的eIF和AP4单独或共同作为内参基因对PSY基因进行相对表达量计算(图7(e)~(g))。结果显示,PSY基因表达的总体趋势与总类胡萝卜素积累的趋势相同,表达情况由高到低依次为花被片、叶、茎、根和鳞片。用最不稳定的18S作为内参基因进行计算,PSY表达情况与总类胡萝卜素积累趋势有所不同,表达量由高到低依次为花被片、茎、叶、根和鳞片(图7(h))。
同时,利用SPSS做PSY基因表达与总类胡萝卜素含量斯皮尔曼相关性分析(表4)。结果显示,在柠檬色百合花被片发育过程中,以Actin和AP4单独或综合作为内参基因计算所得PSY基因表达情况与总类胡萝卜素含量呈极显著正相关,以UBC为内参基因计算所得PSY基因表达情况与总类胡萝卜素含量呈极显著负相关。在柠檬色百合不同器官间,以eIF和AP4单独或综合作为内参基因计算所得PSY基因表达与总类胡萝卜素含量呈极显著正相关,以18S为内参基因计算所得PSY基因表达情况与总类胡萝卜素含量呈显著正相关。
3 讨 论
3.1 使用稳定表达内参基因是获得准确基因表达结果的关键
在花被片发育过程中,‘Tiny Padhye’百合中TIP41和Actin稳定性高[23],而本研究柠檬色百合中,Actin和AP4稳定性高;在不同器官和组织间,Liliumdavidiivar.unicolor中Actin、GAPDH和UBQ稳定性高[22],‘Tiny Padhye’中Actin、Actin11和EF1-α稳定性高[23],本研究中柠檬色百合eIF和AP4稳定性高。由此可见,不同品种的百合在相同试验条件下的最佳稳定内参基因有所不同。
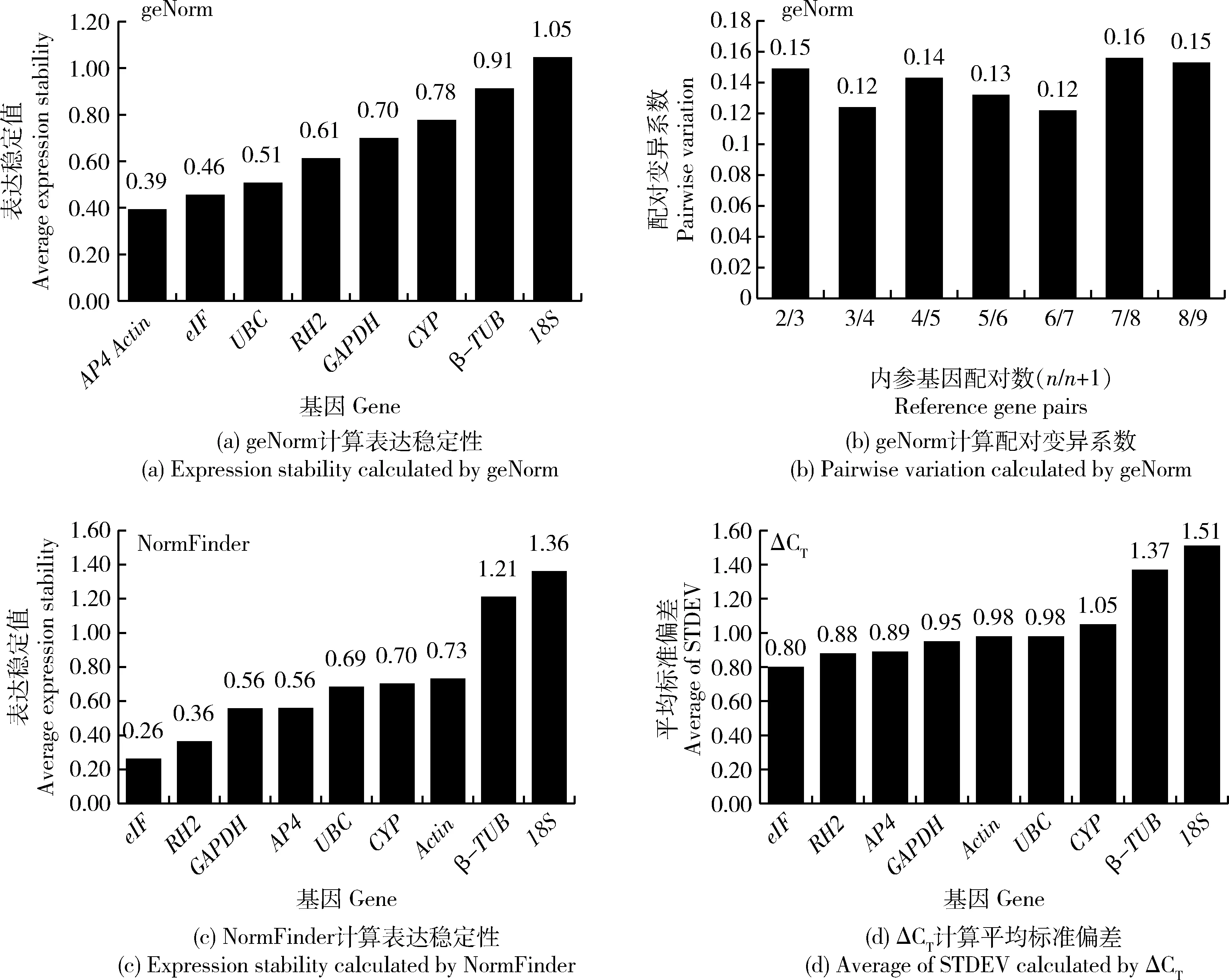
图6 不同程序分析不同器官间候选内参基因稳定性Fig.6 Expression stability values of candidate reference genes analyzed by different applications in different tissues
本研究为验证候选内参基因评估结果的准确性,不仅基于稳定的内参基因探究PSY表达情况,同时也基于不稳定的内参基因对PSY表达进行计算。结果表明,无论是在柠檬色百合花被片发育过程中还是不同器官间,单独使用稳定性差的内参基因会导致结果不准确。在柠檬色百合花被片发育过程中,使用稳定性差的UBC作为内参基因计算所得结果与使用稳定性高的内参基因Actin和AP4计算结果相反;在不同器官间使用稳定性差的18S作为内参基因计算时,茎中PSY表达高于叶中,与实际情况相反。因此,在进行基因表达分析时,为了得到准确结果需要先进行稳定内参基因的筛选。
3.2 内参基因稳定性评估需综合多个方法分析并进行试验验证
在进行内参基因稳定性评估时,不同程序得到的结果并不相同,这是因为不同程序基于不同的算法和假设。geNorm程序建立在候选内参基因间无共表达的条件下展开,计算每一个候选内参基因与其他候选内参基因两两间变异系数,将这些变异系数的平均值定义为该基因的表达稳定值[30];NormFinder是结合组内方差与组间方差计算候选内参基因的稳定值[31];ΔCT方法将所有候选内参基因两两组对为“基因对”,比较“基因对”在不同样本间的相对表达[32];Bestkeeper程序是对每个候选内参基因在所有样本中的CT值进行描述性统计,同时也将所有候选内参基因综合为1个Bestkeeper指数,计算每个候选内参基因与该指数之间相关性[14]。为了解决以上不同程序所得结果差异的问题,Xie等[33]将这4种分析方法整合成1个网络分析工具RefFinder,对以上4个程序的结果进行综合评价。本研究使用geNorm、NormFinder、ΔCT和Bestkeeper程序分别对候选内参基因稳定性进行评估,并最终使用RefFinder网站对以上4个程序结果进行了综合分析,确定了柠檬色百合花被片发育过程及不同器官间qRT-PCR稳定内参基因。


(a)~(d)PSY基因在花被片发育过程中表达情况;(e)~(h)PSY基因在不同器官间表达情况。(a) to (d) The expression of PSY in tepals at different developmental stages; (e) to (h) The expression of PSY in different tissues.图7 PSY基因相对表达量Fig.7 Relative expression patterns of PSY

表4 PSY基因相对表达与总类胡萝卜素含量之间斯皮尔曼相关性Table 4 The spearman correlation coefficient of PSY relative expression patterns and carotenoid content
上述程序中,geNorm与Bestkeeper均倡导多内参基因策略,以此减少因某内参基因使用不当所造成的误差,使计算的目的基因表达模式更接近真实水平。本研究以geNorm计算的所需内参基因数量为准,在柠檬色百合花被片发育过程及不同器官间均使用最稳定的2个候选内参基因对PSY基因相对表达量进行计算。
前人在使用Bestkeeper程序对候选内参基因进行稳定性评估时,常常默认以SD为主CV为辅进行稳定性排名,并没有考虑Bestkeeper指数含义,没有顾及到候选内参基因与Bestkeeper指数间的关系[34]。本研究在计算柠檬色百合花发育过程中9个候选基因稳定性时,虽然UBC的SD最小,CV最低,按照已有研究中常用的方法应该将其认定为该条件下最稳定的内参基因。但研究发现,UBC与相应Bestkeeper指数相关系数的P值远大于0.050,无相关性,其余8个候选内参基因与该指数相关系数的P值均为0.001,r值在0.876~0.996之间,表明这8个候选内参基因与该指数间相关性强且相关性显著。因此,在柠檬色百合花发育过程中UBC并不适合作内参基因。此外,以UBC作为内参基因,用Pfaffl方法计算柠檬色百合花被片发育过程中PSY基因表达量由高到低依次为:S1>S2>S3,与其真实表达趋势相反,进一步佐证了UBC的不稳定性。同时也说明不正确使用和分析Bestkeeper程序输出信息,会影响对候选内参基因稳定性的判断。
4 结 论
本研究选用9个候选内参基因,研究其在柠檬色百合花被片发育过程及不同器官间的表达情况,通过不同程序和网站计算稳定性排序及验证试验,最终确定,进行荧光定量PCR试验时,在柠檬色百合花被片发育过程中检测目的基因表达情况需使用Actin和AP4作为内参基因;而在柠檬色百合不同器官间检测目的基因表达情况需使用eIF和AP4作为内参基因。如此才能够既稳定又正确地反映目的基因表达量。
