36份新选育玉米自交系抗瘤黑粉病鉴定及抗性遗传初步分析
2023-01-17肖明纲
肖明纲
(黑龙江省农业科学院生物技术研究所 博士后工作站,黑龙江 哈尔滨 150086)
玉米瘤黑粉病是由玉蜀黍黑粉菌(Ustilagozeae(Beckm.)unger)侵染引起的一种世界性玉米病害,土壤、气流和种子均可传播。玉米瘤黑粉病是非系统侵染病害,在玉米生长的各个阶段均可发生。玉蜀黍黑粉菌主要通过伤口侵染植株的所有地上组织,被侵染部位形成形状各异、大小不一的肿瘤[1]。瘤黑粉病是我国玉米生产中的重要病害,在我国普遍发生[1-2],发病率一般5%~10%,严重时可造成30%~80%的产量损失[3]。近年来,多年秸秆还田、西北玉米区常年连作及推广品种缺乏抗病性等原因导致土壤中病害初侵染源急剧增加,各地瘤黑粉病发生呈逐渐加重趋势,特别是在夏玉米区和西北玉米制种区,瘤黑粉病对玉米生产的影响越来越大[4-8]。河北省隆尧县2014年玉米瘤黑粉病大发生,田间植株发病率高达14.5%,严重降低玉米产量[9]。2015年由于玉米品种抗性弱,连年重茬造成病原菌积累,玉米瘤黑粉病在云南省大关县大发生,一般地块发病率达到3%~8%,严重地块产量损失达30%~40%[10]。2016年玉米抽雄后强烈降雨导致河北省玉米瘤黑粉病大面积暴发,果穗感病严重,造成玉米大面积减产达50%以上[11]。因气候条件适宜,再加之感病品种的种植,玉米瘤黑粉病在安徽省北部地区的发病率呈逐年上升趋势,自然发病率从2011—2016年由3.5%上升到5.3%,严重影响当地玉米生产[12]。2014—2016年期间,东北三省前期高温干旱,中后期低温多雨,导致玉米瘤黑粉病普遍发生,受侵染玉米面积高达995.33 万hm2。其中,黑龙江省玉米瘤黑粉病发病最为严重,造成的经济损失也最大[13]。2015—2017年玉米瘤黑粉病在甘肃省天水市各玉米产区普遍发生,田间病株率在5%~12%,严重地块造成玉米减产率高达15%以上[14]。国家玉米产业技术体系2019年调研结果表明,玉米瘤黑粉病的发生和危害在东北各玉米产区逐年加重。因此,防治玉米瘤黑粉病的发生和危害是玉米减损增效的重要举措。
选育抗病品种是控制玉米瘤黑粉病发生和危害最经济有效的措施,而丰富的抗病种质资源则是抗病育种的材料基础。为此,国内很多学者对于玉米瘤黑粉病抗性种质资源筛选和鉴定做了大量工作。姜晓颖等[15]对21个骨干自交系人工接种鉴定,发现17份抗病材料,其中9份材料高抗玉米瘤黑粉病。薛春生等[16]采用人工接种方法,评价了19个玉米骨干自交系对瘤黑粉病的抗性,发现8份抗病材料,占比为42%。段灿星等[17]对836份玉米种质资源进行了抗玉米瘤黑粉病鉴定与评价,共筛选出275份抗玉米瘤黑粉病材料,占鉴定总材料的32.9%。严理等[18]采用苗期注射人工接种方法对22个玉米品种瘤黑粉病抗性初步鉴定表明,高抗和中抗品种各2个,抗病品种12个,抗病品种占比较高,达到73%。王泽浩[6]采用冬孢子粉菌土法评价了45份玉米品种亲本对瘤黑粉病的抗性,鉴定结果表明,所有材料对瘤黑粉病都具有抗性。贾娇等[19]田间调查了71份新选玉米自交系对瘤黑粉病的抗性,85.9%的材料对玉米瘤黑粉病具有抗性,其中高抗材料36份,抗病材料24份。施艳等[20]评价了河南省2015—2017年456份玉米区域试验参试品种对瘤黑粉病的抗性水平,结果表明,玉米瘤黑粉病抗病品种鉴定结果在不同年份中差异较大,2015年和2016年以感病品种为主,2017年以中抗品种为主。周天旺等[21]利用田间人工接种方法评价了47份鲜食玉米对瘤黑粉病的抗性,结果表明,鲜食玉米新品种中抗瘤黑粉病品种比较丰富,47份鲜食玉米杂交种中仅有5份材料表现感病。郭成等[22]于2019年通过人工接种对42份鲜食玉米进行田间抗性鉴定,在鲜食玉米上,对瘤黑粉病抗性品种较为匮乏,42份品种中仅有5份材料表现抗病。于玲玲等[23]对新选育的20份玉米自交系进行抗瘤黑粉病鉴定,结果表明,仅有H7、H9、H12、H13和H19等5份材料抗玉米瘤黑粉病。王铁兵等[24]研究了30份玉米自交系对瘤黑粉病的抗病性,发现仅有7份材料表现为抗病,其余23份均表现为感瘤黑粉病。段灿星等[25]首次对2 000份来源广泛且遗传背景丰富的玉米种质资源进行了多年多点玉米瘤黑粉病的田间自然发生条件下抗病性鉴定,结果表明,玉米瘤黑粉病的发生受环境条件影响较大,需要后续人工接种精准鉴定。张文洁[26]利用人工注射接种瘤黑粉冬孢子的方法对204份玉米自交系进行瘤黑粉病抗性鉴定,结果表明,抗性材料较少,占比仅为34.31%,感病自交系所占比例较大,达到65.69%,且不同玉米种质对瘤黑粉病的抗性存在差异。
随着基因组学和生物信息学的发展,国内外学者开展了玉米抗病基因定位与克隆工作,但关于玉米瘤黑粉病抗性基因定位和克隆的研究较少。Lübberstedt等[27]采用复合区间作图法,利用122个RFLP标记进行了玉米抗瘤黑粉病的QTL定位,共发现19个不同的QTLs。Kerns等[28]采用单因素回归分析法,利用146个RFLP标记对玉米瘤黑粉病进行了QTL定位,鉴定出5个与瘤黑粉病相关的染色体区段。Baumgarten等[29]利用重组自交系群体,定位到了抗玉米瘤黑粉病的QTLs,这些抗病相关位点分布在除第6染色体以外其余9条染色体上。Ding等[30]利用重组自交系群体,定位到6个加性效应QTLs,分布在第3、5、8染色体上。吕爱枝等[31]的片段代换系研究结果则显示,chr3-7、chr3-1和chr3-6分别在phi046(bin3.08)、phi049(bin3.01)和umc1644(bin3.06)位点表现为高抗、中抗和感病。姬东华[32]以F2∶3家系为作图群体,采用复合区间作图法初步定位玉米瘤黑粉病相关抗性基因,共检测到5个QTLs,表型贡献率范围为1.97%~28.68%。梁爽[13]利用Ici Mapping软件对玉米瘤黑粉病进行QTL定位分析,结果共检测到6个玉米抗瘤黑粉病QTLs,表型贡献率为4.729 7%~7.612 8%。
目前玉米瘤黑粉病在我国各玉米种植区发生越来越普遍,危害也越来越严重,针对这种情况,我们利用人工接种方法,对新选育的32份玉米种质资源进行玉米瘤黑粉病抗性鉴定和评价,并对高抗种质资源进行连续多年鉴定,探究其真实抗性水平,以期为玉米抗瘤黑粉病新品种培育筛选有效种质资源;利用F2群体对高抗瘤黑粉病材料进行抗性遗传分析并初步定位抗病基因,丰富抗玉米瘤黑粉病基因资源,为抗病基因的进一步利用奠定基础。
1 材料与方法
1.1 供试自交系
36份新选育的稳定玉米自交系。抗病鉴定对照材料齐319高抗玉米瘤黑粉病,掖478高感玉米瘤黑粉病。2018—2020年连续3 a对这些玉米材料进行了抗瘤黑粉病鉴定,抗性评价以3 a数据最高级别计算。
1.2 供试病原菌
玉蜀黍黑粉菌(Ustilagozeae)分离自黑龙江省玉米发病组织,由本课题组采集、分离、纯化、培养并保存。
1.3 抗病鉴定圃设置
玉米抗瘤黑粉病鉴定圃设在哈尔滨呼兰区,鉴定材料顺序排列,每份材料种植4行,行长5 m,行距0.65 m,每行留25~30株,株距略小于大田生产,每份材料至少保苗100株,田间正常管理。在玉米展6~8叶期,采用注射法接种,7 d后进行第2次接种,乳熟后期进行抗性调查。
1.4 人工接种及抗性评价
接种体制备、具体接种方法、反应分级及抗性评价标准参见《玉米病虫害田间鉴别手册》[1]。
1.4.1 玉米瘤黑粉病接种体准备
在田间采集玉米瘤黑粉病植株上的未破裂菌体,放置通风处阴干,在干燥条件下保存。接种前,将保存的瘤体破碎,并将厚垣孢子团充分碾碎,用50目细箩过筛,使病原菌成为均一的菌粉。在直径90 cm培养皿中放置2~3层滤纸并充分浸润,每皿均匀撒入0.2 g菌粉。25 ℃下保湿72 h,然后将每皿的菌粉洗入1 L水中,配制成浓度约为1×105孢子·mL-1接种液,接种液中加入0.5 g·L-1的葡萄糖[1]。
1.4.2 玉米瘤黑粉病人工接种方法
在玉米6~8叶期时采用注射法人工接种。接种时,在植株中部接近生长点的部位从外向内且刺入心叶内,每株注射菌液2 mL。1周后进行第二次接种,接种后田间正常管理[1]。
1.4.3 玉米瘤黑粉病抗性评价
在玉米进入乳熟后期进行调查,逐株调查每份材料,分别记载调查总株数、发病株数,计算和记载发病株率。发病株率0%~1.0%为1级(HR),发病株率1.1%~5.0%为3级(R),发病株率5.1%~10.0%为5级(MR),发病株率10.1%~40.0%为7级(S),发病株率40.1%~100%为9级(HS)[1]。
1.5 高抗玉米瘤黑粉病材料抗性遗传初步分析
用高抗玉米材料与感病自交系掖478杂交,产生F2分离群体,在玉米6~8叶期时人工接种相应的F2群体和感病对照掖478,1周后第二次人工接种,乳熟后期调查每个F2单株发病状况[1]。计算各群体抗、感个体的分离比例,用SAS 8.2软件(SAS Institute,Raleigh,NC,USA)计算分离比例的χ2值和概率值,进行分离比例的适合性测验。
2 结果与分析
2.1 引进材料对瘤黑粉病的抗性鉴定与评价
2018年和2019年连续2 a采用注射法评价了36份玉米自交系对瘤黑粉病的抗性,抗病对照齐319发病株率分别为0和0.8%,表现为高抗,感病对照掖478感病株率为89.3%和89.1%,表现为高感,抗、感对照发病率差异明显,鉴定结果有效。在36份待鉴定材料中,共筛选到19份玉米自交系对瘤黑粉病具有抗性,占鉴定材料的52.8%。其中高抗材料11份(Z16HEB-325、Z16HEB-328、Z16HEB-330、Z16HEB-333、Z16HEB-339、Z16HEB-342、Z16HEB-347、Z16HEB-349、Z16HEB-350、Z16HEB-352和Z16HEB-356),占鉴定材料的30.6%;中抗材料2份(Z16HEB-335和Z16HEB-345),占鉴定材料的5.6%;抗病材料6份(Z16HEB-322、Z16HEB-324、Z16HEB-326、Z16HEB-337、Z16HEB-344和 Z16HEB-354),占鉴定材料的16.7%;感病材料11份(Z16HEB-323、Z16HEB-327、Z16HEB-331、Z16HEB-334、Z16HEB-336、Z16HEB-338、Z16HEB-340、Z16HEB-341、Z16HEB-346、Z16HEB-348和Z16HEB-353),占鉴定材料的30.6%;高感材料6份(Z16HEB-321、Z16HEB-329、Z16HEB-332、Z16HEB-343、Z16HEB-351和Z16HEB-355),占鉴定材料的16.7%(图1)。鉴定结果表明,在新选育的36份玉米材料中,有丰富的玉米瘤黑粉病抗源,可用于抗病亲本的选育及抗病材料的改良,以减轻玉米瘤黑粉病的危害,减少制种成本,提高制种产量。

图1 新选玉米自交系瘤黑粉病抗性级别分布
2.2 外引高抗材料抗玉米瘤黑粉病重复鉴定
2020年对11份高抗玉米瘤黑粉病材料又进行了重复鉴定,感病对照掖478发病株率为87.1%,抗病对照齐319发病株率为0,抗、感对照充分发病,人工接种鉴定有效。结果发现,自交系Z16HEB-325、Z16HEB-328、Z16HEB-330、Z16HEB-333、Z16HEB-339、Z16HEB-342、Z16HEB-347、Z16HEB-349、Z16HEB-350、Z16HEB-352和Z16HEB-356共11份材料3 a间玉米瘤黑粉病抗性表现稳定,反映了其真实抗性水平(表1)。这些自交系可作为玉米抗瘤黑粉病的重要抗性资源,以拓展我国玉米抗瘤黑粉病种质的遗传基础。
2.3 高抗玉米瘤黑粉病材料抗性遗传分析
11份高抗自交系与感病对照掖478配制杂交组合,人工接种F2群体,F2单株对玉蜀黍黑粉菌的抗感表现结果表明,组合掖478/Z16HEB-325、掖478/Z16HEB-333、掖478/Z16HEB-339、掖478/Z16HEB-347和掖478/Z16HEB-352的F2群体抗感植株比例都符合3∶1的分离比,而组合掖478/Z16HEB-328、掖478/Z16HEB-330、掖478/Z-16HEB-342、掖478/Z16HEB-349、掖478/Z16HEB-350和掖478/Z16HEB-356的F2群体抗、感植株比例不符合3∶1的分离比(表2),说明自交系Z16HEB-325、Z16HEB-333、Z16HEB-339、Z16HEB-347和Z16HEB-352对玉蜀黍黑粉菌的抗性可能受1对显性单基因控制。
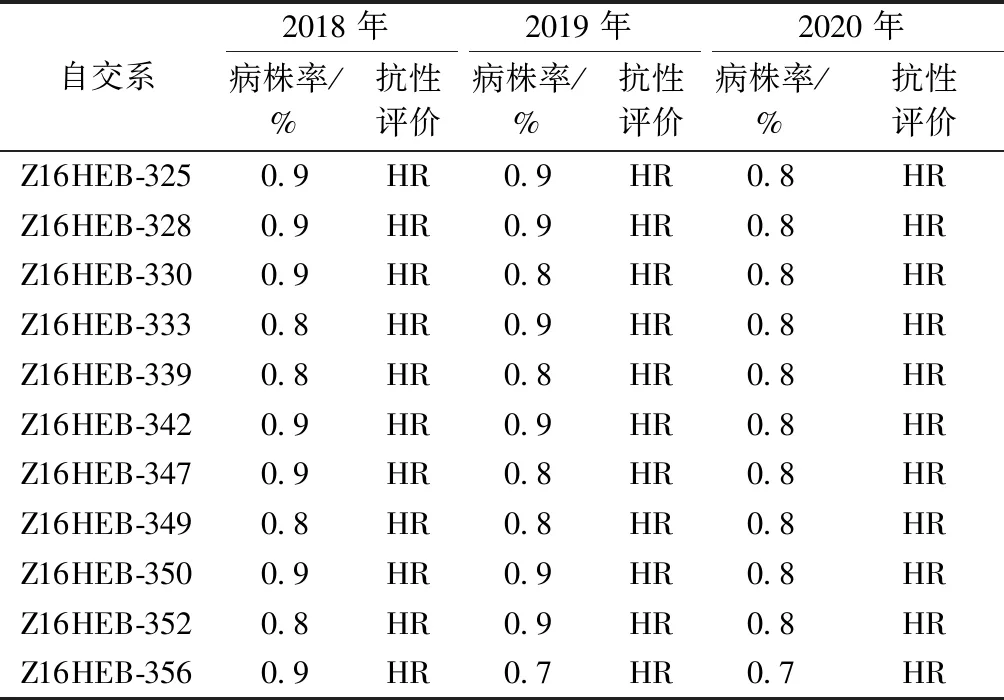
表1 11份玉米自交系对玉米瘤黑粉病多年抗性鉴定

表2 11个F2群体对玉蜀黍黑粉菌的抗性反应
3 小结与讨论
玉米瘤黑粉病属于土传病害,一旦传入就很难根除,防治起来也十分困难。玉米瘤黑粉病在整个生育期都能发生,田间喷药也很难奏效,同时从生产成本和环境保护角度看,化学方法也不能作为防治玉米瘤黑粉病的首选措施。
连续2 a人工接种鉴定评价了36份玉米自交系对瘤黑粉病的抗性,共筛选到19份玉米自交系对瘤黑粉病具有抗性,占鉴定材料的52.8%,其中高抗材料11份,且抗性稳定,感病材料17份,占鉴定材料的47.2%。这些抗病资源将会在一定程度上拓宽我国玉米抗病种质遗传基础,对我国玉米抗病资源创制及抗病品种培育具有重要的应用价值。
11份高抗自交系与感病对照掖478配制杂交组合,人工接种F2群体,利用F2群体抗感表现型对11份高抗玉米瘤黑粉病材料进行抗性遗传分析,结果表明,组合掖478/Z16HEB-325、掖478/Z16HEB-333、掖478/Z16HEB-339、掖478/Z16HEB-347和掖478/Z16HEB-352的F2群体抗感植株比例都符合3∶1的分离比(表2),说明自交系Z16HEB-325、Z16HEB-333、Z16HEB-339、Z16HEB-347和Z16HEB-352对玉蜀黍黑粉菌的抗性可能受1对显性单基因控制。
尽管质量抗性基因和数量抗性基因有着明显的不同,但是在某些情况下,质量抗性基因更像是一个主效QTL[33-34]。自交系Z16HEB-325、Z16HEB-328、Z16HEB-330、Z16HEB-333、Z16HEB-342、Z16HEB-347、Z16HEB-350、Z16HEB-352和Z16HEB-356年际间感病植株百分率均有波动,而自交系Z16HEB-339和Z16HEB-349年际间感病植株百分率比较恒定,均为0.8%(表1),但病瘤数量、病瘤大小和病瘤产生部位可能有差异。仅根据病情级别,自交系Z16HEB-325、Z16HEB-333、Z16HEB-339、Z16HEB-347和Z16HEB-352对瘤黑粉病的抗性可能受一对显性单基因控制,而如果综合考虑病情级别、病瘤大小、病瘤数量、危害程度及环境因素,自交系Z16HEB-325、Z16HEB-333、Z16HEB-339、Z16HEB-347和Z16HEB-352对瘤黑粉病的抗性也可能受少数主效QTLs控制,存在微效基因的作用。下一步将重点开展质量单基因或主效QTL位点的定位。
