经颅直流电刺激对卒中后失眠的疗效
2023-01-17顾彬黄富表李泓钰宋鲁平
顾彬,黄富表,李泓钰,宋鲁平
1.首都医科大学康复医学院,北京市 100068;2.中国康复研究中心北京博爱医院,北京市 100068;3.宁夏医科大学总医院,宁夏银川市 750003;4.深圳大学总医院,广东深圳市 518071
0 引言
脑卒中可导致睡眠调节相关脑结构受损,引起睡眠效率降低,睡眠觉醒周期异常等问题。卒中后失眠(post-stroke insomnia,PSI)发生率为20%~59.5%,不仅降低患者体力,影响神经系统功能康复,而且增加脑卒中再发、认知下降、焦虑抑郁状态、自杀等身心风险,对患者生活质量造成影响,可贯穿脑卒中发生、发展、结局全过程[1-4]。
目前,临床上PSI 干预首选药物治疗[5],辅助以睡眠健康综合教育[6]、认知行为治疗[7]、经颅磁刺激(transcranial magnetic stimulation,TMS)[8]等方法,以期达到最佳治疗效果。经颅直流电刺激(transcranial direct current stimulation,tDCS)与TMS 同属非侵入性神经调控技术,两者机制相近且各有优势。tDCS 通过恒定、低强度直流电对神经元膜电位进行阈下调制,改变大脑皮质兴奋性,具有无创便捷、费用低、副作用少等优势,被应用于治疗脑卒中后情绪障碍[9]和睡眠障碍[10]。本研究拟观察tDCS 对PSI患者睡眠及情绪的影响。
1 资料与方法
1.1 一般资料
本研究使用PASS (Power Analysis and Sample Size)软件计算样本量,以匹兹堡睡眠质量指数量表(Pittsburgh Sleep Quality Index,PSQI)为主要评价方法,检索相关文献,将治疗前后的匹兹堡睡眠质量指数平均数及标准差输入软件后,设置α(检验标准)=0.05,1-β(检验效能)=0.9。结果显示每组样本量为18,考虑到20%脱失率,每组各纳入22例。
选择2019 年11 月至2021 年5 月北京博爱医院神经康复中心接收的PSI 患者44 例。脑卒中诊断符合全国第四届脑血管病学术会议制定的脑卒中诊断标准[11],经头部CT 或MRI 扫描证实;失眠诊断符合《中国失眠症诊断与治疗指南2017 版》制定的诊断标准[12]。PSI 的诊断需同时满足脑卒中和失眠的诊断标准[13]。
纳入标准:①失眠出现在卒中后;②脑出血和脑梗死,病程在1 个月以上;③年龄≥ 18 岁;④意识清楚、查体合作、能保持坐位30 min以上,能配合完成各种测试;⑤无疼痛等影响睡眠的其他因素;⑥研究对象及家属签署知情同意书。
排除标准:①短暂性脑缺血发作;②卒中前有失眠、焦虑、抑郁等病史;③中重度认知障碍及失语;④无法配合康复治疗;⑤刺激部位不适合佩戴tDCS,如颅骨空洞、裂缝或修补等;⑥不能配合本研究的各种情况。
脱落标准:由于各种原因,如紧急事件、缺乏疗效、副作用、研究对象主动退出等,无法完成所有过程而提前退出。
采用随机数字表法将纳入患者分为对照组(n=22)和试验组(n=22),每组脱落2 例。两组性别、年龄、病程、卒中类型和病灶侧别均无显著性差异(P>0.05)。见表1。

表1 两组一般资料比较
本研究经中国康复研究中心医学伦理委员会审批通过(No.2019-32-1),所有研究对象均对本研究知情同意并签署知情同意书。
1.2 方法
两组均采用常规治疗。试验组行tDCS 真刺激,每天1 次,每周5 d,共4 周。对照组进行与试验组刺激部位、时间、频次相同的tDCS假刺激。
1.2.1 常规治疗
包括常规药物治疗、康复治疗和康复护理。根据患者病情给予对症药物治疗;根据个体功能障碍情况给予常规康复治疗,包括作业治疗、物理治疗等;针对失眠症状给予相应的常规护理策略,包括控制患者白天睡眠时间、创造良好的夜晚睡眠环境、疏导不良情绪、开展健康宣教等。
1.2.2 tDCS
睡前在病房中行tDCS 治疗。室内环境要求安静舒适,无其他刺激。整个过程中患者保持清醒,平静坐位或卧位,不执行任何附加任务。采用JX-tDCS-1型tDCS设备(江西华恒京兴医疗科技有限公司),阳极放在F3 区(国际10-20 脑电图系统),即左侧背外侧前额叶皮质(dorsolateral prefrontal cortex,DLPFC),阴极放在F4 区,即右侧DLPFC。tDCS 真刺激通电电流2 mA,刺激持续时间每次20 min;假刺激仅在刺激开始前15 s 通电,之后程序自动断电,其他参数与真刺激相同。试验过程中如发现患者出现不适、注意力过于分散或者疼痛等,则对患者的不良反应进行客观评估并记录,以确定是否需要停止tDCS治疗。
1.3 评价指标
分别于治疗前、治疗1 个月后进行评估;本研究为前瞻性单盲(评估者盲)随机对照研究,评估者对观察对象分组不知情。
1.3.1 PSQI
本研究仅用参与计分的18 个积分条目,组成7 个分项:睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物和日间功能障碍。每项0~3 分,总分0~21 分。总分<6 分,睡眠正常;6~7 分,轻度失眠;8~14分,中度失眠;>14分,重度失眠。得分越高代表睡眠质量越差[14]。
1.3.2 汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)
所有项目采用0~4 分的5 级评分法,共14 项,总分越高焦虑越严重。总分<7 分,没有焦虑症状;7~13 分,可能有焦虑,14~20 分,肯定有焦虑;21~28分,肯定有明显焦虑,≥ 29分,可能为严重焦虑[15]。
1.3.3 汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD)
共17 个项目,各项目采用0~4 分的5 级评分法,评分越高抑郁越严重。总分<7分,无抑郁;7~17分,轻度抑郁;18~24 分,中度抑郁;>24 分,重度抑郁[16]。
1.3.4 睡眠监测
采用基于心肺耦合技术[17]的M1-C1009910 型Sleepimage睡眠监测系统(北京普康科健医疗设备有限公司)监测一个整夜的睡眠过程,主要睡眠参数包括睡眠质量指数、睡眠总时间、睡眠潜伏期、睡眠效率、觉醒转换次数和快速眼动期睡眠时间。
睡眠质量指数是基于临床验证作为睡眠健康的总体指标,用于跟踪随时间变化的睡眠质量,是心肺耦合生物标志物,即睡眠质量、睡眠稳定性、睡眠片段化和周期性的汇总指标,以0~100 的整数分值显示,分值越高说明睡眠质量越好,预期值>55 分,≤ 55 分表示睡眠质量较差。睡眠总时间是入睡至最后觉醒前的时间累计,预期值480~600 min。睡眠潜伏期是入睡至睡眠第一期出现的时间,预期值<30 min,≥ 30 min 则为入睡困难。睡眠效率是睡眠总时间与睡眠机会时间之比,预期值>85%,≤ 85%则表示睡眠效率较低[18]。
1.4 统计学分析
采用SPSS 23.0 统计学软件进行统计学分析。计量资料服从正态分布,以()表示,两组间比较采用独立样本t/t'检验,治疗前后组内比较采用配对t检验;不服从正态分布,以M(Ql,Qu)表示,采用秩和检验。计数资料采用χ2检验。显著性水平α=0.05。
2 结果
共4 例脱落,试验组1 例因tDCS 刺激时头皮针刺样疼痛退出,1 例因病情变化退出;对照组1 例因病情变化退出,1例因效果不佳退出。
2.1 PSQI评分
治疗前,两组PSQI 评分比较无显著性差异(P>0.05)。治疗1 个月后,两组PSQI 评分均显著降低(P<0.001),试验组明显低于对照组(P<0.01);但两组仍属于中度失眠。见表2。

表2 两组治疗前后PSQI评分比较
2.2 HAMA评分
治疗前,两组HAMA 评分比较无显著性差异(P>0.05)。治疗1个月后,两组HAMA 评分均显著低于治疗前(P<0.001),且试验组明显低于对照组(P<0.01)。治疗后,试验组属于可能有焦虑,对照组属于肯定有焦虑。见表3。
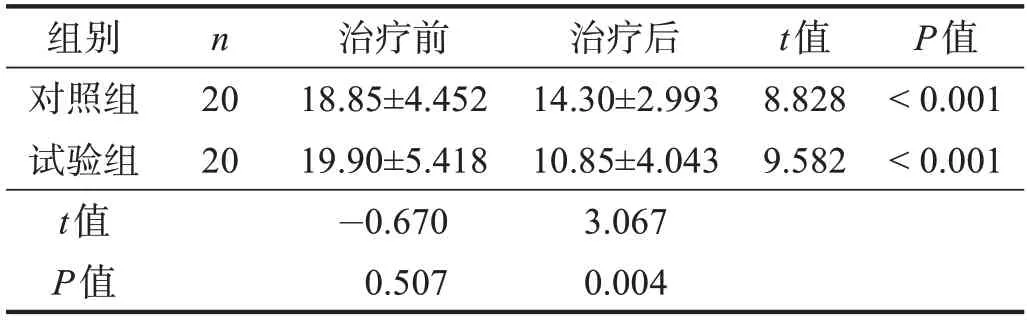
表3 两组治疗前后HAMA评分比较
2.3 HAMD评分
治疗前,两组HAMD 评分无显著性差异(P>0.05)。治疗1个月后,两组HAMD 评分均显著低于治疗前(P<0.001),但两组间比较无显著性差异(P>0.05)。治疗后,两组均属于轻度抑郁。见表4。
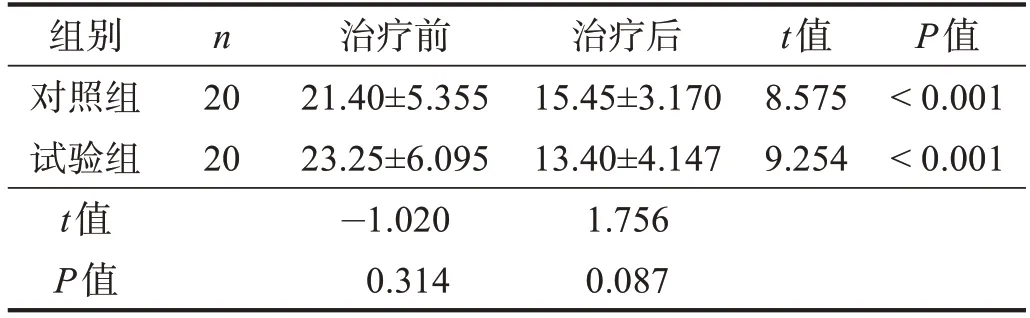
表4 两组治疗前后HAMD评分比较
2.4 睡眠监测
治疗前,两组睡眠监测各指标比较均无显著性差异(P>0.05);治疗1 个月后,两组睡眠质量指数、睡眠效率均显著高于治疗前(P<0.001),睡眠总时间均显著长于治疗前(P<0.001),睡眠潜伏期均显著短于治疗前(P<0.001),觉醒转换次数均显著少于治疗前(P<0.001);试验组快速眼动期时间延长(P<0.05);试验组睡眠质量指数、睡眠总时间、睡眠效率、觉醒转换次数均优于对照组(P<0.05),但两组间睡眠潜伏期、快速眼动期时间无显著性差异(P>0.05)。
从预期值角度来看,试验组睡眠质量仍较差,睡眠总时间仍少于预期值;两组睡眠潜伏期均达到预期值,睡眠效率仍较低。见表5。

表5 两组治疗前后各项睡眠参数比较
3 讨论
本研究发现,tDCS 可以改善PSI 患者睡眠质量、焦虑情绪,但对抑郁情绪、睡眠潜伏期、快速眼动期时间等影响不明显,对睡眠结构影响不大。这与国内外其他tDCS 改善睡眠治疗的研究结果相近[19-22]。临床上PSI 常并发抑郁、焦虑状态,三者关系复杂,较难识别因果,若共存则会产生额外的不良后果,严重损害健康,生活质量更差,治疗难度更大,因此需要积极同步处理,同时介入[23]。
本研究显示,tDCS 结合常规治疗对PSI患者的睡眠状况、焦虑状态、抑郁状态较治疗前均有较好的改善,尽管没有达到治愈的标准,但同时也说明PSI 并发焦虑、抑郁状态临床治疗的难度。有研究发现,tDCS 联合运动想象疗法治疗对改善患者睡眠状况有较好效果[24]。一项动物研究显示,缺血性脑卒中兴奋性神经递质增多,抑制性神经递质减少,引发PSI[25]。有研究发现当神经元活跃时,神经胶质细胞跨膜电位也会因而改变,对γ-氨基丁酸、谷氨酸的释放和稳定起调控作用,因此认为tDCS 通过调节神经胶质细胞来影响神经递质浓度[26]。另外,磁共振波谱研究显示,阳极tDCS 可减少γ-氨基丁酸的局部浓度,而阴极tDCS 则降低谷氨酸水平[27],这与药物治疗卒中后抑郁、失眠的机制接近[28]。同样,tDCS 在抑郁性失眠[29]的治疗中也得到应用,改善睡眠质量的同时改善情绪。
额叶在睡眠的启动、维持过程中发挥重要作用[30],因而对于刺激靶点选择,出现F3-F4 即左-右侧DLPFC比较主流的方法,本研究亦采用此方法。多项采用tDCS 治疗睡眠障碍的研究将阳极刺激靶点选择在DLPFC[21-22,31]。DLPFC 作为大脑皮质进行情绪调节的重要脑区,抑郁患者左侧DLPFC 兴奋性可能降低,右侧DLPFC 兴奋性可能增加[32-33]。国外研究以抑郁症患者和双相情感障碍患者为对象,使用tDCS 阳极刺激左侧DLPFC 后,患者的睡眠质量得到改善[34]。tDCS应用于脑卒中康复治疗的刺激电流强度常为1.0~2.0 mA,刺激持续时间一般不超过30 min,多数tDCS研究设置刺激电流2 mA,刺激时长20 min,每周5 d,连续刺激1~4周[35],本研究亦采取此方案。
在安全性方面,一项Meta 分析纳入209 项研究(回顾1998 年到2010 年的172 篇文章),评估tDCS 在不同实验设计中的安全性,报道的轻度或暂时副作用中最常见的是发痒、刺痛、头痛、烧灼感或不适感,结果显示一些轻度副作用如发痒和刺痛,在tDCS 刺激组中比假刺激组更常见,但并无显著性差异[36]。一项MRI 研究表明,tDCS 不会导致受试者大脑组织水肿、血脑屏障失衡及脑组织结构的改变[37]。本研究中仅出现1例因tDCS刺激时头皮针刺样疼痛退出,并未出现严重不良事件,可以说tDCS 安全性较高,当然也可能因为本研究排除了颅骨空洞、裂缝或修补等患者;并且操作者严格遵守设备使用程序、操作指引和实验室规定的安全操作规章制度。
PSI 给患者的康复进程带来很大困扰,长期失眠会严重影响免疫力,增加患者卒中后焦虑抑郁的发病风险,而焦虑抑郁又进一步负面影响睡眠,它们相互影响,互为因果,最终甚至导致脑卒中复发[38]。考虑到药物治疗容易产生耐药性和依赖性,认知行为治疗依赖操作者水平且治疗周期长,TMS价格昂贵且容易有不良反应,tDCS 因其经济安全、无创便捷、副作用少等优势,为PSI 干预提供了新的治疗思路;且随着基础机制研究的进展及临床疗效循证依据的增多,其作为临床治疗的辅助手段,将越来越广泛应用到临床实践中。
本研究还存在一定局限性。未进行加强治疗和随访,不能明确tDCS 的长期疗效和后续效应;未检测神经递质,未来研究可以改进,研究tDCS 对中枢睡眠-觉醒系统相关神经递质的影响;样本量相对较少,刺激靶点的选择也仅仅依据既往对卒中后抑郁[39]、失眠的研究,不能充分探讨tDCS对PSI的疗效,未来应设计更规范的大样本、多中心的随机对照研究,为临床具体应用提供依据。
利益冲突声明:所有作者声明不存在利益冲突。
