辅助化疗对合并脏层胸膜侵犯的IB期非小细胞肺癌的疗效分析
2023-01-17池强伟赵畅
池强伟,赵畅
肺癌目前仍是世界范围内最常见的癌症之一,其发病率和死亡率均位于所有癌症首位[1]。非小细胞肺癌(NSCLC)约占所有肺癌的85%,其病理亚型主要包括腺癌和鳞状细胞癌[2]。对于早期NSCLC而言,手术切除能明显改善疾病预后,但仍有约30~75%的患者术后发生局部复发或全身转移[3-4]。接受术后辅助化疗对改善该部分患者的预后具有积极作用。脏层胸膜侵犯(VPI)作为NSCLC的不良预后因素,参与决定肿瘤T分期,能使IA期肺癌(肿瘤大小≤3cm)升至IB期。合并VPI状态(PL1或PL2)的IB期NSCLC术后是否需接受辅助化疗仍存在争议。最新国际指南认为合并VPI的IB期NSCLC可以考虑进行术后辅助化疗,但未明确指出是否合并VPI就必须接受化疗[5]。同时,既往也有研究报道,无论肿瘤大小,合并VPI的IB期NSCLC均无法从术后辅助化疗中获益[6]。
因此,本研究基于监测、流行病学和最终结果(SEER)数据库,研究该数据库大样本的临床预后数据,使用科学合理的统计学方法探讨辅助化疗与合并VPI的IB期NSCLC术后生存的关系,现报道如下。
1 资料与方法
1.1 一般资料 使用SEER*Stat 8.4.0软件检索并下载肺癌患者的临床病理及预后数据。入组标准:(1)诊断时间从2010年至2018年;(2)接受手术切除;(3)根据第八版TNM分期为IB期(T2aN0M0)且合并有VPI状态(程度为PL1或PL2)。排除标准:(1)肺癌非第一原发肿瘤;(2)缺少临床病理特征数据;(3)缺失完整随访数据且随访时间小于3个月。纳入患者的一般资料,包括年龄、性别、种族、婚姻、肿瘤病理类型、分化程度、肿瘤大小、VPI状态、手术方法、化疗、放疗及预后数据,以总生存期(OS)作为评价指标来评估患者的预后。本研究所使用的数据为可公开获得的回顾性研究资料,不涉及患者隐私。
1.2 方法 最终纳入的患者根据是否接受术后辅助化疗分为化疗组和非化疗组。由于回顾性队列的固有缺陷,两组患者的人口统计学和临床病理学特征不平衡。为平衡组间差异,使用1∶1最近邻匹配算法在两组患者之间进行倾向评分匹配(PSM)。使用单因素和多因素生存分析筛选预后相关的独立风险因素,并建立和验证预测合并VPI状态的IB期NSCLC预后的列线图,使用Bootstrap重抽样法计算该列线图的一致性指数(C-index)。

图11 PSM后辅助化疗与合并VPI的ⅠB期NSCLC患者OS的单因素生存分析
1.3 统计方法所有的统计分析均在R 4.2.0软件中完成。通过MatchIt程序包[7]进行1∶1最近邻匹配算法完成PSM。采用Pearson卡方检验计算组间分类变量的差异。使用survival、survminer程序包采用Kaplan-Meier法构建生存曲线,并用log-rank检验比较两组OS差异。使用rms程序包建立Cox比例风险模型进行单因素和多因素分析筛选独立预后因素,单因素分析中P值<0.1的变量被纳入多因素分析中。P<0.05表示差异有统计学意义。
2 结果
2.1 患者临床特征 共纳入3 277例合并VPI状态的IB期NSCLC患者,临床特征资料见表1。PSM前两组患者除种族、肿瘤大小之外的变量均不平衡;PSM后两组患者的基线资料均衡,具有可比性,见表1。PSM前辅助化疗能使术后患者获得更好的OS(P=0.019),而经PSM平衡基线差异后,两组患者术后OS的差异无统计学意义(P=0.64),见封三彩图10~11。

图10 PSM前辅助化疗与合并VPI的ⅠB期NSCLC患者OS的单因素生存分析
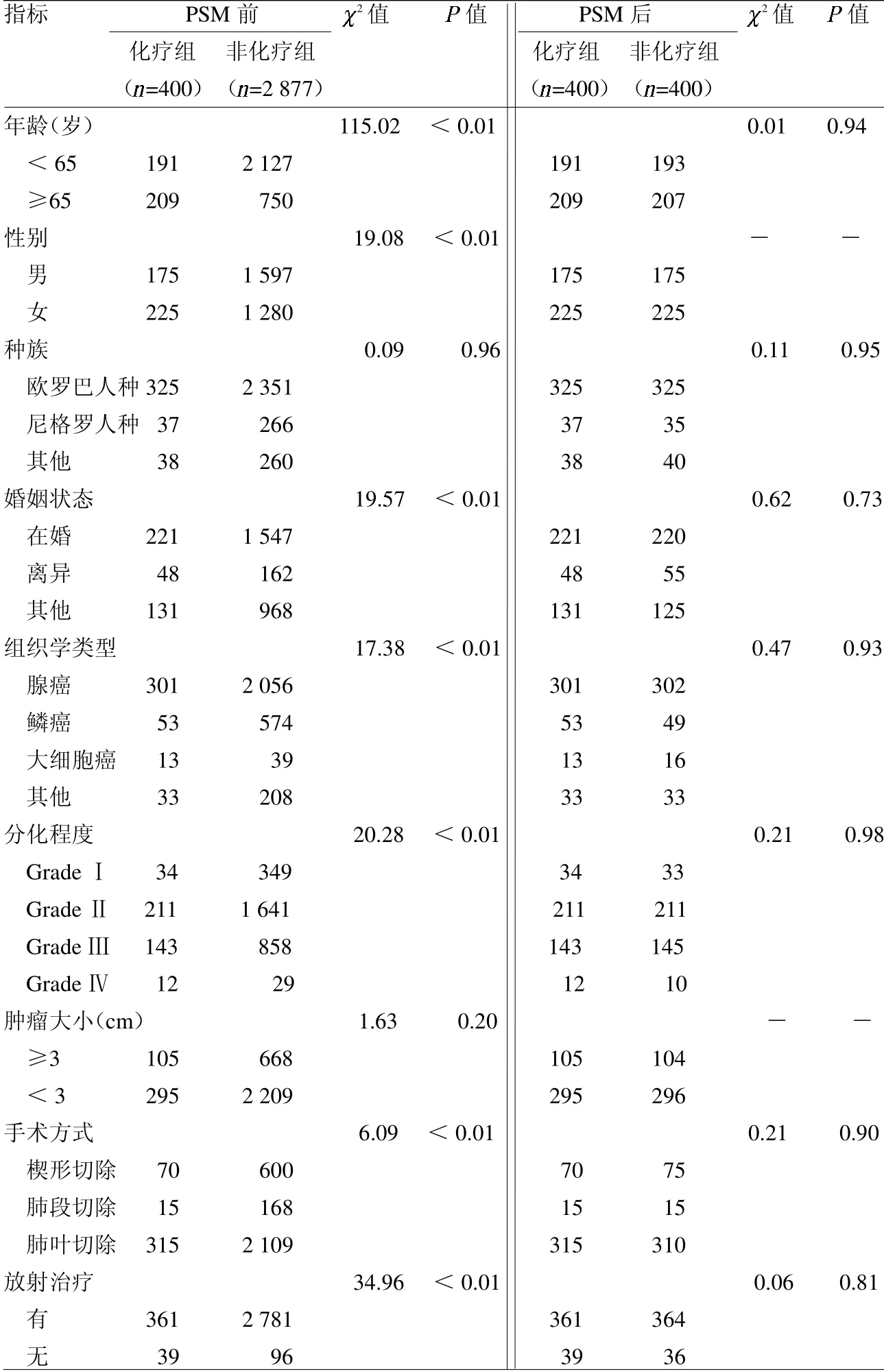
表1 PSM前后的合并VPI的IB期NSCLC患者临床基线资料 例
2.2 Cox风险比例模型建立 单因素分析显高龄[≥65岁,HR:1.59(1.22~2.06),P<0.01]、组织学类型为鳞癌[HR:1.82(1.31~2.56),P<0.01]、较差的分化程度[HR:1.86(1.04~3.33),P<0.05]、接受放疗[HR:1.70(1.18~2.44),P<0.01]与合并VPI状态的IB期NSCLC患者更差的预后相关;而种族为其他[亚裔或印度裔等,HR:0.58(0.34~0.99),P<0.05]、接受肺叶切除术[HR:0.53(0.39~0.71),P<0.01]的患者术后有更好的预后,见表2。

表2 PSM后的合并VPI的IB期NSCLC患者OS的单因素和多因素Cox分析
将上述变量纳入多因素分析后显示,高龄[≥65岁,HR:1.41(1.076~1.85),P=0.01]、组织学类型为鳞癌[HR:1.46(1.03~2.08),P<0.01]、接受放疗[HR:1.52(1.04~2.23),P=0.03]是合并VPI状态的IB期NSCLC患者预后的独立危险因素;同时接受肺叶切除术[HR:0.53(0.39~0.71),P<0.01]为独立保护因素。术后接受辅助化疗在单因素和多因素分析中均未显示出与术后OS相关(P=0.64、0.68)。
2.3 列线图的建立 将Cox风险比例模型筛选出的独立预后因素可视化建立了列线图,见图1。该列线图C-index的计算结果为0.74(>0.7),表示该列线图的区分度好,有临床价值。

图1 预测合并VPI的IB期NSCLC患者3年和5年OS的列线图
3 讨论
脏层胸膜是一种复合结构,由内至外分为肺实质表面的结缔组织层、弹性纤维层、内皮下的薄纤维结缔组织层和内皮细胞层[8]。VPI根据侵犯层次不同分为4个等级:(1)PL0:肿瘤侵犯结缔组织层未超越弹性纤维层;(2)PL1:肿瘤侵犯弹性纤维层未超越内皮层;(3)PL2:肿瘤超越内皮层侵犯至脏层胸膜表面;(4)PL3:肿瘤超越脏层胸膜表面侵犯至壁层胸膜[9]。PL1和PL2作为T2a的分期标准被写入第8版TNM分期。
既往有研究认为,脏层胸膜有非常丰富的淋巴管,在肺表面形成相互连通的网络,并穿透肺实质引流至肺门淋巴结。因此,VPI与局部复发和全身转移的风险增加有关[10,11]。同时,VPI对于肺癌患者术后预后的影响可能与肿瘤大小有关。Nitadori等[12]发现VPI不会影响肿瘤大小<2 cm、淋巴结阴性的肺腺癌患者的术后OS和复发率。Martini等[13]通过对I期NSCLC患者的进行生存分析发现VPI与生存率无明显相关,但当肿瘤大小>3 cm时VPI与生存有明显相关。David等[14]发现在肿瘤体积<5cm的肿瘤中,VPI不会影响患者的OS或无病生存期(DFS),但VPI与肿瘤体积>5 cm的淋巴结阴性肺癌患者更差的DFS显著相关。这些研究均提示VPI可能并不影响肿瘤体积较小的早期肺癌(如IB期)术后生存。本研究中入组的病例肿瘤大小均<4 cm,生存分析也同样显示出肿瘤大小(≥3cm vs<3cm,P=0.22)未对生存产生影响。笔者推测过小的肿瘤大小可能会使VPI失去原有的侵袭能力,从而不影响生存。 术后辅助化疗的目的是消除微小残留病灶,减少肿瘤复发风险,改善患者生存率[15]。目前,合并VPI的IB期NSCLC患者术后是否接受辅助化疗仍存在争议。Zhang等[16]报道,辅助化疗不能改善IB和ⅡA期NSCLC患者术后的5年OS,但亚组分析显示肿瘤大小≥3 cm且合并VPI的IB期NSCLC能从术后化疗中获益。Xie等[17]发现IB期NSCLC不能从辅助化疗中获益,即使了合并VPI状态。本研究结果显示。PSM前生存分析显示出接受辅助化疗对术后生存有优势,但在PSM后,单因素和多因素分析均显示辅助化疗与术后生存不相关,这考虑是PSM前组间基线资料不平衡引起的。另外,本研究还发现高龄、组织学类型为鳞癌、接受放疗是合并VPI状态的IB期NSCLC患者预后的独立危险因素;同时接受肺叶切除术为独立保护因素,这与既往研究相符[18-20]。
同时,本研究还存在诸多局限性:首先,免疫及靶向治疗已经是肺癌治疗的重要组成部分,目前还未纳入SEER数据库,缺少这部分数据可能对研究造成重要影响;其次,SEER数据库中种族多为白人、黑人,亚洲人种较少,本研究所得出的结论可能不适用于我国人群。
综上所述,辅助化疗不能使合并VPI状态的IB期NSCLC患者术后生存获益,对这部分患者的临床治疗决策具有一定的参考价值。
