基于对衰老大鼠心脏抗氧化保护作用及Keap1-Nrf2-HO-1 通路探讨川芎临床“久服”用药策略
2023-01-17刘尧张建军李振皓朱映黎乐娜张睿南海鹏王祥山陈秀红王淳李明焱王林元
刘尧 张建军 李振皓 朱映黎 乐娜 张睿 南海鹏 王祥山 陈秀红 王淳 李明焱 王林元
人口老龄化问题日益严重,衰老所引起的各种退行性疾病严重制约着老年健康及生活。 自由基学说被认为是衰老发生的机制之一,大量自由基的产生会攻击细胞内物质引起氧化应激[1]。 近年来“血瘀致衰”理论受到重视[2],中医认为老年多气虚,由此引起血液运行不畅造成瘀血,瘀血内阻,脏腑功能失调。 瘀血既是病理产物,又是衰老病机之一,现代研究发现血瘀证大鼠模型体内超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶活性(glutathione peroxidase,GSH-PX)的含量降低,丙二醛(malondialdehyde,MDA)含量升高,加重氧化应激[3]。 心为五脏六腑之主,心脏搏动,血液运行依赖心之统摄,衰老引发的心血管疾病是老年人常见疾病。
川芎始载于《神农本草经》,其辛温而燥,能够活血行气、祛风止痛,为“血中之气药”。 现代研究表明川芎对心脑血管系统具有抗衰老、抗动脉粥样硬化、细胞保护、改善心功能等作用[4-6]。 但川芎辛温升散,久服易散真气,其小剂量下久服能否发挥抗氧化作用,并能否通过抑制氧化应激对心脏衰老具有保护作用还不明确。
本实验通过构建衰老合并血瘀大鼠模型,观察川芎小剂量下久服抗氧化作用,基于Keap1-Nrf2-HO-1 抗氧化通路,探讨对衰老合并血瘀大鼠心脏保护作用及机制,为川芎合理用药提供依据。
1 材料与方法
1.1 动物
SPF 级雄性SD 大鼠66 只,体质量180 ~220 g,购自斯贝福(北京)实验动物科技有限公司,许可证号:SCXK(京)2019-0010。 饲养于北京中医药大学动物房,大鼠自由饮水、摄食,12/12 小时日灯光模拟白天黑夜,以标准普通饲料喂食。 实验伦理号BUCM-4-2021032401-1052。
1.2 药物
D-半乳糖(批号:R24O11H128688,上海源叶生物有限公司);肾上腺素注射液(批号:2107262,天津金耀药业有限公司);维生素E 软胶囊(批号:210211,天津市中央药业有限公司);川芎配方颗粒(批号:2101006,北京康仁堂药业有限公司);人参配方颗粒(批号:21006942,北京康仁堂药业有限公司)。
1.3 试剂与仪器
SOD 试剂盒(批号:20220303)、GSH-PX 试剂盒(批号:20211123)及总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒(批号:20211123)、MDA 试剂盒(批号:20220304)、总蛋白(total protein,TP)定量测定试剂盒(批号:20211223)、ATP 酶测试盒(批号:20220506),以上试剂盒均购自南京建成生物工程研究所;蛋白质羰基(protein carbonyl,PC)ELISA试剂盒(批号:202203),购自上海酶联生物科技有限公司;核因子E2 相关因子2(nuclearfactor erythroidderived 2-like 2,Nrf2)抗体(批号:00063558)、血红素加氧酶1(heme oxygenase 1,HO-1)抗体(批号:00105224)、Kelch 样 ECH 相关蛋白 1(recombinant kelch like ECH associated protein 1,Keap1)抗体(批号:00073992)、GAPDH 抗体(批号:10015666),购自美国Proteintech 公司。
酶标分析仪(美国伯腾仪器有限公司)、凝胶成像系统(上海勤翔科学仪器有限公司)。
1.4 分组与模型制备
动物适应性喂养7 天后,按体质量随机分为空白组(11 只)、模型组(55 只)。 模型组大鼠从造模第一天起按每10 g 体质量0.1 mL 腹腔注射D-半乳糖(300 mg/kg)连续42 天,于第43 天眼眶取血,检测大鼠血清MDA 含量。 按MDA 水平随机分为模型组、维生素E 组、川芎2 g 组、川芎4 g 组、川芎配伍人参2 g 组,每组11 只。 同时继续造模并给药14天,第15 天开始冰水浴20 分钟,连续14 天,最后一天注射0.1%肾上腺素0.8 mg/kg。 空白组每日给予普通饲料喂食,腹腔注射等剂量生理盐水,共70 天。
1.5 给药方法
按MDA 水平随机分为模型组、维生素 E 组(0.02 g/kg,相当于人日用量0.2 g/天)、川芎2 g 组(0.20 g/kg,相当于人日用量2 g/天),川芎4 g 组(0.40 g/kg,相当于人日用量4 g/天),川芎配伍人参2 g 组(0.20 g/kg,相当于人日用量2 g/天),每组11 只。 空白组、模型组每天灌胃双蒸水,各给药组分别灌胃给予相应药物,连续28 天。
1.6 检测指标与方法
1.6.1 观察大鼠体质量 给药后每2 周记录体质量变化。
1.6.2 苏木精—伊红(hmatoxylin-eosin,HE)染色法检测大鼠心脏 摘取心脏,用4%多聚甲醛溶液固定,然后加入不同体积分数的乙醇梯度脱水、二甲苯透明、石蜡包埋、石蜡切片、HE 染色处理,显微镜下观察各组大鼠心脏组织病理变化。
1.6.3 大鼠血清SOD、GSH-PX、T-AOC 水平检测最后一次给药后,大鼠腹主动脉取血,室温静置4 小时,4 ℃,3500 r/分钟离心15 分钟,分离血清,按试剂盒检测血清 SOD、GSH-PX、T-AOC、MDA、PC 含量。
1.6.4 取大鼠心肌组织心尖部分,按组织重量体积比1 ∶9 加入预冷0.9%的生理盐水,并匀浆,分别制备成10%的组织匀浆,4000 r/分钟离心15 分钟后取上清液。 BCA 法测定蛋白浓度后,按试剂盒检测心脏组织中 SOD、GSH-PX、MDA、Na+-K+-ATP酶、Ca2+-Mg2+-ATP 酶含量。
1.6.5 蛋白质印迹(Western Blotting)法检测Nrf2、HO-1、Keap1 蛋白表达 取大鼠心肌组织心耳部分,按组织重量体积比1 ∶9,在冰上加入含有蛋白酶抑制剂的RIPA 裂解液裂解,机械研磨匀浆后3500 r/分钟,离心10 分钟取上清液,用BCA 法测定蛋白浓度。 按照 1 ∶4 加入 5×Loading Buffer,10% SDSPAGE 凝胶电泳分离后电转至PVDF 膜,用含5%脱脂奶粉的TBST 缓冲液封闭1 小时,分别加入Nrf2(1 ∶6000 稀释)、HO-1(1 ∶6000 稀释)、Keap1(1 ∶6000 稀释)、GAPDH(1 ∶10000 稀释),4℃ 孵育过夜,TBST 洗 3 次,每次 10 分钟。 加入二抗(1 ∶10000 稀释)室温温育 1 小时,TBST 洗 3 次,每次 10分钟,电化学发光液显影,凝胶成像仪曝光。
1.7 统计学方法
用SPSS 20.0 统计软件对计量数据进行分析,以均数±标准差()表示,数据进行正态检验和方差齐性检验,符合正态分布且方差齐,采用单因素方差分析(One-way ANOVA),组间比较采用LSD法。 以P<0.05 为差异有统计学意义。
2 结果
2.1 对大鼠体质量的影响
给药4 周后,与空白组相比,模型组大鼠体质量增长显著下降(P<0.05);与模型组相比,维生素E组能显著提高大鼠体质量(P<0.05),川芎2 g 组、川芎4 g 组、川芎配伍人参2 g 组均能提高大鼠体质量,差异具有统计学意义(P<0.05),结果见表1。
表1 各组大鼠给药后体质量增长的变化比较(,n=8,g)
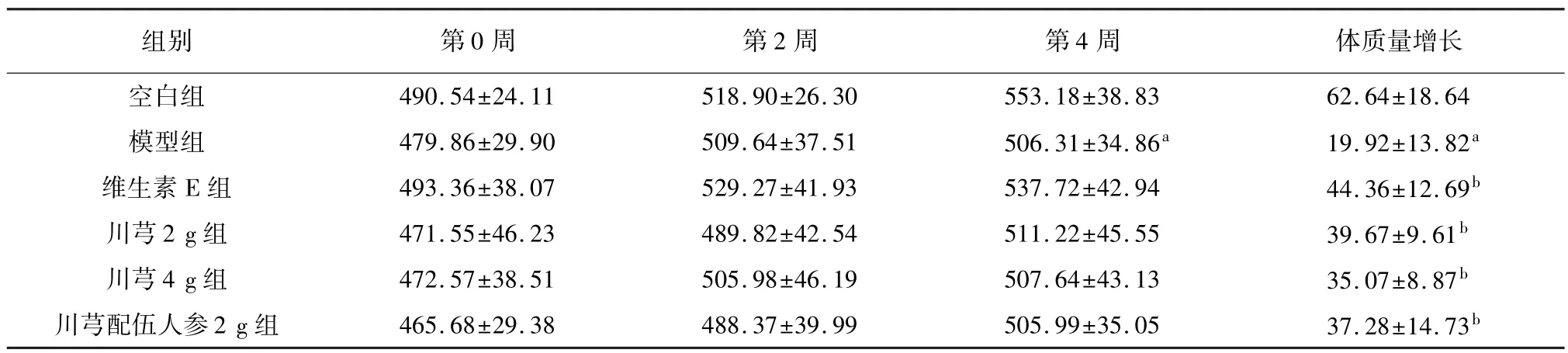
表1 各组大鼠给药后体质量增长的变化比较(,n=8,g)
注: 与空白组比较,aP<0.05;与模型组比较,bP<0.05。
64±18.64模型组 479.86±29.90 509.64±37.51 506.31±34.86a 19.92±13.82a维生素 E 组 493.36±38.07 529.27±41.93 537.72±42.94 44.36±12.69b川芎2 g 组 471.55±46.23 489.82±42.54 511.22±45.55 39.67±9.61b川芎4 g 组 472.57±38.51 505.98±46.19 507.64±43.13 35.07±8.87b川芎配伍人参2 g 组 465.68±29.38 488.37±39.99 505.99±35.05 37.28±14.73体质量增长空白组 490.54±24.11 518.90±26.30 553.18±38.83 62.组别 第0 周 第2 周 第4周b
2.2 对大鼠心脏病理的影响
HE 染色:空白组心脏组织心内膜、心肌膜及心外膜结构清晰,心壁及心腔未见明显异常;心肌纤维着色均匀,细胞分界清楚,走形一致,心肌细胞横纹清楚,明、暗相间,间质未见异常;未见明显的炎性改变。 模型组右心室壁上可见少量心肌纤维坏死溶解,伴有结缔组织增生及点状的淋巴细胞与中性粒细胞浸润,周围可见少量心肌纤维变性,胞质空泡化。 维生素 E 组、川芎2 g 组、川芎 4 g 组、川芎配伍人参2 g 较模型组均有不同程度改善。 见图1。
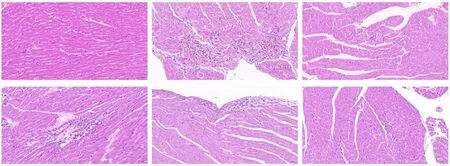
图1 各组大鼠心脏HE 染色(×200)
2.3 对大鼠血清 SOD、GSH-PX、T-AOC 的影响
与空白组相比,模型组大鼠血清SOD 含量降低(P<0.01);与模型组相比,维生素E 组、川芎4 g 组与川芎配伍人参2 g 组均能显著升高 SOD 含量(P<0.05);与川芎4 g 组相比,川芎配伍人参2 g 组显著升高SOD 含量(P<0.05)。 与空白组相比,模型组大鼠血清GSH-PX 含量降低,差异明显(P<0.01);与模型组相比,维生素E 组、川芎2 g 组、川芎4 g组、川芎配伍人参2 g 组均能够升高GSH-PX 含量(P<0.05);与川芎4 g 组相比,川芎配伍人参配伍2 g组显著升高 GSH-PX 含量(P<0.01)。 与空白组相比,模型组大鼠血清T-AOC 含量降低(P<0.01);与模型组相比,维生素E 组、川芎2 g 组、川芎4 g 组均能够升高T-AOC 含量(P<0.05),见表2。
表2 各组大鼠给药后血清SOD、GSH-PX、T-AOC 的变化比较(,n=8,U/mg)
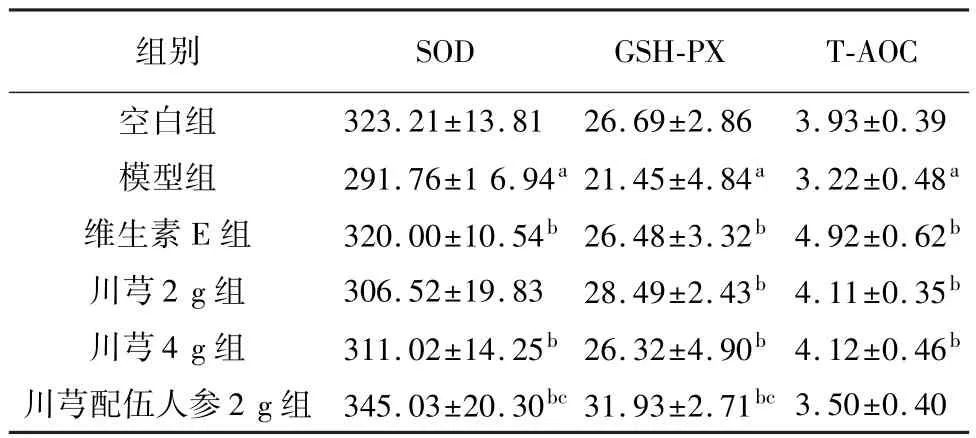
表2 各组大鼠给药后血清SOD、GSH-PX、T-AOC 的变化比较(,n=8,U/mg)
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.05;与川芎4 g 组比较,cP<0.01。
3.50±0.40组别323.21±13.81 26.69±2.86 3.93±0.39模型组 291.76±1 6.94a 21.45±4.84a 3.22±0.48a维生素 E 组 320.00±10.54b 26.48±3.32b 4.92±0.62b川芎 2 g 组 306.52±19.83 28.49±2.43b 4.11±0.35b川芎 4 g 组 311.02±14.25b 26.32±4.90b 4.12±0.46b川芎配伍人参2 g 组 345.03±20.30bc 31.93±2.71bc SOD GSH-PX T-AOC空白组
2.4 对大鼠血清MDA 和PC 的影响
与空白组相比,模型组大鼠血清MDA 含量明显升高(P<0.001);与模型组相比,川芎2 g 组、川芎4 g 组、川芎配伍人参2 g 组均能够降低MDA 含量(P<0.05)。 与空白组相比,模型组大鼠血清PC含量明显升高(P<0.001);与模型组相比,维生素E组、川芎2 g 组及川芎配伍人参2 g 组均能显著降低PC 含量(P<0.05);与川芎4 g 组相比,川芎配伍人参2 g 组可以降低 PC 含量(P<0.05)。 见表3。
表3 各组大鼠给药后血清MDA、PC 的变化比较(,n=8)
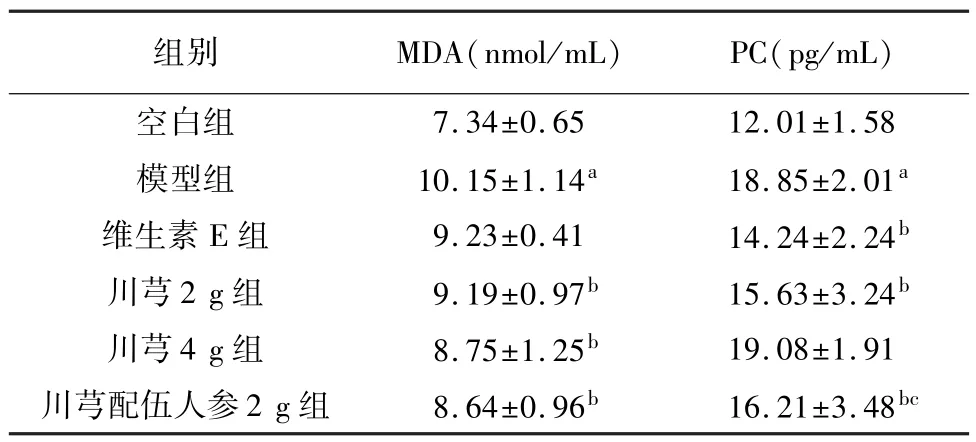
表3 各组大鼠给药后血清MDA、PC 的变化比较(,n=8)
注: 与空白组比较,aP<0.001;与模型组比较,b P<0.05;与川芎4 g组比较,cP<0.05。
组别 MDA(nmol/mL) PC(pg/mL)7.34±0.65 12.01±1.58模型组 10.15±1.14a 18.85±2.01a维生素 E 组 9.23±0.41 14.24±2.24b川芎 2 g 组 9.19±0.97b 15.63±3.24b川芎 4 g 组 8.75±1.25b 19.08±1.91川芎配伍人参 2 g 组 8.64±0.96b 16.21±3.48空白组bc
2.5 对大鼠心脏组织SOD、GSH-PX、MDA 的影响
与空白组相比,模型组大鼠心脏组织SOD 含量显著降低(P<0.01);与模型组相比,维生素E 组显著升高SOD 含量(P<0.05)。 与空白组相比,模型组大鼠心脏组织中MDA 含量明显升高(P<0.01);与模型组相比,维生素E 组、川芎4 g 组、川芎配伍人参2 g 组均能够降低MDA 含量(P<0.05)。 与空白组相比,模型组大鼠 GSH-PX 含量明显降低(P<0.01);与模型组相比,川芎4 g 组、川芎配伍人参2 g 组均能够升高 GSH-PX 含量(P<0.05)。 见表4。
表4 各组大鼠给药后心脏组织SOD、MDA、GSH-PX 的变化比较(,n=8)
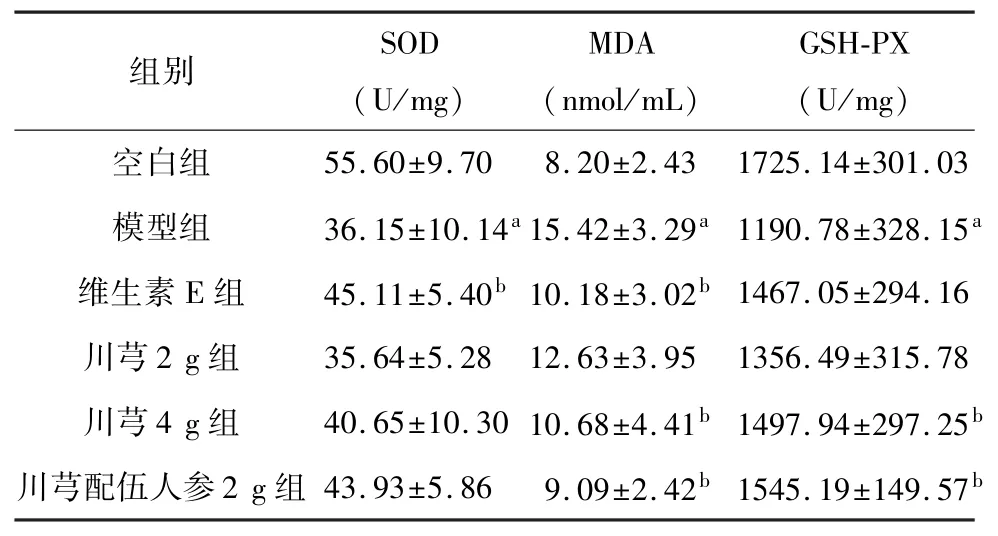
表4 各组大鼠给药后心脏组织SOD、MDA、GSH-PX 的变化比较(,n=8)
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.05。
组别 SOD(U/mg)MDA(nmol/mL)GSH-PX(U/mg)55.60±9.70 8.20±2.43 1725.14±301.03模型组 36.15±10.14a 15.42±3.29a 1190.78±328.15a维生素 E 组 45.11±5.40b 10.18±3.02b 1467.05±294.16川芎2 g 组 35.64±5.28 12.63±3.95 1356.49±315.78川芎4 g 组 40.65±10.30 10.68±4.41b 1497.94±297.25b川芎配伍人参 2 g 组 43.93±5.86 9.09±2.42b 1545.19±149.57空白组b
2.6 对大鼠心脏Na+-K+-ATP 酶、Ca2+-Mg2+-ATP酶的影响
与空白组相比,模型组大鼠心脏组织内Na+-K+-ATP 酶含量显著降低(P<0.01);与模型组相比,各组均能提高酶含量,除川芎2 g 组外均有统计学差异(P<0.05)。 与空白组相比,模型组大鼠心脏组织内Ca2+-Mg2+-ATP 酶含量降低(P<0.01);与模型组相比,川芎4 g 组、川芎配伍人参配伍2 g 均能显著提高其含量(P<0.05)。 见表5。
表5 各组大鼠给药后心脏Na+-K+-ATP 酶、Ca2+-Mg2+-ATP 酶的变化比较(,n=8,μmol/mg)

表5 各组大鼠给药后心脏Na+-K+-ATP 酶、Ca2+-Mg2+-ATP 酶的变化比较(,n=8,μmol/mg)
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.05。
组别 Na+-K+-ATP 酶 Ca2+-Mg2+-ATP酶6.92±1.65 5.69±1.38模型组 3.05±2.33a 3.36±1.79a维生素 E 组 4.91±1.94b 4.58±1.61川芎2 g 组 4.74±1.36 4.69±1.25川芎4 g 组 5.21±1.14b 5.17±0.87b川芎配伍人参 2 g 组 5.62±1.67b 5.69±1.91空白组b
2.7 对大鼠心脏组织Keap1-Nrf2-HO-1 通路相关蛋白表达量的影响
与空白组相比,模型组大鼠心脏组织中Nrf2、HO-1 表达显著减少(P<0.05),Keap1 表达显著增加(P<0.05);与模型组相比,川芎2 g、川芎4 g、川芎配伍人参2 g 中Nrf2 表达显著增加(P<0.05),维生素E 组、川芎4 g、川芎配伍人参2 g 组HO-1 表达显著增加(P<0.05),Keap1 表达有所减少,但差异无统计学意义。 见表6,图2。
表6 各组对大鼠心脏组织Keap1、Nrf2、HO-1 蛋白表达量的变化比较(,n=3)
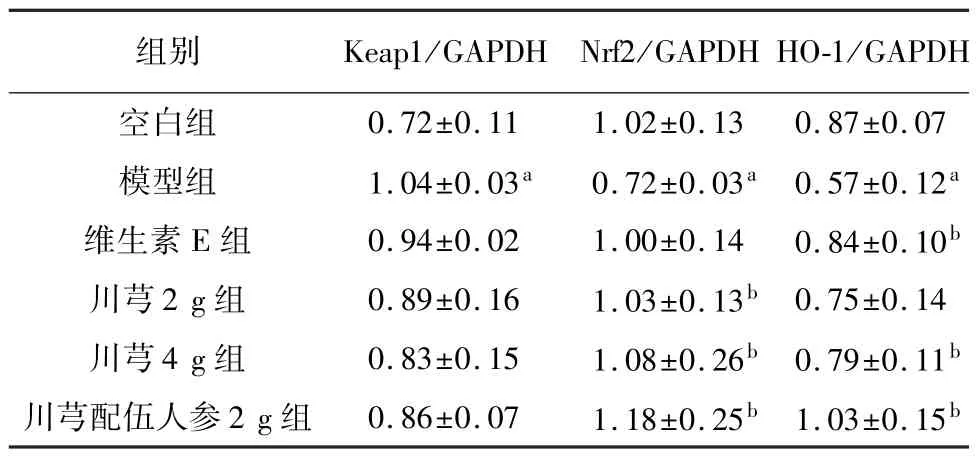
表6 各组对大鼠心脏组织Keap1、Nrf2、HO-1 蛋白表达量的变化比较(,n=3)
注: 与空白组比较,aP<0.05;与模型组比较,bP<0.05。
0.72±0.11 1.02±0.13 0.87±0.07模型组 1.04±0.03a 0.72±0.03a 0.57±0.12a维生素 E 组 0.94±0.02 1.00±0.14 0.84±0.10b川芎2 g 组 0.89±0.16 1.03±0.13b 0.75±0.14川芎4 g 组 0.83±0.15 1.08±0.26b 0.79±0.11b川芎配伍人参 2 g 组 0.86±0.07 1.18±0.25b 1.03±0.15 Keap1/GAPDH Nrf2/GAPDH HO-1/GAPDH空白组组别b
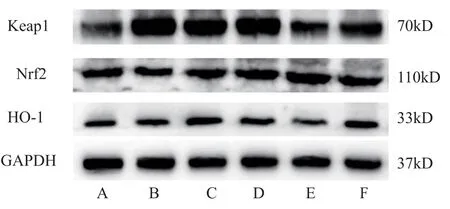
图2 各组大鼠Keap1、Nrf2、HO-1 蛋白印迹表达
3 讨论
衰老作为机体内在有害的生理过程,表现为机体各个器官组织结构和功能的退行性改变,如心血管疾病、癌症、糖尿病和神经退行性疾病[7]。 随着全球范围内老龄化趋势的增加,如何延缓衰老成为了热点问题。 机体或细胞内自由基失衡导致的氧化应激被认为是造成衰老的重要因素。 半乳糖是人体内一种正常的还原糖,过量的超出机体负荷的D-半乳糖则会致使机体产生活性氧自由基从而降低了抗氧化能力[8]。 研究表明,当机体处于衰老状态时,自由基过氧化反应增强,机体清除自由基能力减弱;内源性抗氧化剂超氧化物歧化酶SOD 及谷胱甘肽过氧化物酶GSH-PX 含量及其活性明显降低,脂质过氧化产物丙二醛MDA 及慢性氧化应激标志物羰基化蛋白PC 含量升高[9]。
中医认为衰老多由气血失调引起,从而引起五脏机能虚损[10]。 气是维持人体生命活动的动力和物质基础,《千金翼方·养老大例》中指出:“人年五十以上,阳气日衰,损与日至”,认为人的衰老关键在于阳气虚弱。 气虚无力推动血液运行致瘀血形成,血瘀内阻,塞而不通,脏腑功能失调,可加速人体的衰老。 这正是“虚瘀致衰”的内在机制[11]。 有学者提出“辨证保健”,结合中医辨证论治及治未病理论基础,在尚未有“病痛”,亚健康态通过早期中医药干预实现机体健康的良性循环[12]。 川芎“性阳,气善走窜而无阴凝粘滞之态,虽入血分,又能去一切风,调一切气”,具有活血行气、祛风止痛的功效。 川芎中主要活性成分川芎嗪、阿魏酸具有抗血小板凝集,扩张血管,保护心肌等作用,其醇提液可以清除DPPH 和羟自由基[13]。 血得热则行,得寒则凝。 因此本实验通过腹腔注射D-半乳糖,冰水浴及注射肾上腺素构建衰老合并寒凝血瘀氧化损伤模型,探讨川芎在亚健康状态久服发挥抗氧化作用与机制。
心为五脏六腑之主,心脏搏动,血液运行依赖心之统摄,衰老引发的心血管疾病是老年人常见疾病[14],药物延缓衰老在一定程度上表现为心血管抗氧化能力的改善。 随着年龄增长,机械负荷增加以及间质纤维化的发生均可导致左心室肥厚,心肌代偿性肥厚可致心肌纤维化和胶原纤维类型改变[15]。衰老能够影响心脏能量代谢,ATP 酶活力的下降可使心肌细胞膜结构发生破坏,在再灌注期间产生的氧自由基诱发肌膜脂质过氧化,进一步加重了心肌细胞膜的破坏,心肌缺血会增加细胞内 Ca2+的累积,导致离子泵损伤和线粒体功能障碍,增加机体对损伤的易感性[16-17]。 此外衰老加剧心脏中脂质过氧化,促进动脉粥样斑块形成,导致冠状动脉的血流灌注受损,心肌细胞缺氧进而坏死或死亡,影响心脏正常收缩和舒张功能[18]。 Keap1-Nrf2-HO-1是常见抗氧化通路,是机体抗氧化应激的关键环节。 在受到氧化应激的情况下,Keap1 和Nrf2 脱耦,Nrf2 在稳定状态下发生核转位,并与抗氧化反应因子HO-1 结合,并调控相应的抗氧化酶表达[19]。 本实验表明模型组Nrf2 核蛋白表达显著下调,提示氧化应激抑制胞浆Nrf2 向细胞内转位,从而抑制下游抗氧化酶类SOD、GSH-PX 的表达,心肌 MDA 含量上升,病理可见心肌纤维坏死及变性,此外心肌ATP酶活性降低,提示心肌氧化损伤。 与模型组相比,川芎2 g、4 g 组通过调节Nrf2/HO-1 通路,调节下游抗氧化酶的表达,升高血液中SOD、GSH-PX 水平及降低血清MDA、PC 水平,同时提高Na+-K+-ATP 酶及Ca+-Mg2+-ATP 酶活性,及时排出心肌细胞内的Na+、Ca2+。 研究进一步说明活血化瘀药川芎可能是在一定程度上抑制氧化应激反应,提高心肌能量代谢,推动气血运行,进而延缓衰老,改善心肌功能。
川芎辛温升散,长于生血,而短于生气,可用于治疗月经病、头痛病、胸痹心痛等疾病,各疾病平均用药剂量为(6.38±2.53)g、(11.68±7.87) g、(10.79±4.09)g[20]。 有研究表明单药川芎给予7.5 g时,其可以升高D-半乳糖衰老模型脑组织中SOD、GSH-PX 含量,降低 MDA、MAO 含量,具有良好的延缓衰老的作用[21]。 《本草纲目》记载川芎若单服既久,久则偏绝。 《景岳全书》记载川芎多服久服,令人走散真气,能致暴亡。 有学者提出“久服”药物需具备很高的安全性,需要缓缓以小剂量药物扶持,产生的较为温和的干预作用,由量变达到质变从而维护健康[22]。 老年气虚,素体虚弱,用药不宜多猛,本实验表明,川芎小剂量下对血清抗氧化指标可产生一定作用,然而在心脏中保护作用不及川芎配伍人参组。 《本草备要》认为川芎单服则脏有偏胜,久服则过剂生邪,故有此失。 若有配合节制,则不至此矣。 川芎多与补虚药、活血化瘀药、清热药等相配伍,如黄芪、当归、丹参、赤芍等。 川芎、当归、白芍是四物汤的主要药物组成,配合桃仁、红花,具有补血和血、活血化瘀之功,临床以人参养荣汤合桃红四物汤治疗冠心病心绞痛,复方中川芎15 g疗效佳,且安全性好[23]。 保心汤以益气活血为组方原则,方中含川芎、黄芪、丹参等,能够降低血清细胞炎症因子 TNF-α、IL-6、ICAM-1 表达水平,抑制炎症反应,从而治疗气虚血瘀型冠心病心绞痛[24]。 文献研究表明治疗胸痹等病搭配补气药频率最高,气虚证与血瘀证为心血管疾病常见证型[25]。 本实验以人参为例,人参扶正固本,大补元气,制约川芎“久服散真气”。 研究表明,人参、川芎的主要活性成分人参皂苷和川芎嗪合用对家兔心肌缺血再灌注损伤可以起到保护作用[26]。 本实验表明川芎配伍人参2 g 组对心肌抗氧化指标及能量代谢均有改善,川芎剂量由2 g 减少为1 g 并与1 g人参合用后抗氧化作用增强,优于将单味川芎剂量增加到4 g,且益气活血对于心肌氧化损伤改善明显,其发挥作用可能与人参补气推动血液运行起到协同增效作用相关。
人口老龄化日益严重,老年人作为特殊人群,中药临床安全应用尤为重要,如何发挥中医药优势防治老年病,显得十分必要。 综上,本研究通过构建衰老合并血瘀氧化损伤模型,针对老年血瘀状态下,基于抗氧化通路探讨川芎小剂量下久服对于延缓衰老的药效及作用机制,从而阐明川芎的用药配伍规律,为临床用药的安全性、有效性、合理性提供依据。
