泛素调控蛋白A20对慢性乙肝患者单核细胞活性的影响①
2023-01-17王佳斌李英兰张希功马燕春青海省人民医院全科医学科西宁810007
王佳斌 李英兰 张希功 马燕春(青海省人民医院全科医学科,西宁 810007)
乙型肝炎病毒(hepatitis B virus,HBV)可诱导机体免疫耐受及多种免疫细胞(包括T细胞、B细胞、单核细胞、自然杀伤细胞等)功能衰竭,机体无法清除病毒,导致持续感染和慢性化[1]。新型泛素调控蛋白A20也称为肿瘤坏死因子α诱导蛋白3,是一种重要的免疫抑制因子,在肿瘤、感染性疾病、自身免疫病中均发挥重要的抗炎和免疫调控功能[2-4]。A20在慢性丙型肝炎病毒(hepatitis C virus,HCV)感染中表达升高,对树突状细胞和单核/巨噬细胞功能发挥抑制作用[5-6]。但有关A20在慢性乙肝中的免疫调控作用鲜有报道。本研究主要观察了A20在慢性乙型肝炎患者中的表达及其对CD14+单核细胞功能的调控作用。
1 资料与方法
1.1资料
1.1.1一般资料 选取2019年3月至2019年9月于青海省人民医院就诊的慢性乙型肝炎患者47例作为HBV组,其中男性26例,女性21例,年龄23~44岁,平均(31.9±8.7)岁,所有患者均符合《慢性乙型肝炎防治指南(2015更新版)》[7]诊断标准,纳入标准:①年龄>18岁且<65岁;②HBsAg阳性超过6个月且HBV DNA阳性;③入组前从未接受过抗病毒和/或免疫调节治疗;④获得患者知情同意。排除标准:①合并其他嗜肝病毒、人类免疫缺陷病毒感染;②合并自身免疫性疾病;③合并恶性肿瘤;④合并妊娠。所有患者均为HBeAg阳性,HBV DNA(6.22±1.08)log10拷贝/ml,ALT水平均高于2倍正常上限,平均(178.2±56.1)U/L。选取健康志愿者26例作为健康对照组,其中男性14例,女性12例,年龄26~47岁,平均(33.6±9.1)岁,ALT水平(20.4±6.8)U/L。本研究方案通过青海省人民医院伦理委员会批准,入组患者和健康志愿者均签署知情同意书。
1.1.2主要仪器与试剂FACS Calibur流式细胞仪(美国BD公司);ABI7500实时定量PCR仪(美国Applied Biosystems公司);微孔读板仪(美国BioRad公司);Ficoll人淋巴细胞分离液(北京索莱宝公司);CD14 MicroBeads(货号:130-050-201)、CD4 Micro-Beads(货号:130-045-101,德国美天旎公司);A20小干扰RNA(small interfering RNA,siRNA,货号:sc-37655)、对照siRNA(货号:sc-37007)、A20-PE(美国Santa Cruz公司);CD14-FITC、CD4-FITC、IFN-γ-PE、IL-17-APC(美国eBioscience公司);Trizol试剂(美国Invitrogen公司);PrimeScript反转录试剂盒、TB GreenPremix Ex TaqⅡ(北京TaKaRa公司);IFN-γ、TNF-α、IL-1β、IL-6、IL-8、单 核 细 胞 趋 化 蛋 白-1(monocyte chemotactic protein 1,MCP-1)ELISA检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(武汉碧云天公司)。
1.2方法
1.2.1CD14+单核细胞和CD4+T细胞的纯化 采集入组患者和健康志愿者的外周静脉血30 ml,EDTA抗凝,采用Ficoll人淋巴细胞分离液、密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。分离的PBMC使用CD14 Micro-Beads纯化CD14+单核细胞。取4×107个PBMCs,以300 r/min离心10 min,弃上清,加入320µl缓冲液重悬细胞,再加入80µl CD14 MicroBeads,混匀后4℃孵育15 min,加入4 ml缓冲液洗涤,300 r/min离心弃上清,加入500µl缓冲液重悬细胞。将分离柱置于MACS分离架,使用4 ml缓冲液浸润分离柱,加入上述标记的细胞悬液,使细胞悬液穿过分离柱,使用2 ml缓冲液洗涤2次,收集穿过分离柱的细胞,即为去除单核细胞的PBMC。将分离柱从MACS分离架上取下,加入2 ml缓冲液,使用注射器活塞快速推注,收集的细胞即为CD14+单核细胞,计数备用。去除单核细胞的PBMC使用CD4 MicroBeads纯化为CD4+T细胞。取3×107个去除单核细胞的PBMCs,300 r/min离心弃上清,加入240µl缓冲液重悬细胞,再加入60 µl CD4 MicroBeads,混匀后4℃孵育15 min,加入3 ml缓冲液洗涤,300 r/min离心10 min,弃上清,加入500µl缓冲液重悬细胞。将分离柱置于MACS分离架,使用3 ml缓冲液浸润分离柱,加入上述标记的细胞悬液,使细胞悬液穿过分离柱,2 ml缓冲液洗涤2次,将分离柱从MACS分离架上取下,加入2 ml缓冲液,采用注射器活塞快速推注,收集细胞即为CD4+T细胞,计数备用。
1.2.2A20 siRNA转染 取1×105个单核细胞,加入2 ml RPMI1640培养液+10%胎牛血清于6孔板中培养,将2 µl siRNA双链体溶于100 µl siRNA转染培养液(A溶液),将2µl siRNA转染试剂溶于100µl siRNA转染培养液(B溶液),将A溶液和B溶液混合后室温静置30 min,采用2 ml siRNA转染培养液洗涤细胞,加入800µl siRNA转染培养液和200µl A+B混合溶液,于37℃、5%CO2条件下培养6 h,然后加入RPMI1640培养液+20%胎牛血清继续培养24 h。
1.2.3细胞培养 ①2.5×104个转染后的单核细胞与1×105个HepG2.2.15细胞共培养,培养液中加入1×脂多糖,培养24 h后收集上清;②2.5×104个转染后的单核细胞与5×104个自体CD4+T细胞共培养,培养液中加入1×脂多糖和抗CD3/CD28(1 µg/ml),在培养的最后6 h加入佛波酯(50 ng/ml)、伊乌诺霉素(1 µg/ml)和布雷菲德菌素A(10 µg/ml),培养24 h后收集细胞。
1.2.4流式细胞术检测A20表达及IFN-γ、IL-17分泌 取分离的PBMC,加入CD14-FITC进行表面染色,洗涤后加入100 µl固定破膜液A,室温孵育15 min,加入3 ml流式染色缓冲液,300 r/min离心5 min,弃上清,加入100µl固定破膜液B和A20-PE,室温避光孵育15 min,洗涤后使用FACS Calibur流式细胞仪分析。取单核细胞和CD4+T细胞共培养的细胞,加入CD4-FITC进行表面染色,洗涤后加入100µl固定破膜液A,室温孵育15 min,加入3 ml流式染色缓冲液,300 r/min离心5 min,弃上清,加入100 µl固定破膜液B和IFN-γ-PE、IL-17-APC,室温避光孵育15 min,洗涤后使用FACS Calibur流式细胞仪分析。使用FlowJo V10软件分析流式结果。
1.2.5实时定量PCR检测A20、Fas配体(Fas ligand,FasL)和肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)mRNA相对表达量Trizol试剂提取单核细胞中的总RNA。取1µg总RNA,以PrimeScript反转录试剂盒将总RNA反转录为cDNA,反转录反应体系:5×PrimeScript Buffer 2µl、PrimeScript RT Enzyme MixⅠ
0.5µl、Oligo dT Primer(50µmol/L)0.5µl、Random 6 mers(100 µmol/L)0.5 µl、总RNA 1 µg、加 入RNase Free dH2O至10 µl。反转录反应条件:37℃15 min,85℃5 s。使用TB GreenPremix Ex TaqⅡ进 行 实 时 定 量PCR反 应,PCR反 应 体 系:2×TB GreenPremix Ex TaqⅡ(Tli RNaseH Plus)10 µl、PCR正向引物(10 µmol/L)0.8 µl、PCR反向引物(10µmol/L)0.8µl、50×ROX ReferenceDyeⅡ0.4µl、RT反应液(cDNA溶液)2µl、灭菌水6µl,总体积为20µl。PCR反应条件:预变性95℃30 s,1个循环,PCR反应,95℃5 s、60℃30 s,40个循环。使用ABI7500实时定量PCR仪进行PCR反应,引物序列参考文献[5,8]合成,采用2-ΔΔCt法对目的基因进行半定量分析。
1.2.6ELISA法检测细胞因子分泌 采用ELISA双抗体夹心法检测细胞因子水平。将样本和标准品以100 µl/孔加入相应孔,采用封板膜封住反应孔,室温孵育120 min,使用洗涤液(含0.05%吐温20的磷酸盐缓冲液,pH=7.4)洗板5次。每孔中加入100µl生物素化抗体,封板膜封住反应孔,室温孵育60 min,洗板5次。每孔中加入100 µl辣根过氧化物酶标记的链霉亲和素,封板膜封住反应孔,室温孵育20 min,洗板5次。每孔加入100 µl显色剂TMB溶液,封板膜封住反应孔,室温孵育20 min。每孔中加入50 µl终止液,混匀后立即在450 nm波长下测定OD值,绘制标准曲线,计算待测样本浓度。
1.2.7HepG2.2.15细胞死亡比例检测 使用LDH细胞毒性检测试剂盒检测培养上清中LDH水平。以HepG2.2.15细胞培养液中LDH水平为“低水平对照”,以Triton X-100处理的HepG2.2.15细胞培养液中LDH水平为“高水平对照”,死亡细胞比例(%)=(样本LDH值-低水平对照)/(高水平对照-低水平对照)×100%。
1.3统计学方法 应用SPSS21.0软件进行统计学分析,计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析、SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1慢性乙肝患者外周血CD14+单核细胞中A20的变化 根据FCS和SSC对单核细胞圈门,CD14+单核细胞中A20阳性细胞比例和平均荧光强度(mean fluorescence intensity,MFI)的典型流式检测图如图1。慢性乙肝患者外周血CD14+A20+细胞比例、CD14+单核细胞中A20 MFI及A20 mRNA相对表达高于健康对照者,见表1。
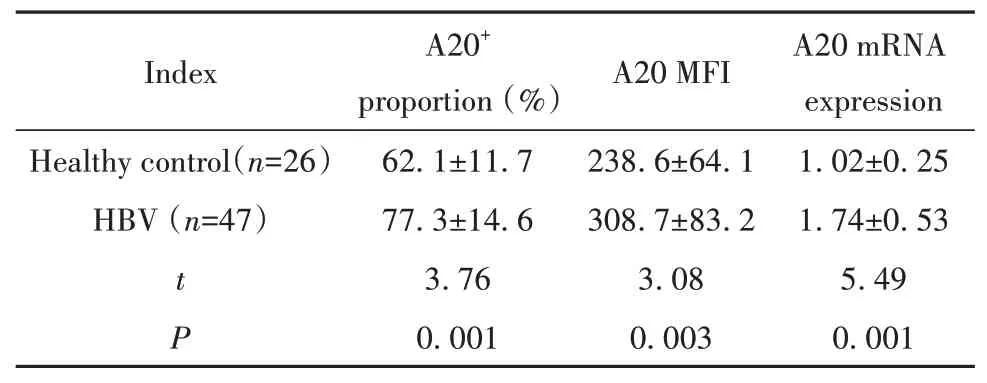
表1 健康对照者和慢性乙肝患者CD14+单核细胞中A20表达比较Tab.1 Comparison of A20 expression in CD14+monocytes of healthy controls and chronic hepatitis B patients
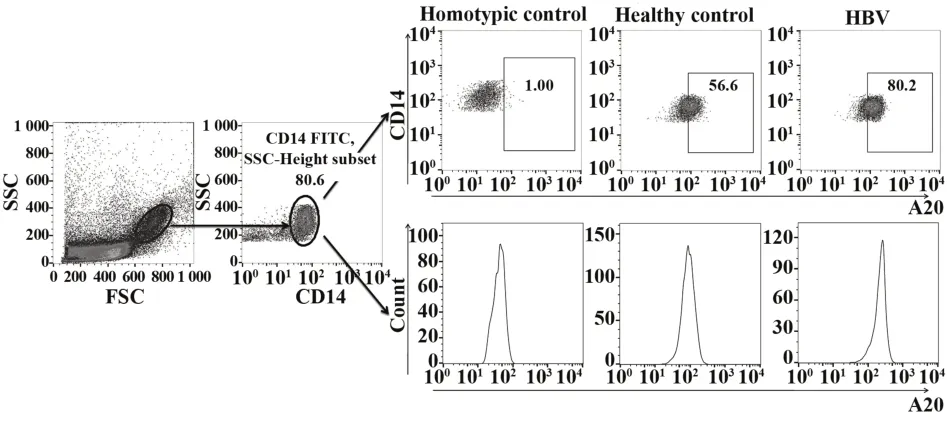
图1 健康对照者和慢性乙肝患者CD14+单核细胞中A20细胞比例和MFI典型流式分析图Fig.1 Representative flow cytometric plots of percentage of A20 cell and MFI of CD14+monocytes of healthy controls and chronic hepatitis B patients
2.2抑制A20对慢性乙肝患者CD14+单核细胞杀伤功能的影响A20 siRNA转染所有入组慢性乙型肝炎患者纯化的CD14+单核细胞后,其分泌炎症细胞因子IFN-γ、TNF-α、IL-1β、IL-6、IL-8、MCP-1水平均高于未转染细胞和对照siRNA转染细胞(P均<0.05),上述细胞因子在未转染细胞和对照siRNA转染细胞间的差异无统计学意义(P均>0.05)。CD14+单核细胞中FasL和TRAIL mRNA相对表达量在未转染、对照siRNA转染和A20 siRNA转染细胞间差异均无统计学意义(P均>0.05)。CD14+单核细胞与HepG2.2.15细 胞 共 培 养 后,A20 siRNA转 染 的CD14+单核细胞诱导靶细胞死亡比例高于未转染细胞和对照siRNA转染细胞(P均<0.05),但靶细胞死亡比例在未转染细胞和对照siRNA转染细胞间差异无统计学意义(P=0.152)。见表2。
表2 抑制A20对慢性乙型肝炎患者CD14+单核细胞杀伤功能的影响(±s,n=47)Tab.2 Effect of inhibiting A20 on killing function of CD14+monocytes in patients with chronic hepatitis B(±s,n=47)
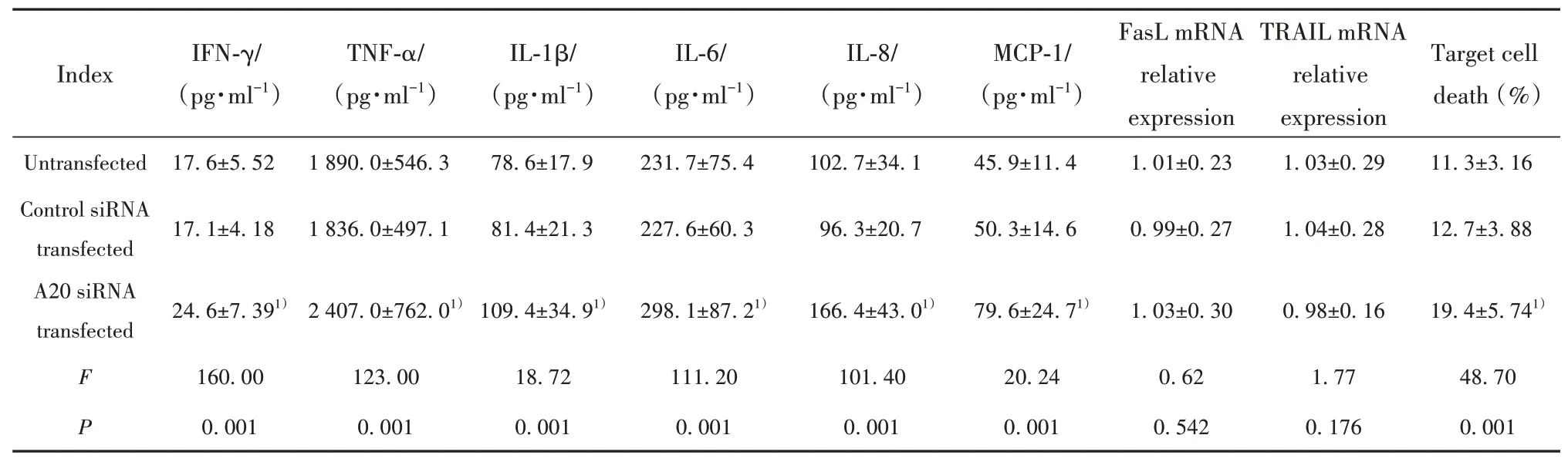
表2 抑制A20对慢性乙型肝炎患者CD14+单核细胞杀伤功能的影响(±s,n=47)Tab.2 Effect of inhibiting A20 on killing function of CD14+monocytes in patients with chronic hepatitis B(±s,n=47)
Note:Compared with untransfected and control siRNA transfected groups,1)P<0.05.
?
2.3抑制A20对慢性乙肝患者CD14+单核细胞诱导CD4+T细胞活化的影响 慢性乙型肝炎患者纯化的CD14+单核细胞与CD4+T细胞共培养后,CD4+T细胞分泌IFN-γ和IL-17的典型流式散点图如图2。A20 siRNA转染的CD14+单核细胞诱导CD4+T细胞分泌IFN-γ和IL-17的比例高于未转染和对照siRNA转染细胞(P均<0.05),但IFN-γ+CD4+和IL-17+CD4+细胞比例在未转染和对照siRNA转染间差异无统计学意义(P均>0.05)。见表3。
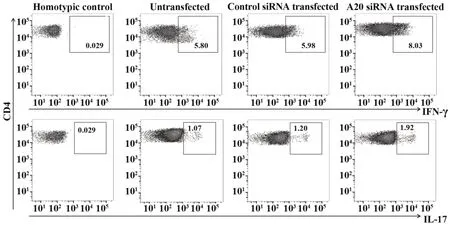
图2 未转染、对照siRNA转染和A20 siRNA转染慢性乙肝患者CD14+单核细胞诱导CD4+T细胞分泌IFN-γ和IL-17的典型流式散点图Fig.2 Representative flow cytometric plots of effect of untransfected,control siRNA transfected and A20 siRNA transfected on CD14+monocytes in HBV patients inducing CD4+T cells to secrete IFN-γ and IL-17 cytokines
表3 抑制A20对慢性乙型肝炎患者CD14+单核细胞诱导CD4+T细胞活化的影响(±s,n=47,%)Tab.3 Effect of inhibiting A20 on CD14+monocyte-induced CD4+T cell activation in chronic hepatitis B patients(±s,n=47,%)
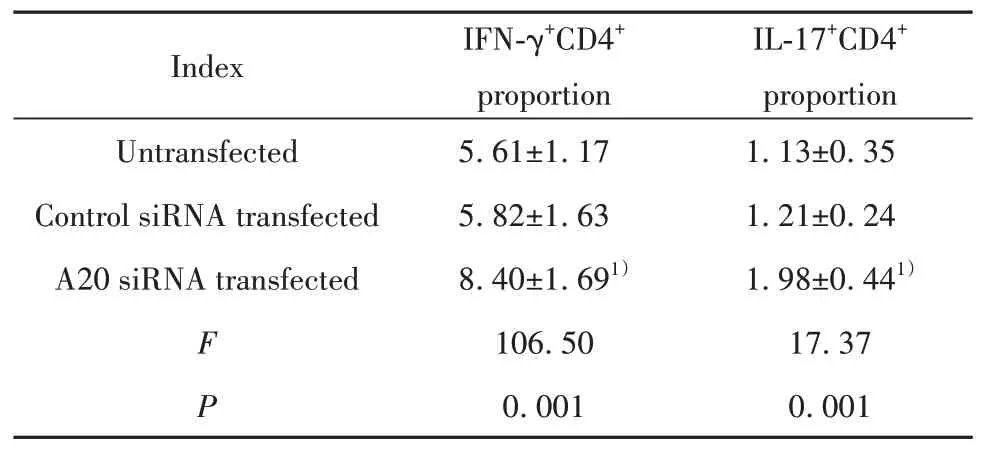
表3 抑制A20对慢性乙型肝炎患者CD14+单核细胞诱导CD4+T细胞活化的影响(±s,n=47,%)Tab.3 Effect of inhibiting A20 on CD14+monocyte-induced CD4+T cell activation in chronic hepatitis B patients(±s,n=47,%)
Note:Compared with untransfected and control siRNA transfected groups,1)P<0.05.
?
3 讨论
泛素调控蛋白A20主要表达于多种免疫器官和免疫细胞,其主要作用是一种去泛素化酶,由于蛋白泛素化在固有免疫和获得性免疫中均发挥重要作用,主要功能是调控免疫耐受、免疫细胞分化、细胞因子和Toll样受体介导的信号转导通路,A20的主要功能就是发挥去泛素化作用,增加IκB激酶活性,延长NF-κB活化,从而发挥负性免疫调控作用[9]。A20在病毒感染中亦发挥重要调控作用。甲型流感病毒NS1蛋白可诱导A20表达升高,通过抑制IFN介导的抗病毒应答促进病毒复制,而抑制支气管上皮细胞中A20表达则可增强细胞毒性T细胞功能和MCP-1表达,从而有效控制甲型流感病毒感染[10-11]。牛病毒性腹泻病毒-1可通过增加A20表达抑制NF-κB活性,从而抑制IL-8的表达和活化[12]。HCV感染亦可诱导A20表达水平升高,抑制树突状细胞和单核/巨噬细胞活性,促进病毒感染慢性化[5-6,13]。既往研究发现,慢性乙肝患者及乙肝相关慢加急性肝衰竭患者血清和PBMC中A20水平均显著升高,与机体的免疫状态、疾病预后均密切相关[14-18]。本研究发现,慢性乙肝患者CD14+单核细胞中A20水平升高,虽未发现A20与病毒学和生化学指标的显著相关性,结合既往研究结果,提示A20参与慢性乙肝发病,但其对慢性乙肝患者CD14+单核细胞功能的调控仍有待进一步研究。
去泛素化酶在调控固有免疫信号转导中发挥关键作用,而A20是第一个被发现对固有免疫具有调控作用的去泛素化酶。CD14+单核细胞是重要的固有免疫细胞,主要发挥细胞毒性作用、间接抗原提呈作用和共刺激信号转导细胞[19-20]。CD14+单核细胞主要通过2条途径发挥细胞毒性作用:一条途径是分泌可溶性细胞因子,诱导靶细胞坏死和凋亡;另一条途径是依赖细胞直接接触,通过FasL和TRAIL介导的信号通路介导细胞凋亡[8,19]。本研究发现,抑制慢性乙肝患者CD14+单核细胞中A20表达对FasL和TRAIL mRNA表达无显著影响,但可增加多种炎症细胞因子的分泌,同时,CD14+单核细胞诱导HepG2.2.15细胞死亡亦增加。提示A20并不影响慢性乙肝患者CD14+单核细胞中的促凋亡配体表达,而主要通过抑制可溶性细胞因子分泌,抑制其细胞毒性作用。另一方面,多个研究均发现CD14+单核细胞可诱导CD4+T细胞分化和激活,多种因素(如:细胞因子、Notch信号通路等)均参与了CD14+单核细胞抗原提呈功能的调控[8,21-22]。本研究发现,抑制慢性乙肝患者CD14+单核细胞中A20表达可促进其诱导CD4+T细胞向Th1型(IFN-γ+CD4+)和Th17型(IL-17+CD4+)细胞的活化。提示A20可抑制慢性乙肝患者CD14+单核细胞对CD4+T细胞的活化作用,进而抑制固有免疫对适应性免疫的调控功能。但本研究入组患者例数相对较少,且仅观察到A20可调控慢性乙肝患者CD14+单核细胞的功能,但对其中的机制研究较少。有关A20对慢性乙肝CD14+单核细胞功能调控作用的机制还有待扩大样本并进行动物实验进行证实。
综上所述,慢性乙肝患者CD14+单核细胞中高表达的A20有抑制细胞毒性及CD4+T细胞活化的作用,发挥负性免疫调控作用,可能与导致HBV感染慢性化相关。
