稳定型冠状动脉疾病向急性心肌梗死进展的生物标志物鉴定①
2023-01-17冷利华裴宜斌晏晶晶何小伍黄文胜
冷利华 裴宜斌 周 函 晏晶晶 何小伍 朱 高 黄文胜
(中国人民解放军海军安庆医院心血管内科,安庆 246003)
冠状动脉疾病(coronary artery disease,CAD)是一种复杂的多因素疾病,是最常见的死亡原因之一,并在全世界造成了沉重的经济和社会负担[1]。CAD包括稳定/不稳定心绞痛、突发性心脏疾病和心肌梗死(myocardial infarction,MI),病理基础为动脉粥样硬化斑块形成,导致腔隙狭窄/堵塞。斑块进一步破裂和血栓将阻塞冠状动脉导致急性心肌梗死(acute myocardial infarction,AMI)[2]。常见的包括高度敏感的肌钙蛋白、NT-pro BNP、左心室射血分数等,可作为预测稳定型冠状动脉疾病(stable coronary artery disease,SCAD)向AMI进展的传统诊断和预后生物标志物,但这些指标仅在初级预防情况下有效,且易受遗传因素和环境因素干扰[3-4]。近年AMI早期诊断和治疗进展较快,但SCAD患者动脉粥样硬化斑块进展为不稳定型动脉粥样硬化斑块的病理机制尚不清楚。
生物信息学分析结合高通量测序是一种非常有效、准确的方法用于探索疾病基因表达谱差异,能深入挖掘潜在的疾病相关基因,以便开发新的诊断与治疗策略。外周血中基因表达可反映包括心血管疾病在内的各种复杂疾病变化,是检测和验证疾病极为重要的生物标志物。TAN等[5]观察到外周血CPNE3低表达的SCAD患者更易向AMI进展。WANG等[6]采 用GSE71226微 阵 列 数 据 集 结 合RT-qPCR证实,SCAD患者基质金属蛋白酶(matrix metallopeptidase,MMP)9和C-X-C基序趋化因子受体(C-X-C motif chemokine receptor,CXCR)1表达显著上调。VIJAY[7]采用GSE66360微阵列数据集探索差异表达基因发现,AMI患者CXCL2、MMP9、Toll样受体(Toll-like receptor,TLR)2和TLR4在炎症反应、免疫应答及细胞因子与细胞因子受体相互作用中显著富集。本研究将进一步探索GSE71226与GSE66360微阵列数据集,试图将其整合筛选SCAD向AMI进展的相关核心基因和作用途径,以期阐述其病理机制。
1 资料与方法
1.1微阵列数据获取 在基因表达综合(gene expression omnibus,GEO,https://www.ncbi.nlm.nih.gov/geo/)数据库中下载2个独立数据集GSE71226和GSE66360。GSE71226数据集包括3例SCAD和3例健康对照,取两组外周血样本,分别提取总RNA,采用Affymetrix Human Genome U133 Plus 2.0 Array平台进行分析。GSE66360数据集包括49例AMI患者和50例健康对照,取两组外周血样本,分别提取总RNA,Affymetrix Human Genome U133 Plus 2.0 Array平台分析。
1.2GSE71226和GSE66360数据集处理 在GEO数据库中下载Series Matrix File和Platforms文件。通过Perl脚本对2个独立数据集进行注释和整合,去除1个探针对应多个分子探针,当遇到对应同一个分子探针时,仅保留信号值最大的探针。采用R软件“sva”包进行表达式值校正和数据归一化处理,得到基因表达谱文件。采用R语言“limma”包进行两组差异基因分析。筛选标准:P<0.05和|log2 fold change|>1,利用火山图进行可视化。利用“ggplot2”包对GSE71226和GSE66360数据集得到的差异基因取交集,并定义SCAD向AMI进展的关键基因,绘制维恩图,采用热图对关键基因进行可视化。
1.3GO和KEGG富集分析GO是一种常用注释基因功能的生物信息学工具。KEGG是系统分析基因功能,联系基因组信息和功能信息的知识库。GSEA是一种广泛应用的软件包,可衍生基因集确定两组间不同生物学功能。以基因计数>2和P<
0.05为筛选阈值。
1.4蛋白质相互作用(protein-protein interaction,PPI)网络创建和核心基因鉴定 采用检索相互作用基因的搜索工具(STRING 11.0,https://string-db.org/)创建PPI网络,以分值>0.4为分界点。采用Cytoscape软件插件Cytohubba(Cytoscape,3.7.1)显示关键基因的关系,采用Cytoscape软件插件MCODE 1.5.1鉴定PPI网络中的核心基因。
1.5核心基因的临床验证 选取中国人民解放军海军安庆医院2019年1月至2020年3月住院的168例SCAD患者作为SCAD组。纳入标准:①SCAD诊断标准参照《稳定性冠心病诊断与治疗指南》[8];②年龄>18岁;③本地常住居民。排除标准:①心脏瓣膜病、先天性心脏病;②合并慢性疾病如阻塞性肺疾病、肝功能、肾功能衰竭;③中枢神经系统疾病或自身免疫系统疾病;④急慢性感染;⑤凝血功能障碍或血液疾病;⑥恶性肿瘤。选择同期体检的健康志愿者24例作为对照组。所有SCAD患者均进行有效随访,随访截止时间为2021年3月,期间共有34例患者发生AMI,定义为AMI组,未发生AMI定义为无AMI组(n=134)。AMI诊断标准参照《急性冠脉综合征急诊快速诊疗指南》[9]。
1.6核心基因表达168例SCAD患者于入院后第1天8:00抽取空腹静脉血5 ml,室温静置15~30 min,3 000 r/min离心10 min。按照ELISA试剂盒说明书检测血清核心基因表达,终止反应后酶标仪测定450 nm处各孔OD值,以标准品OD值/标准品OD值为纵坐标,以标准品浓度为横坐标绘制标准曲线,根据检测标本OD值及标准曲线计算相应浓度。随访期间发生AMI的患者于入院后第1天8:00抽取空腹静脉血5 ml,核心基因表达检测同上。对照组检测血清核心基因表达方法同上。
1.7统计学方法 采用SPSS17.0软件进行数据分析。计数资料用百分比(%)表示,组间比较采用χ2检验。计量资料以±s表示,采用独立样本t检验。采用ROC曲线分析核心基因诊断SCAD患者进展为AMI的性能。P<0.05为差异有统计学意义。
2 结果
2.1GSE71226和GSE66360数据集差异基因分析GSE71226数据集中获得1 122个差异基因,高表达327个,低表达795个(图1A)。GSE66360数据集中获得463个差异基因,高表达366个,低表达97个(图1A)。GSE71226和GSE66360数据集差异基因的交集基因见图1B,共得到48个关键基因,具体表达特点见图2。
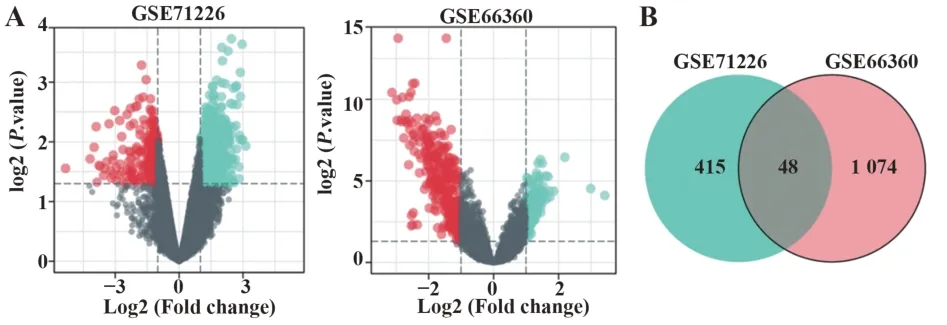
图1 GSE71226和GSE66360数据集差异基因火山图及交集基因Fig.1 Volcanic map of differential genes and their intersection genes in GSE71226 and GSE66360 datasets
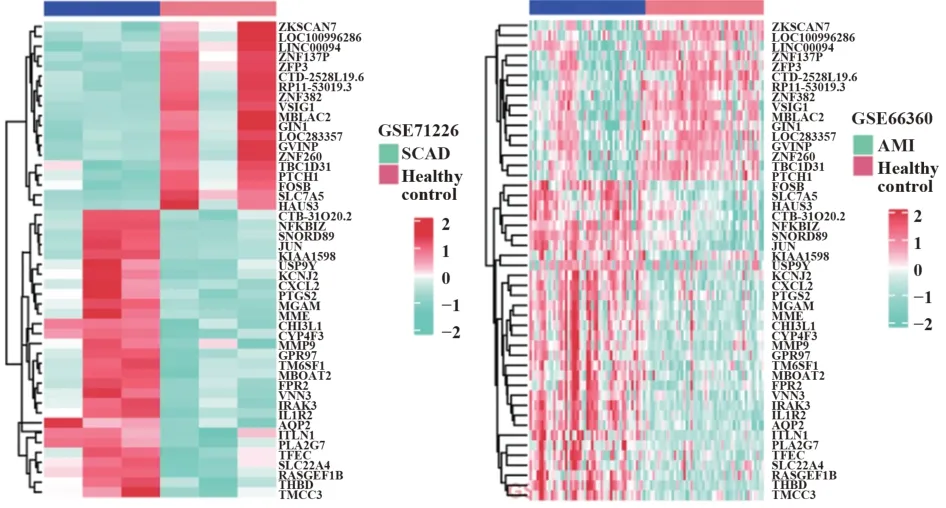
图2 GSE71226和GSE66360数据集中48个关键基因表达特点热图Fig.2 Heat maps of 48 key gene expression characteristics in GSE71226 and GSE66360 datasets
2.248个关键基因的GO与KEGG分析48个关键基因导入Metascape在线数据库,结果显示:GO分析主要富集于环磷酸腺苷反应、对应力刺激的响应及炎症反应等;KEGG分析主要富集于IL-17信号通路及PID IL1信号通路等(图3)。
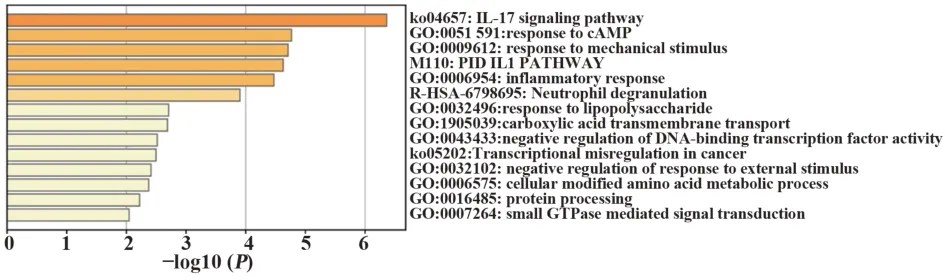
图3 48个关键基因的GO与KEGG分析Fig.3 GO and KEGG analysis of 48 key genes
2.348个关键基因的GSEA分析 为进一步鉴定48个关键基因中具有统计学差异的基因集,进行GSEA分析,结果显示:关键基因中正相关的前3位最丰富基因集为线粒体反应途径、反应途径及基于CRISPR与初级纤毛发育相关的基因;负相关的前3位最丰富基因集为中性粒细胞脱颗粒反应、人体补体系统及脊髓损伤(图4)。
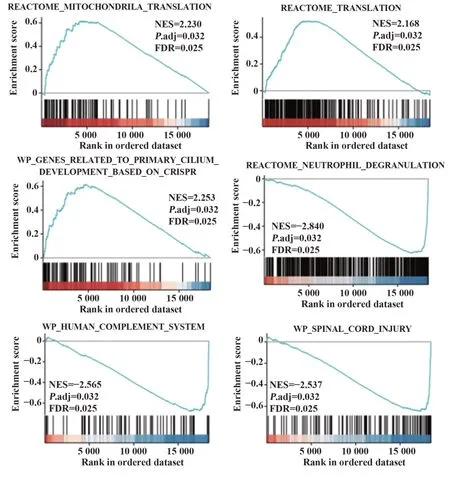
图4 48个关键基因的GSEA分析Fig.4 GSEA analysis of 48 key genes
2.448个关键基因的PPI网络构建和核心基因鉴定 为识别关键聚类,将48个关键基因导入STRING构建聚类PPI网络(图5A),PPI网络中有38个节点,23个边。采用Cytoscape中MCODE插件识别PPI网络中的核心基因,得分为4分,共获得4个核心基因:前列腺素内过氧化物合酶2(prostaglandinendoperoxide synthase 2,PTGS2)、转录因子AP(transcription factor AP-1,JUN)、CXCL2及MMP9,共4个节点,6条边(图5B)。
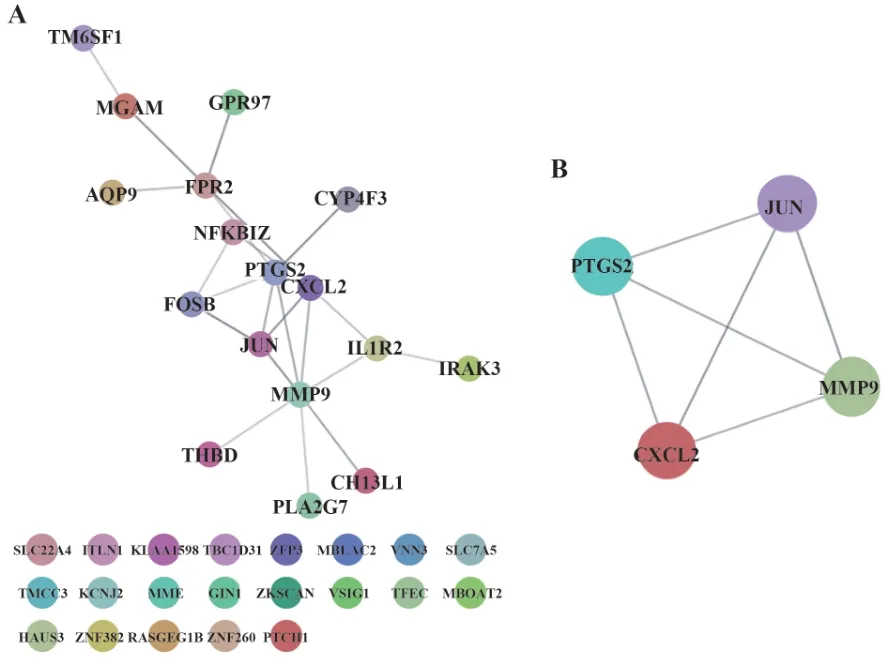
图5 48个关键基因的PPI网络构建和核心基因鉴定Fig.5 PPI network construction and core hub gene identification of 48 key genes
2.5GSE71226和GSE66360数据集的核心基因表达比较2个独立数据集GSE71226和GSE66360的基因表达谱中,提取核心基因PTGS2、JUN、CXCL2及MMP9表达。GSE71226数据集:SCAD组PTGS2、JUN、CXCL2及MMP9表达均高于健康对照组(P<0.05,图6A)。GSE66360数据集:AMI组PTGS2、JUN、CXCL2及MMP9表达均高于健康对照组(P<0.05,图6B)。
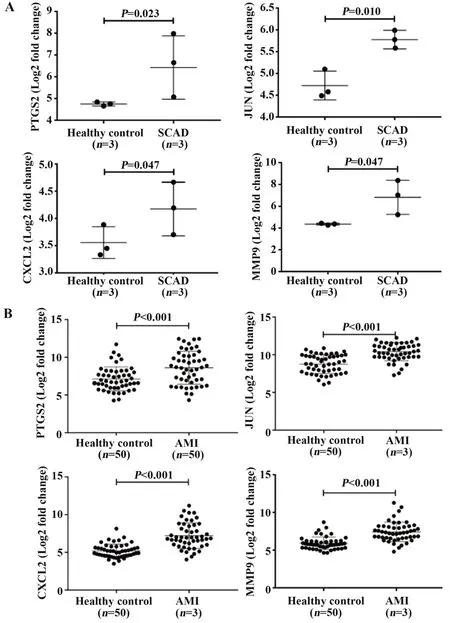
图6 GSE71226、GSE66360数据集中SCAD组与健康对照组PTGS2、JUN、CXCL2及MMP9表达Fig.6 PTGS2,JUN,CXCL2 and MMP9 expressions between SCAD group and healthy control group in GSE71226 and GSE66360 datasets
2.6临床数据集验证外周血核心基因表达SCAD组患者PTGS2、JUN、CXCL2、MMP9蛋白表达高于对照组(P<0.05),AMI组患者PTGS2、JUN、CXCL2、MMP9蛋白表达高于非AMI组(P<0.05,表1)。
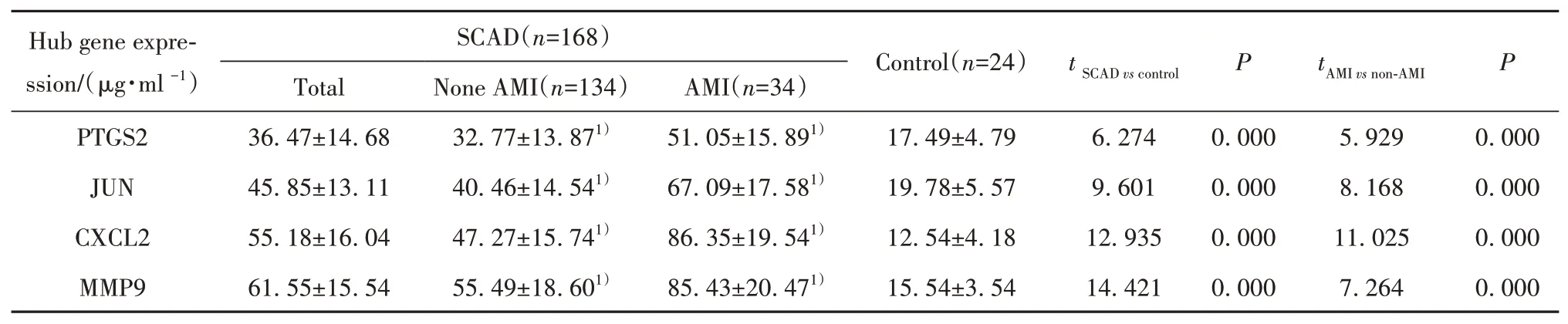
表1 SCAD组与对照组核心基因表达Tab.1 Hub gene expressions in SCAD group and control group
2.7外周血核心基因蛋白表达ROC曲线分析ROC曲线评估PTGS2、JUN、CXCL2及MMP9表达预测168例SCAD患者发生AMI的效能,PTGS2、JUN、CXCL2及MMP9 AUC分别为0.747(0.704~0.867)、0.775(0.714~0.887)、0.773(0.708~0.874)、0.850(0.794~0.972),见图7。
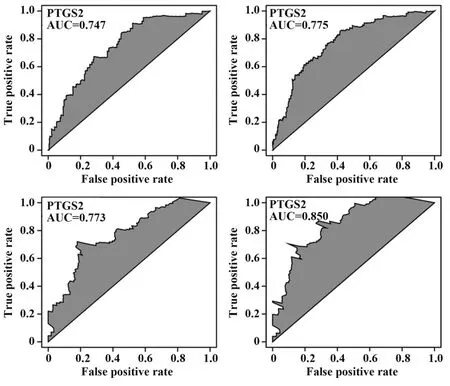
图7 外周血核心基因蛋白表达ROC曲线Fig.7 ROC curve of peripheral blood hub gene protein expression
3 讨论
SCAD向AMI进展的病理机制尚不清楚。虽有研究发现,糖尿病、高血压、高脂血症、吸烟和阳性家族史是SCAD进展为AMI的重要危险因素,但这些因素并不是SCAD向AMI进展的全部原因[10-11]。AMI患者中,20%患者无任何传统危险因素,50%患者仅有1个危险因素[12]。因此,阐述SCAD向AMI进展的潜在病理学机制可为AMI防治提供理论依据。本研究根据GEO数据集筛选出48个SCAD向AMI进展的潜在关键基因,采用PPI网络筛选出4个核心基因(PTGS2、JUN、CXCL2及MMP9),通过临床验证这些基因表达可靠地预测SCAD向AMI进展。
48个潜在关键基因的GO分析主要富集于环磷酸腺苷反应、对应力刺激的响应及炎症反应等。刘波等[13]发现环磷酸腺苷反应在AMI患者后心肌纤维化中起重要作用,且炎症反应也起重要作用[14]。KEGG分析主要富集IL-17信号通路及PID IL1信号通路等。自身免疫性疾病、心力衰竭、动脉粥样硬化和心肌缺血中,IL-17在保护宿主不受细胞外病原体侵袭和促进炎症病理方面发挥重要作用[15]。进一步研究表明,IL-17及其下游靶基因表达可能在诱导缺血性心力衰竭中起重要作用[16]。GSEA证明与SCAD向AMI进展相关的前3位显著富集基因集为线粒体反应途径、反应途径及基于CRISPR与初级纤毛发育相关的基因;负相关的前3位为中性粒细胞脱颗粒反应、人体补体系统及脊髓损伤。表明SCAD向AMI进展的潜在病理机制复杂,是多种机体反应参与及多种信号通路共同作用的结果。
聚类分析显示,PTGS2、JUN、CXCL2及MMP9是参与SCAD向AMI进展病理机制的核心基因。PTGS2是花生四烯酸转化为前列腺素的一种酶,与脑卒中和心肌梗死风险降低相关,也可通过促进增殖、抑制凋亡和血管生成参与肿瘤进展[17]。大鼠实验证实,PTGS2可通过氧化应激和炎症反应促进AMI进展[18]。JUN是二聚体转录复合物家族,参与多种细胞和生理功能,被认为是细胞外信号的主要承担者,使细胞适应环境变化,与移植排斥、纤维化、器官损伤、风湿性关节炎及哮喘等严重疾病有关,其介导的炎症反应途径能促进内啡肽表达和心肌纤维化[19-20]。研究表明,JUN表达增加与冠心病风险增加有关[19]。此外,JUN在人类颈动脉斑块中增加,与胆固醇酯相关,表明JUN可能是斑块易损的生物学标志[21]。CXCL2由激活的单核细胞和中性粒细胞产生并在炎症部位表达,损害机体心血管系统[22]。临床观察到AMI和SCAD患者CXCL2表达失衡,提示AMI患者免疫系统功能紊乱[23]。MMP9是锌依赖的内蛋白酶,负责组织重塑和细胞外基质蛋白降解,也是SCAD患者动脉粥样硬化斑块不稳定的独立预测因子,MMP9水平与冠状动脉粥样硬化斑块不稳定及坏死核心大小呈正相关[24-25]。PTGS2、JUN、CXCL2在SCAD向AMI进展中具体的病理机制尚未明确,但被证实与心血管疾病相关。
为进一步明确核心基因的临床表达,课题组进行了临床样本数据集验证。SCAD患者中观察到PTGS2、JUN、CXCL2、MMP9蛋白表达高于对照组;AMI组患者PTGS2、JUN、CXCL2、MMP9蛋白表达高于SCAD组。表明PTGS2、JUN、CXCL2、MMP9在SCAD向AMI进展的病理机制中扮演重要角色。ROC曲线分析结果显示,PTGS2、JUN、CXCL2及MMP9表达预测168例SCAD患者发生AMI的AUC分别为0.747、0.775、0.773、0.850,表明这些基因可有效预测SCAD向AMI进展。同时其鉴定可为后续药物靶点设计与开发提供理论基础。
本研究也存在局限性,一是本研究是在GEO数据集中分析筛选SCAD和AMI的外周血生物标志物,入组患者较少;二是经费限制,无法开展细胞层面的核心基因验证;最后,验证集样本量较小,需进一步证实。
综上,本研究采用GEO数据集鉴定出PTGS2、JUN、CXCL2、MMP9 4个核心基因,可能为SCAD进展为AMI的预防和治疗靶点开发提供理论依据。
