慢性阻塞性肺疾病合并肺癌患者的临床特征研究
2023-01-16黄少辉杨远舰梁超凡孙雅赵一兰王文强徐志伟张晓菊
黄少辉,杨远舰,梁超凡,孙雅,赵一兰,王文强,徐志伟,张晓菊
(郑州大学人民医院/河南大学人民医院/河南省人民医院 呼吸与危重症医学科,河南 郑州 450003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的慢性、进行性、可以预防和治疗的呼吸系统疾病,以持续存在的呼吸系统症状和气流受限为主要特点。据估计,2010年COPD全球患病率约为11.7%,死亡人数约占全球死亡人数的6%[1-2],而随着社会的发展、人口老龄化问题和空气环境污染问题逐渐的恶化,COPD在全世界范围内的患病率也将逐年增长。近年来,越来越多研究表明COPD和肺癌存在许多联系,COPD是肺癌发展的独立危险因素[3],而COPD的存在增加了肺癌的发病率和死亡风险[4]。在疾病的发生过程中,二者具有许多共同影响因素,如吸烟、职业暴露和空气污染等[5-6]。而COPD的存在也严重影响了肺癌患者的生存预后[7]。COPD易掩盖早期肺癌临床症状,患者容易忽视对肺癌的筛查,临床确诊肺癌时往往已是晚期,并且COPD患者心肺功能差,因此对COPD合并肺癌的治疗非常困难[8]。本文旨在通过对COPD合并肺癌患者和单纯COPD患者的临床资料进行分析总结,以期提高临床对COPD合并肺癌患者的认知,并尽早做到对COPD可能进展为肺癌风险的二级预防,达到降低COPD合并肺癌患者的发病率和病死率的目的。
1 资料与方法
1.1 临床资料选择2021年3月至2022年7月在河南省人民医院呼吸与危重症医学科住院治疗的4 728例患者,依据纳入标准和排除标准筛选出符合本项目要求的且有明确病理学证据支持的70例COPD合并肺癌患者为观察组,在同期住院的COPD患者中随机选取72例为对照组。搜集整理归纳观察组和对照组患者的临床资料,包括患者的性别、年龄、吸烟史、临床表现、实验室辅助检查、首次确诊肺癌的方式、病理学检查、肺癌位置、TNM分期、转移情况等,进一步进行描述和分析。
1.2 纳入与排除标准(1)纳入标准:①既往有明确COPD病史,COPD诊断符合2022版《Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease:2022 Report》[9]中的诊断标准;②有明确的病理学证据,病理需按照WHO胸部肿瘤分类(第5版)[10]肺部肿瘤组织分类复阅证实为肺癌;③肺癌TNM分期采用美国癌症联合会2016年第8版分期标准[11]。(2)排除标准:①合并有结核、间质性肺病、支气管扩张、尘肺病等其他呼吸系统疾病;②合并其他器官或系统恶性肿瘤;③合并有心脏病、严重肝肾功能损害等疾病。
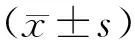
2 结果
2.1 一般资料两组年龄、性别、是否吸烟、吸烟指数比较差异无统计学意义(P>0.05)。见表1。

表1 观察组与对照组一般资料比较
2.2 临床表现两组咯血、消瘦、胸痛、肺不张、胸腔积液比较,差异有统计学意义(P<0.05);两组咳嗽、咳痰、胸闷、发热比较,差异无统计学意义(P>0.05)。见表2。

表2 观察组与对照组临床表现比较[n(%)]
2.3 实验室辅助检查结果观察组外周血中性粒细胞计数、嗜酸性粒细胞计数、血小板计数及C反应蛋白水平高于对照组(P<0.05);对照组血红蛋白水平高于观察组(P<0.05);两组外周血白细胞计数比较差异无统计学意义(P>0.05)。见表3。

表3 观察组与对照组实验室辅助检查结果的对比情况
2.4 观察组的肺癌确诊方式、病理类型、解剖学位置、分期分级及远处转移的情况本研究中,观察组确诊肺癌的方式有4种,其中经气管镜活检确诊的有45例(64.29%),经皮肺穿刺活检确诊的有11例(15.71%),经手术切除确诊的有6例(8.57%),经胸腔积液细胞学检查确诊的有7例(10.00%),经气管镜活检在所有确诊方式中最为常用。70例肺癌患者中,重要病灶分布为左肺上叶25例(35.71%),左肺下叶7例(10.00%),右肺上叶20例(28.57%),右肺中叶6例(8.57%),右肺下叶11例(15.71%),纵隔1例(1.43%),以右肺肺癌最多见。肺癌类型主要分为4种,分别为鳞癌30例(42.86%),腺癌30例(42.86%),小细胞癌8例(11.43%),其他类型2例(2.86%),以鳞癌和腺癌为主。TNM分期为Ⅰ~Ⅱ期共11例(15.71%),Ⅲ~Ⅳ期共59例(84.29%),Ⅲ、Ⅳ期患者最多。确诊时60例患者已发生淋巴结或远处转移(85.71%),10例患者未转移(14.29%)。
3 讨论
COPD和肺癌在全世界具有较高的发病率和病死率[12]。随着研究深入,COPD越来越被认为是一种具有多种肺部和肺外表现的疾病,有研究表明,COPD可增加肺癌的患病风险[13],而50%~80%的肺癌患者亦患有COPD[14],而肺癌是全球癌症相关死亡最主要的原因。根据最新数据显示,2020年全球新发肺癌人数220万,肺癌死亡人数180.0万,是全球第二大常见癌症,也是癌症死亡的主要原因[15]。2015年我国肺癌新发人数为78.7万,死亡人数为63.1万,病死率居首位,与以往数据相比,发病率和病死率均呈持续上升趋势[16]。
因此肺癌和COPD的危害均不容忽视,长期以来,许多研究者对这两种疾病进行了大范围的临床研究和探索。有研究显示肺癌在COPD人群中的发病率是正常人群的2~4倍[17-19],而伴有COPD的肺癌患者3 a存活率仅是单纯肺癌患者的15%~26%[3]。二者具有相同的病因(吸烟),通常在日常临床实践中共存,但其临床症状具有一定的相似性,难以鉴别,大多肺癌确诊时已达晚期,错过最佳治疗时间,预后较差。
目前,COPD与肺癌在日常临床诊疗过程中已相当常见,研究表明,年龄是COPD发生的危险因素,随着年龄的增大,COPD的发生风险逐渐增大[20]。本研究中,142例患者中84.5%均大于60岁,这提示在≥60岁的人群中筛查COPD具有重要临床意义。除了年龄以外,性别也是影响COPD发生的因素。有研究表明,COPD男性发病率是女性的2倍[20]。但一项对近50 000例COPD加重住院患者的研究发现,只有1 833例患者(4%)是女性[21]。我国一项多中心横断面调查显示,429例COPD急性加重患者中,只有101例女性患者[22]。结合本研究结果,女性患者只占有14.1%,性别比例与其他研究结果相似,这可能与男性COPD患者更容易受到危险因素暴露导致住院有关。COPD急性加重导致住院可由多种因素引起,最常见的原因是上呼吸道感染及支气管感染[23]。因此,在COPD患者的日常管理中,要注意个人防护,避免危险因素暴露,减少急性加重导致的住院频率。
本研究通过分析142例患者的临床资料发现,COPD合并肺癌患者出现咯血、消瘦、胸痛、肺不张、胸腔积液等临床症状的发生率高于对照组,而咳嗽、咳痰、胸闷、发热等症状的发生率未见明显差异,这与国内许多研究结果一致[24-26]。有研究发现,COPD合并肺癌患者比单纯肺癌患者的预后更差[27-28]。本研究中84.29%的肺癌患者确诊时处于Ⅲ期或Ⅳ期,已丧失了手术治疗机会,通常预后不佳,由此表明一旦COPD患者出现无明显诱因的咯血、消瘦、胸痛、肺不张、胸腔积液等情况时,需高度警惕是否有肺癌的发生。
COPD合并肺癌患者血液指标的异常机制目前尚不明确,可能与肺癌的副肿瘤效应有关[26]。目前有研究表明,慢性炎症在肺癌和COPD这两种疾病中都起着重要作用。然而,肺癌患者的炎症更明显[29]。本研究结果提示,两组中性粒细胞计数、血红蛋白水平、嗜酸性粒细胞计数、血小板及C反应蛋白有差异。目前认为,炎症与肿瘤微环境的形成密不可分。由于长期吸烟、持续粉尘或污染物等的影响,COPD患者肺部常存在持续的慢性炎症反应,且与疾病严重程度呈正相关[30]。COPD患者肺部持续存在的慢性炎症营造了特殊的细胞毒性环境,这种毒性环境能抑制癌症的生长,但利于肿瘤的发生。但一旦肿瘤形成,其可释放细胞因子和趋化因子来改变周围微环境,从而导致周围免疫细胞组成的改变[31]。结合本研究结果,两组间中性粒细胞计数、血红蛋白水平、嗜酸性粒细胞计数的差异可能是肺肿瘤改变了周围免疫细胞所造成的。癌症可引起血液高凝状态,可促进血小板的产生,增加肺肿瘤周围环境中血小板的浸润,进一步改变肿瘤微环境,促进了肺腺癌的发生[32]。C反应蛋白作为一种慢性炎症标志物,其升高增加了肺癌的发生风险[33]。这提示在COPD患者肺癌筛查过程中,需要重点关注血液指标变化,尤其是血小板和C反应蛋白的变化趋势。
综上所述,一旦COPD患者出现咯血、消瘦、胸痛、肺不张、胸腔积液等症状,中性粒细胞计数、嗜酸性粒细胞计数、血红蛋白水平,尤其血小板计数和C反应蛋白等出现异常改变时,需高度警惕肺癌的发生,建议及早进行肺癌筛查,做到肺癌的早期诊断。
