一株产蛋白微藻Desmodesmus abundans ZM-4的单细胞分选、鉴定及对养猪废水降解特性研究
2023-01-16赵昕悦孟祥伟李春艳
赵昕悦,孟祥伟,刘 妍,李 航,李 备,李春艳
(1.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030;2.长春长光辰英生物科学仪器有限公司,吉林 长春 130033)
养猪废水是农业污染的重要源头,同时也被认为是地表水富营养化的主要原因.养猪废水是一种典型的低C/N废水(COD浓度400~20 000 mg/L,总N浓度200~16 000 mg/L),具有水质波动大、有机物浓度高等特点,威胁水生生态系统的稳定和人类健康,因此,如何经济有效地处理养猪废水成为急需解决的重要问题.
微藻是一种低等的古老生物,具有高效地获取和利用营养物质进行生长繁殖的能力.它们自身携带叶绿体能进行光合作用,部分微藻还能利用有机物进行异养生长.与光合植物相比,微藻生长速度快,对外界的环境有较高耐受性,在实现废水净化方面具有巨大潜力[1].微藻用于养猪废水的处理,不仅可以让微藻利用废水中高浓度的碳、氮、磷等元素作为营养来源进行生长代谢,同时还可以合成蛋白质、油脂、多糖等生物质,并在细胞内大量富集[2].而且,微藻细胞富含的多种高价值生物质在食品、医药、工业材料等方面都有着重要的应用潜力.基于此,可以在利用微藻降解废水中有机物的同时,实现废水的资源化利用.近年来,随着全球资源与能源危机问题的逐步凸显,微藻的开发与利用已成为环境治理和生物质能源生产关注的焦点.由于微藻对废水的净化能力比较依赖微藻自身的生长状况,所以,筛选出对于废水具有优良净化效果的藻种,在后续废水治理方面将有重大的研究意义[3].当前最常用的微藻筛选方式是基于三区画线操作的平板分选方法,这种方法虽然操作要求简单,但多次划线增大了染菌概率,分选效率极低,且不适用于从环境背景复杂的样本中分离出目标微藻[4].
单细胞分离培养法是通过一定的单细胞分选设备,从群体中分离出来单个生物细胞,再对得到的单细胞进行扩大培养,这种分选方法可直接实现对单细胞的原位研究[5].传统的单细胞分选包括荧光激活细胞分选和磁激活细胞分选等,这些基于外部基因编码的荧光蛋白标记或磁性分子和化合物标记进行的细胞预分选方法,由于外加标记或修饰,可能会影响甚至改变细胞原本的状态[6-7].Yuan等[8]研究发现,在进行单细胞分选工作时产生的激光辐射可对一些细胞造成损伤,这种损伤会导致细胞无法进行后续扩大培养.此外,传统的单细胞分选方法还有流式细胞术、激光显微切割等,但由于微生物通常形态较小,难以使用这些方法实现准确分离[9-10].不可视、准确性低、识别方式单一、分选尺寸受限、上样量大等问题都是传统单细胞分选技术所遇到的瓶颈.因此,寻找无损、可视化、能够精准定位目标细胞并广泛适用的细胞分选技术平台是发展单细胞分析科学的必要条件.相比传统单细胞分选方法,基于激光诱导向前转移(LIFT)的单细胞分选技术可以免标记、非接触、精准无损地分离出单个目标微藻细胞.此技术基于激光与物质相互作用的原理,具有独特的可视化分选功能,所见即所得,可以实现对复杂生物样本中单细胞的逐一精准分离,其操作简单,能够广泛适用于不同尺寸、形态细胞的分离[11-12].具体而言,此分选技术集显微成像与细胞分离为一体,可基于细胞形态识别目标细胞,分选过程中光与细胞不发生直接作用,不会对细胞活性产生影响;具有高精度多维运动系统,可实现亚微米级微生物细胞的精准定位,配合图像算法,实现自动聚焦、多细胞自动识别、高通量自动分选等功能,因此能够保证纯度,避免杂细胞污染;具有全自动细胞接收系统,定位精度可达100 nm,确保单细胞准确接收.
本文利用单细胞分选仪(PRECI SCS),基于LIFT技术从哈尔滨周边某养猪场附近的人工湿地水体中直接分选目标——单细胞微藻,对筛选后的微藻单细胞进行了富集、扩大培养,以用于后续的废水处理及资源化产物分析;通过对分选微藻进行鉴定、生长特性及理化性质分析,探讨了微藻对蛋白质、油脂、多糖的积累性能,以及微藻在不同温度、pH、废水浓度、光照时间、光照强度的条件下对养猪废水中COD、总氮、总磷降解能力的影响,以为实现微藻处理污水并实现产业化应用提供技术储备和理论依据.
1 实验材料与方法
1.1 实验材料
实验试剂:重铬酸钾、硫酸、钼酸铵、酒石酸锑氧钾、抗坏血酸、过硫酸钾、氢氧化钠、氯化氢等,其中所用化学试剂均为分析纯,实验用水为去离子水.
实验仪器:单细胞分选仪器(HOOKE PRECI SCS)、生化培养箱(BSP-100)、可见分光光度计(UV-1800PC)、磁力搅拌器(MSB-1C)、COD消解仪(58-3C)、高温灭菌锅(LDZX-30KBS)等.
样品采集:实验所用微藻源取自哈尔滨周边某养猪场附近人工湿地的水体.
微藻培养基:采用BG11培养基,组分为:NaNO31.5 g/L,K2HPO4·3H2O 0.04 g/L,MgSO4·7H2O 0.075 g/L,CaCl2·2H2O 0.036 g/L,C6H8O70.006 g/L,C6H8FeNO70.006 g/L,EDTA 0.001 g/L,Na2CO30.02 g/L,H3BO30.002 86 g/L,MnCl2·H2O 0.001 81 g/L,ZnSO4·7H2O 0.000 222 g/L,CuSO4·5H2O 0.000 079 g/L,Na2MoO4·2H2O 0.000 39 g/L,Co(NO3)2·6H2O 0.000 049 g/L.
养猪废水配方:实验所用养猪废水配方及成分见表1

表1 不同初始COD浓度的养猪废水指标 g
1.2 实验方法
1.2.1 单细胞分选
分选操作前,将收集的水样充分摇匀并混合均匀,取 2 μL样品于分选芯片上,通过单细胞分选仪对样品中的细胞进行显微成像.其后,在显微成像中定位目标——微藻单细胞并进行单细胞分离和接收.将接收器接收的微藻单细胞转移到含有3.0 g/L葡萄糖的BG11液体培养基的细胞培养管中,置于振荡培养箱中进行培养,培养条件30℃、24 h光照、转速400 r/min.若单细胞可成功进行增殖,则将此藻液继续转移到含有3.0 g/L葡萄糖的BG11液体培养基中进行扩大培养.从扩大培养后的藻液中转移15 μL藻液于BG11固体培养基中进行三区划线直至出现单藻落.
1.2.2 目标微藻的18SrRNA鉴定
三代纯化后,挑取含有BG11固体培养基的平板中的单藻落,提取微藻总DNA,并采用通用引物18SF(5′-CCTGGTTGATCCTGCCAG-3′)和18SR(5′-TTGATCCTTCTGCAGGTTCA-3′)进行PCR扩增,由北京六合华大基因科技有限公司进行18SrRNA测序.测序结果通过比对NCBI数据库,基于分子生物学手段判断目标藻样品的种属水平分类学信息,并采用MEGA7平台构建系统发育树[13].
1.2.3 微藻理化性质测定
(1)油脂的测定:利用干重法对微藻的油脂含量进行测定.用移液枪吸取20 mL藻液至50 mL离心管中,8 000 r/min条件下离心10 min;倒掉上清液后,用去离子水反复清洗3次并收集藻样,将收集的藻样转移至新的10 mL离心管中.加入2 mL的氯仿和4 mL的甲醇,以超声功率400 W工作5 s 间歇2 s的破碎条件超声破碎10 min,4 500 r/min离心10 min,用新的离心管收集上清液.最后,在含有上清液的离心管中加入2 mL 1% 的氯化钠溶液,静置分层,下层液体即为油脂和氯仿的混合物,将下层混合物吸取到已经称过重的空试管中.在含有藻液的离心管中继续加入2 mL氯仿和4 mL甲醇,重复上述步骤,直至藻体颜色变白.将空白试管的质量记为m1,将装有油脂和氯仿混合物的试管置于65℃水浴锅中蒸干,蒸干后对试管进行称量,质量记为m2,油脂的最终质量即为m2-m1.
(2)多糖的测定:采用改良的蒽酮-硫酸法对微藻中的多糖进行测定.首先,以葡萄糖为对照品绘制葡萄糖标准曲线:称取干燥的葡萄糖0.1 g,将其定容至100 mL后混匀;从中分别取 0,0.25,0.5,1.0,2.0,4.0,5.0,7.5 mL并定容至50 mL,配制成5,10,20,40,80,100,150 mg/L的系列标准溶液;再分别从中取1 mL,加入4 mL的蒽酮-硫酸溶液,混匀后置于沸水浴 10 min,冰浴后于 620 nm条件下测吸光值;以葡萄糖浓度为横坐标、吸光值为纵坐标绘制标准曲线.然后,称取微藻干粉1 g,先使用 80%的乙醇去除叶绿素,再使用高氯酸水解淀粉和多糖,离心.此过程重复3次,合并收集上清液.以4倍体积向提取的浓缩液中加入Sevage试剂(V(氯仿)∶V(正丁醇)=4∶1)进行脱蛋白处理,再加入无水乙醇使得乙醇终浓度为80%,4℃条件下放置24 h后离心.向沉淀中加入80%的乙醇溶液进行洗涤并离心,重复3次.最后,所得沉淀复溶后按照标准曲线的测定方法测定样品620 nm下的吸光值,并通过标准曲线方程计算提取的微藻产多糖的质量.
(3)蛋白质的测定:采用Bradford法对微藻中的蛋白质进行测定.将微藻细胞用1× PBS稀释,按照Bradford测定法的蛋白质定量检测试剂盒(中国生工生物工程有限公司)说明书操作测定.
1.2.4 单因素实验
提高微藻规模生产在经济上的可行性,微藻需具有较高的生长速度和生物质产量[14].在处理养猪废水过程中,微藻的有效生长与培养条件密切相关,例如:养猪废水的浓度、pH、光照时间、光照强度、温度和碳氮比等.然而,微藻在不同的培养条件下,其生长与生物量的产生具有较大的差异,进而对废水的处理能力有着显著的影响.因此,本文根据以上6种因素设计单因素实验,分析微藻去除养猪废水中COD及总N(TN)、总P(TP)的能力.
将150 mL养猪废水分别装至锥形瓶中,调节pH,依次放入转子后做好标记,并在121℃条件下灭菌20 min.取10 mL藻液,离心处理后弃上清,将藻细胞转接到养猪废水中.不同组单因素实验条件如下:
(1)设定养猪废水COD初始浓度为200,400,600,800 mg/L,固定其他培养条件:pH=7,光照时间24 h,光照强度4 000 lx,温度为30℃,碳氮比为8∶1.设置4组平行实验.
(2)设定养猪废水的pH分别为5,6,7,8,固定其他培养条件:初始COD浓度为400 mg/L,光照时间24 h,光照强度为4 000 lx,温度为30℃,碳氮比为8∶1.设置4组平行实验.
(3)设定光照时间为0,8,16,24 h,固定其他培养条件:初始COD浓度为400 mg/L,pH=7,光照强度为4 000 lx,温度为 30℃,碳氮比为8∶1.设置4组平行实验.
(4)设定光照强度为0,2 000,4 000,6 000 lx,固定其他培养条件:初始COD浓度为400 mg/L,光照时间 24 h,pH=7,温度为 30℃,碳氮比为8∶1.设置4组平行实验.
(5)设定培养温度为20℃,25℃,30℃,35℃,固定其他培养条件:初始COD浓度为400 mg/L,pH=7,光照时间 24 h,光照强度为4 000 lx,碳氮比为8∶1.设置4组平行实验.
(6)设定养猪废水的碳氮比为1∶1,4∶3,8∶1,15∶1,固定其他培养条件:初始COD浓度为400 mg/L,pH=7,光照时间24 h,光照强度为4 000 lx,温度为30℃.设置4组平行实验.
待实验按照上述条件进行时,分别于12,24,36,48,60 h 取样20 mL,离心取上清液,上清液过0.22 μm滤膜后测定养猪废水中COD及TN,TP的含量.
2 结果与讨论
2.1 微藻单细胞的分选
通过基于激光诱导向前转移(LIFT)单细胞分选技术识别并分选样品中的微藻,其过程原理如图1(a)所示.应用PRECI SCS单细胞分选仪,利用激光将微藻单细胞从分选芯片上分离至采集器中,以此来获得微藻单细胞,这种方法保证了单细胞微藻纯度以及分选的准确性,防止杂菌污染.LIFT细胞分选作为一种非接触性的分选方法,在最大程度上降低了分选过程对单细胞的影响,使单细胞后续可培养至单藻落.结合图1(b)的显微成像图可以观察到,分选前在芯片上可以清晰地观察到目标藻单细胞,且接收器视场中无任何细胞.分选后,可观察到目标藻细胞从芯片上消失,而视野中的其他非目标藻细胞未发生变化,目标藻细胞出现在收集器中,形态保持完整,且收集器中未混入其他细胞.
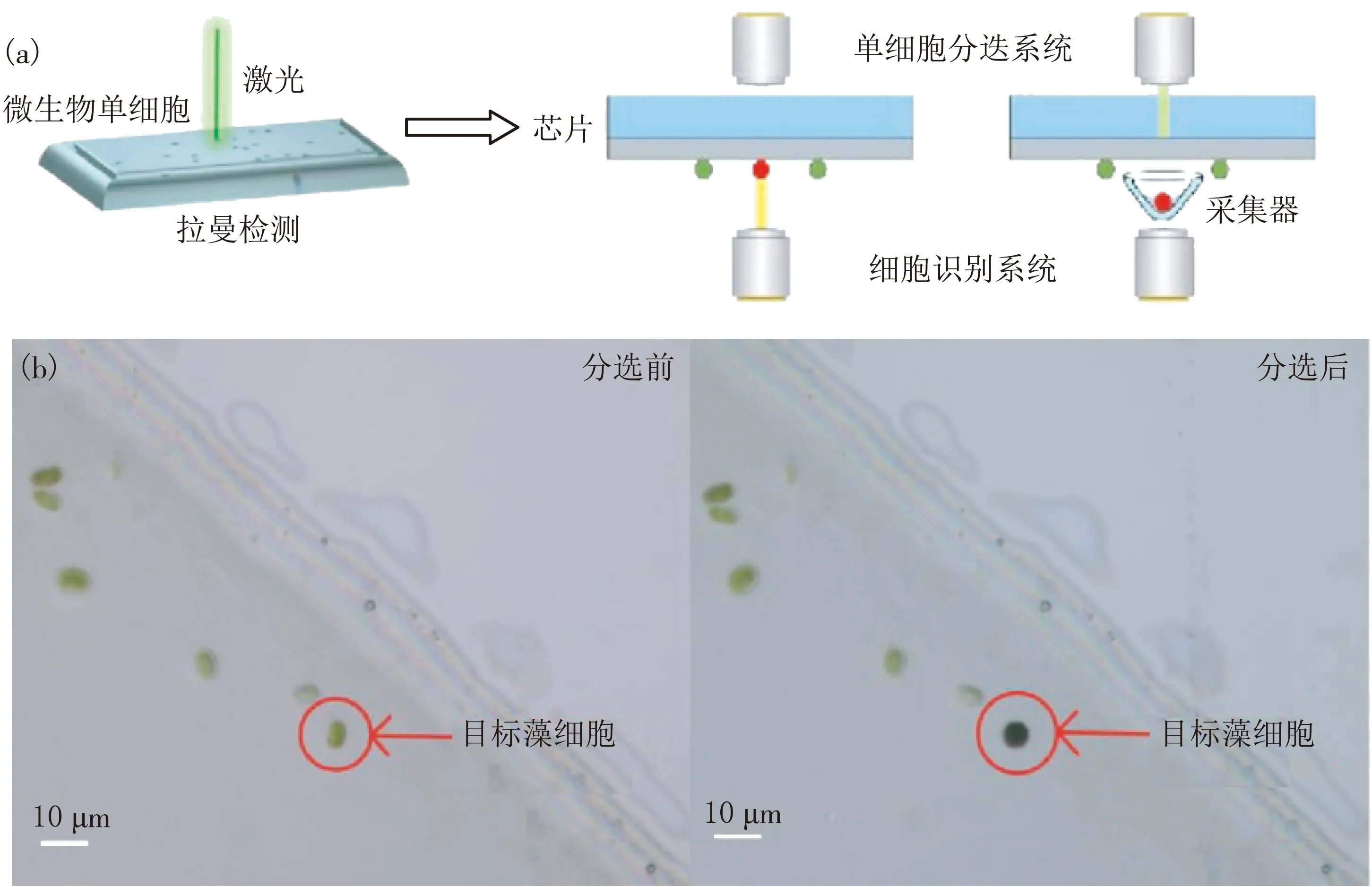
图1 微藻单细胞分选原理(a)及微藻单细胞分选前后结果对比(b)
2.2 微藻种属鉴定
通过单细胞分选仪收集的细胞经过扩大培养后的显微成像见图2(a),其中的微藻细胞呈现浅绿色,椭圆形,细胞壁光滑.根据18SrRNA分子生物学鉴定结果(见图2(b)),该株微藻与DesmodesmusabundansCCAP 258/213 相似性为99.94%,因此,确定该株微藻属于Desmodesmusabundans,并将其命名为ZM-4.
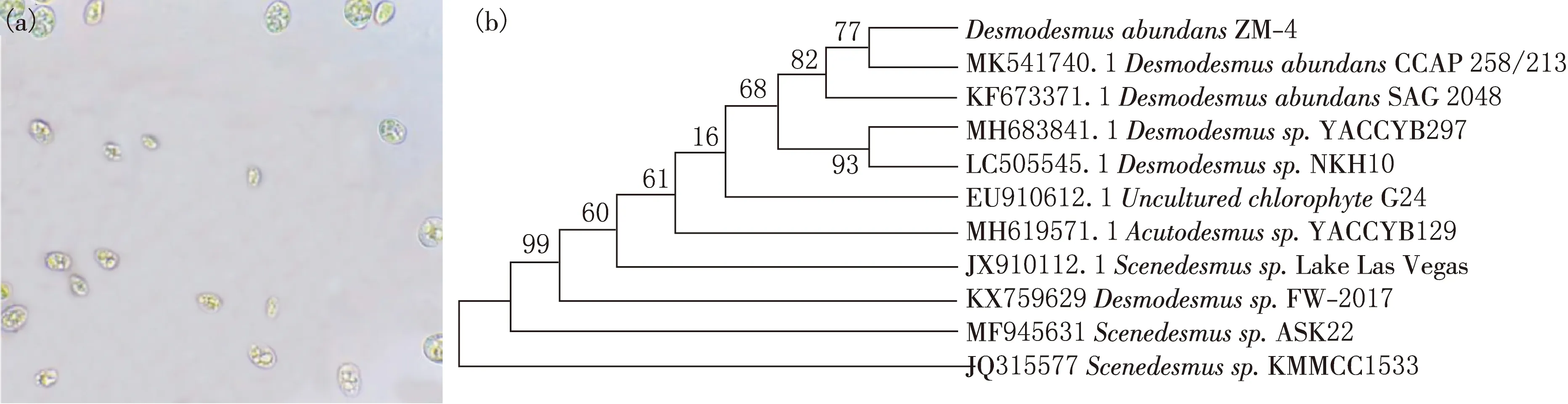
图2 微藻ZM-4光学显微镜成像图(a)及基于18SrRNA的系统发育树(b)
2.3 微藻ZM-4的理化性质
微藻细胞内含有丰富的生物质能源,本文测得的实验微藻油脂产量为108.3 mg/g、蛋白质产量为190.7 mg/g、多糖产量为126.3 mg/g,因此判断本研究分选的微藻ZM-4偏向于产蛋白.这些产物后续均可以作为生物柴油生产来源、食品加工原料和养猪场部分蛋白饲料的替代品等用于人类生产生活[15].此外,本实验测定的3种成分在微藻中的含量占比均在 10%~20%,除上述已测成分外,微藻细胞也可产生不同质量分数的色素、维生素和矿物质等资源化有机质[16].
2.4 微藻ZM-4的生长
以取样时间为横坐标,D(680)为纵坐标,利用Origin软件绘制微藻ZM-4生长折线图(见图3).由图3可见,微藻ZM-4在一个生长周期中,D(680)=0.028~0.156.在前6 h,微藻ZM-4的D(680)由0.028增长至0.035,此过程微藻ZM-4生长缓慢;6 h后,D(680)迅速增加,微藻生长速度明显增大,在28 h时D(680)达到0.155;此后D(680)变化不大,微藻生长速度开始减慢,在30 h时D(680)稳定至0.156;随后在34 h时微藻生物量开始降低,进入衰亡期.
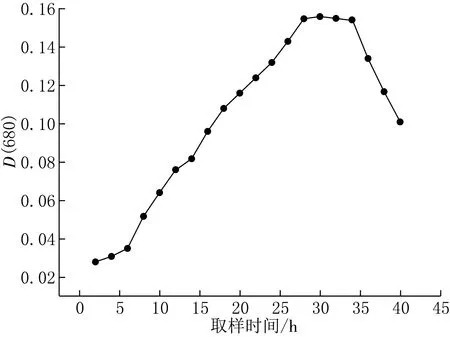
图3 微藻ZM-4生长曲线
2.5 不同条件下微藻ZM-4对养猪废水降解能力
2.5.1 不同初始废水浓度
养猪废水的浓度对微藻ZM-4降解废水中COD和TN,TP的能力有一定影响.由图4可见,除12 h取样时间点以外,其他时间的取样点均呈现出废水浓度越高、微藻降解能力越强的趋势.Converti等[17]的研究表明,氮含量的减少会抑制微拟球藻(Nannochloropsisoculata)的光合作用与呼吸作用.因此推测随着养猪废水中氮含量的增加,促进了微藻的光合作用,导致微藻的光合作用能吸收更多的二氧化碳并提高微藻对于COD和TN,TP的去除效果[18].而在降解的前12 h,可能由于微藻生物量和光合效率较低,因此不具备降解高浓度废水的能力.总的来说,ZM-4的降解能力随着废水浓度的增加而增加,当废水中COD浓度为800 mg/L时,微藻对COD和TN,TP的降解率呈现最高水平,分别为59.93%,61.5%,43.44%.
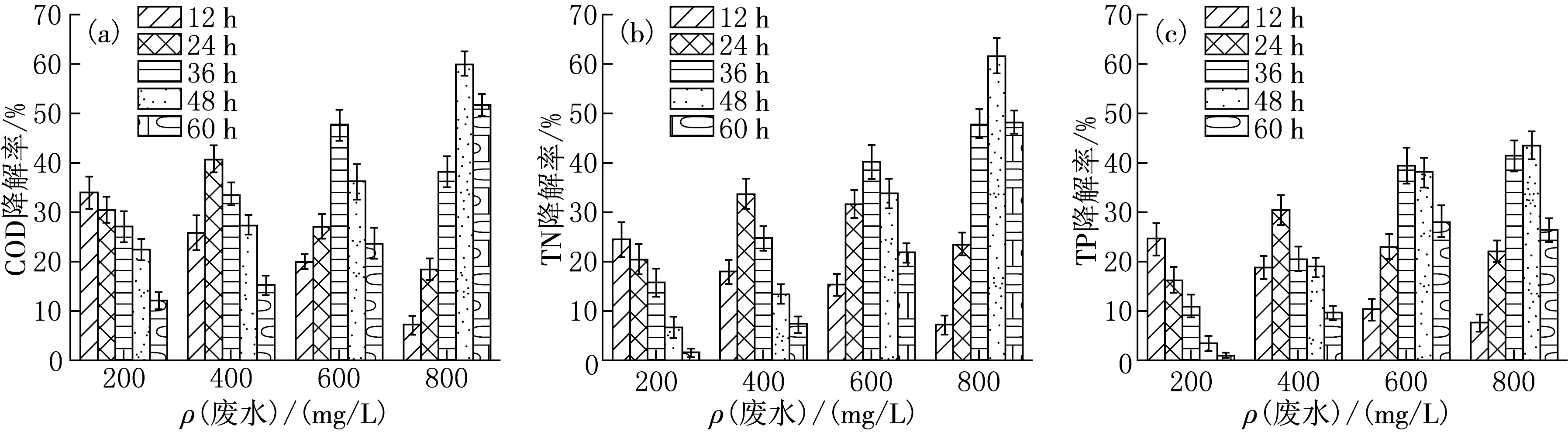
图4 不同废水浓度下Desmodesmus abundans ZM-4的COD降解效率(a),TN降解效率(b),TP降解效率(c)
2.5.2 不同pH
相关研究[19]表明,微藻生长的最适pH范围一般为6~8,图5所示结果也符合这一规律,在pH=6~8时微藻对COD和TN,TP的降解效果更优.而在pH=5的偏酸环境中,微藻对污染物的降解效果略显下降,但小范围变化的酸碱度对微藻的生长影响不大[20].此外,不同取样时间对应的降解率会随时间呈现先升高后降低的趋势.在降解36 h时,微藻的降解能力最优.总体而言,当pH=7时,微藻对COD和TN,TP的降解率呈现最高水平,分别为 43.06%,34.91%,30.46%.

图5 不同pH条件下Desmodesmus abundans ZM-4的COD降解效率(a),TN降解效率(b),TP降解效率(c)
2.5.3 不同光照时间
由图6可见,随着光照时间的增长,微藻降解能力整体呈现正增长趋势.光照时间为24 h时,降解效果最优,这可能是由于光照时间的增加促进了微藻的光合作用.但在0 h光照条件下,微藻也存在着一定的降解COD和TN,TP的能力,推测可能是由于微藻在无光照环境下仍可进行内源呼吸代谢作用,因此对废水中的COD和TN,TP存在着一定的降解能力.根据本实验的结果,微藻ZM-4的降解能力在光照时长为24 h时呈现最高水平,COD降解率为 40.63%,TN降解率为 33.65%,TP降解率为 34.32%.
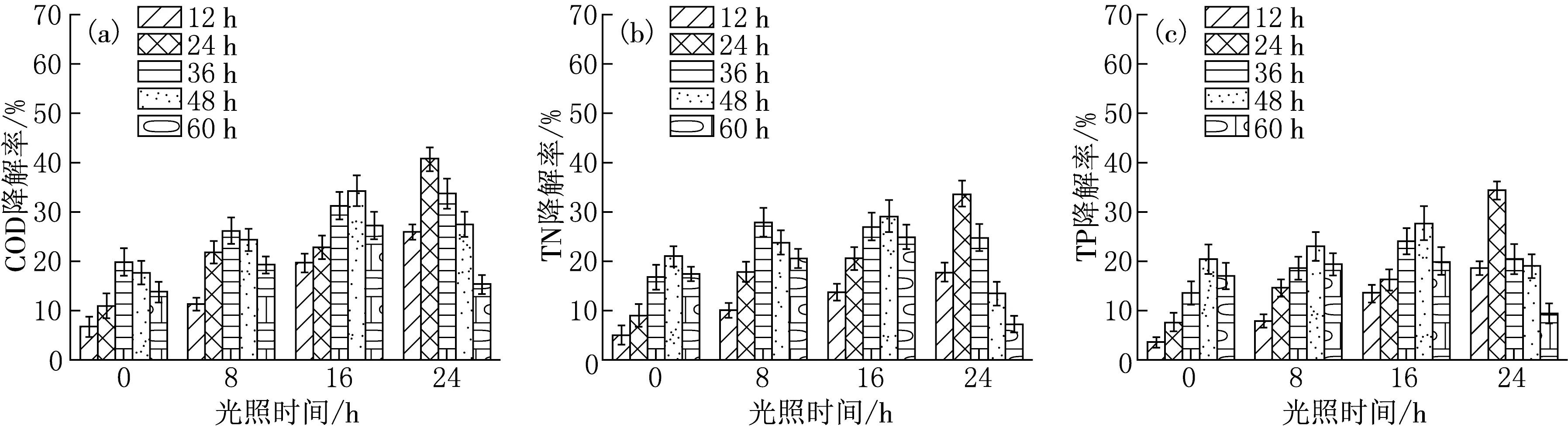
图6 不同光照时间条件下Desmodesmus abundans ZM-4的COD降解效率(a),TN降解效率(b),TP降解效率(c)
2.5.4 不同光照强度
在其他环境因子和营养源不限制微藻生长的条件下,光照强度是影响藻细胞生长代谢的重要因子之一.由图7可见,随着光照强度的增加,微藻降解能力逐渐增强.这是因为光合作用的增强,刺激了微藻的呼吸作用,从而为碳、氮、磷等代谢过程提供了大量氧气和能量,导致降解能力的提高.当光照强度达到6 000 lx时,微藻ZM-4的生长与降解在48 h和60 h出现光抑制现象.光照强度直接影响微藻的光合作用进而影响其降解能力,当光照强度过饱和时,微藻生长量过多,细胞间相互遮蔽反而抑制了光合作用[21],这可能是微藻降解能力在48 h和60 h有所降低的原因.由图7可知,微藻ZM-4的降解能力在光照强度为6 000 lx时呈现最高水平,COD降解率为40.63%,TN降解率为33.65%,TP降解率为34.32%.

图7 不同光照强度下Desmodesmus abundans ZM-4的COD降解效率(a),TN降解效率(b),TP降解效率(c)
2.5.5 不同温度
温度直接影响微藻对废水中COD和TN,TP的降解效果.在25℃~35℃范围内,污染物降解率较高,当高于最适温度,微藻的生长将会减慢甚至停止生长,微藻的降解能力相对减弱.当温度较低时,微藻由于细胞内酶的活性下降,主要依靠光合作用从外界环境获取能量以维持生存所需,导致降解能力下降.温度通过两方面影响微藻ZM-4的生长与降解能力,一是温度变化对废水中的碳、氮、磷含量有一定影响;二是温度影响微藻细胞内酶的活性[22].本文的研究结果表明,微藻ZM-4的降解能力在30℃时最优,此时对COD的降解率为40.63%,对TN的降解率为33.65%,对TP的降解率为30.32%.

图8 不同温度条件下Desmodesmus abundans ZM-4的COD降解效率(a),TN降解效率(b),TP降解效率(c)
2.5.6 不同碳氮比
由图9可见,微藻ZM-4对COD和TN的降解率随着碳氮比的增大表现出先升高后降低的趋势.相关研究[23]表明,氮浓度不足会限制微藻中叶绿素的含量,进而抑制微藻的光合作用、降低微藻的生物量,这可能就是碳氮比为15∶1时微藻降解率下降的原因.微藻对TP的降解则随着碳氮比的增大而升高,在碳氮比为15∶1时,微藻对TP的降解率相对最高.综合以上结果,微藻ZM-4对COD和TN的降解能力在碳氮比为8∶1时最高,降解率分别为40.91%和41.26%;对TP的降解能力在碳氮比为15∶1时最高,降解率为62.58%.
3 结论
本文通过对微藻进行单细胞分选,并测定微藻ZM-4的生长特性、理化性质和不同条件下对养猪废水中污染物的降解能力,得到以下结论:
(1)利用单细胞分选技术对目标藻株进行分离筛选,成功分选的微藻单细胞经过扩大富集培养后,鉴定为DesmodesmusabundansZM-4.实验结果表明了单细胞分选的免标记、非破坏、快速、无需复杂预处理等优点,证明了单细胞分选技术在微藻筛选和鉴定方面的可行性.
(2)微藻ZM-4能够产生108.3 mg/g的油脂、190.7 mg/g的蛋白质和126.3 mg/g的多糖,该藻株更偏向于产蛋白微藻.
(3)通过改变养猪废水浓度、pH、光照时间、光照强度、温度、碳氮比6个环境因子进行单因素实验,综合实验结果得出:微藻ZM-4在养猪废水COD浓度为 800 mg/L,pH=7,光照时长为24 h,光照强度为6 000 lx,环境温度为30℃,碳氮比为8∶1的条件下,对废水中COD和TN,TP的降解能力最优.
