H2O2直接氧化甲苯合成邻/对甲酚
2023-01-16俞新南朱小刚严生虎刘建武
俞新南 ,朱小刚 ,刘 芳 ,张 跃 ,严生虎 ,刘建武
1.南通醋酸化工股份有限公司,江苏 南通 226017;2.常州大学药学院,江苏 常州 213164;3.石油和化工行业连续流技术工程实验室,江苏 常州 213164
邻/对甲酚是重要的精细化学品,在医药、农药和香料等领域应用十分广泛[1]。传统的甲酚生产方法主要有甲苯磺化碱熔法[2]、苯酚烷基化法[3]、异丙基甲苯氧化法[4]、甲苯氯化水解法[5]和甲基苯胺法[6]等,其中甲苯磺化碱熔法是最早用于生产甲酚的方法,技术成熟,工艺简单,但因使用大量强酸强碱,设备腐蚀和环境污染严重,目前已被逐步淘汰。苯酚烷基化法、异丙基甲苯氧化法和甲苯氯化水解法已在国外规模化生产,这3种方法普遍存在工艺过程复杂、污染严重、高温高压以及对设备腐蚀严重等缺点,因此有待开发新的生产工艺。
近年来,利用甲苯和H2O2直接羟基化合成甲酚的研究较多[7-8]。由于芳香族化合物苯环上的C—H键能高,不易直接活化且在苯环上直接引入羟基很困难,同时芳环羟基化和甲苯侧链氧化存在竞争反应,氧化历程和产物分布难以精确控制,因此,高活性/高选择性催化剂是羟基化反应进行的关键。这类催化剂主要有FeO[9-10]、Al2O3-Fe2O3复合金属氧化物[11-12]、硅钼钒和硅钨钒杂多酸盐[13-14]和钛硅分子筛(Ts-1)[15-16]等,最终甲苯转化率约11.7%、苯甲醛选择性约52.2%、甲酚选择性约38.8%,同时还有苯甲醇和其他副产物生成。由此可见,这些催化剂普遍存在原料转化率低、产品选择性低、催化剂制备复杂和反应时间长等问题。过氧化氢法是以甲苯和H2O2为原料,在催化剂作用下直接氧化生成邻/对甲酚,不需要经过磺化、水解、酸化和分离等步骤,因为该工艺不使用强酸强碱,不会产生大量较难处理的废水,且其反应步骤少、绿色无污染、原子利用率高,因而成为甲酚合成研究的主要方向。
笔者在现有制备方法基础上,以过渡金属盐及其氧化物为催化剂,甲苯经H2O2液相氧化直接生成邻/对甲酚,该制备方法具有原子经济性高、工艺简洁和环境友好等特点,为工业上制备酚类化合物提供新的路径。
1 实验
1.1 试剂和仪器
甲苯,分析纯,国药集团化学试剂有限公司;H2O2溶液,工业级,中盐常州化工有限公司;硫酸氧钒、偏钒酸铵,分析纯,上海达瑞精细化学品有限公司;醋酸钴、醋酸铜、乙腈、丙酮,分析纯,上海凌峰试剂有限公司;冰醋酸,化学纯,上海申博化工有限公司;叔丁醇,分析纯,上海展云化工有限公司;环氧酸钴、FeSO4、草酸亚铁、Fe2O3、FeO、CuCl,分析纯,北京百灵威科技有限公司。
Agilent7890B 型气相色谱仪,安捷伦科技有限公司;DF101S 型集热式恒温磁力搅拌器,巩义市予华仪器有限责任公司;RE-3000A 型旋转蒸发仪器,上海亚荣生化仪器厂;DLSB-500 型低温冷却循环泵,南京科尔仪器设备有限公司。
1.2 实验过程
在配有水冷凝装置、温度计和磁力搅拌加热装置的四口烧瓶中,加入一定量甲苯、催化剂和溶剂,加热搅拌,开启冷凝水。升温到一定温度后,量取适量H2O2溶液倒入恒压滴液漏斗中,控制滴加速度,反应结束后,料液用二氯甲烷多次萃取,保留有机相,进行气相色谱定量分析。
1.3 反应机制
甲苯羟基化反应可以发生在芳环上,也可以在侧链上进行,芳环上亲电取代反应产物为邻/间/对甲酚,侧链上自由基反应产物为苯甲醇和苯甲醛[17-20],其反应机制见图1。
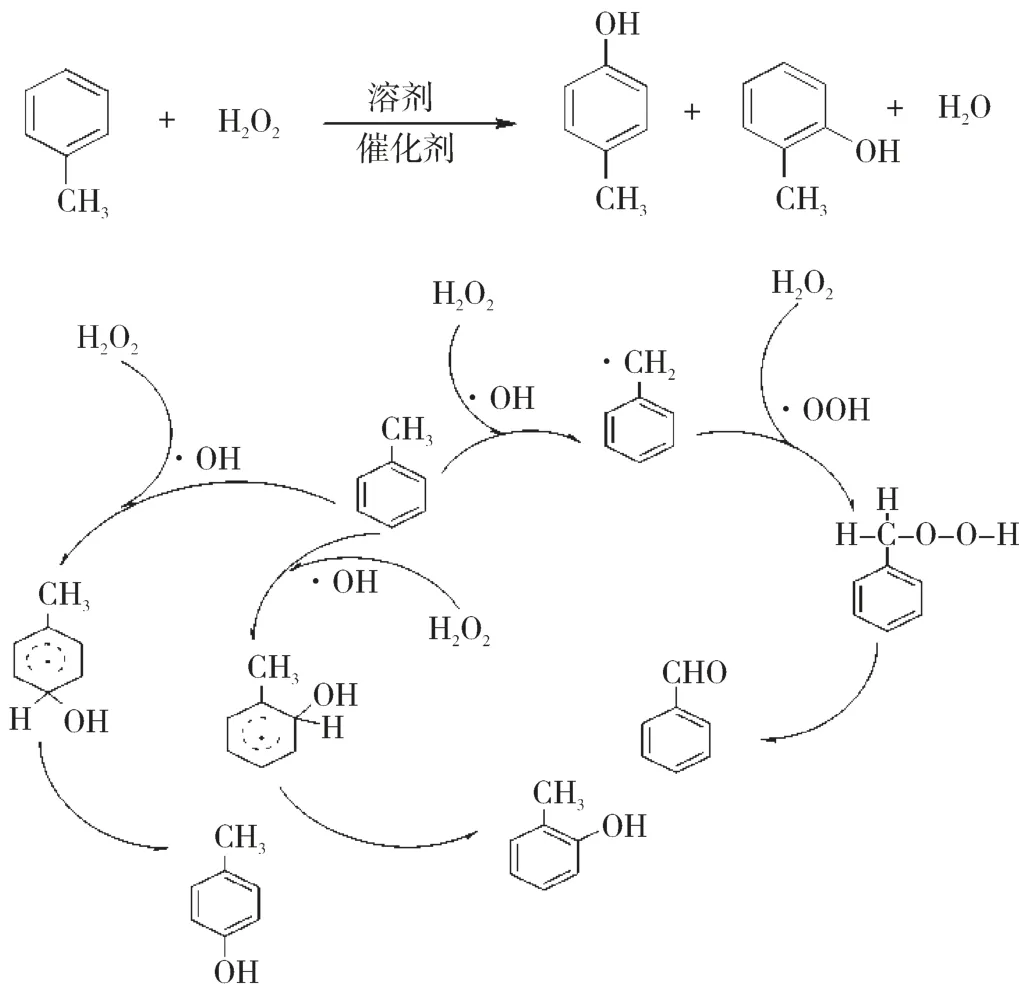
图1 甲苯直接氧化反应机制
氧化过程中过渡金属离子促使H2O2均裂产生·OH,而过渡金属离子在H2O2的作用下被氧化为高价态离子,·OH 进攻甲苯形成酚羟基离子,与体系中的高价态过渡金属离子作用,通过释放一个电子,发生亲电取代形成甲酚。甲苯在过渡金属离子作用下生成苄基自由基,·OH进攻苄基生成不稳定中间态,脱去一分子水,形成副产物苯甲醇和苯甲醛,进一步深度氧化成苯甲酸。
1.4 分析方法
采用Agilent7890B 型气相色谱仪进行定量检测,色谱柱为HP-5(30 m×300 μm×0.25 μm),进样口温度240 ℃,检测器温度250 ℃,程序升温(初温100 ℃,以25 ℃/min升温至250 ℃),进样量1 μL。采用面积归一化法计算分析结果。
1.5 转化率与选择性计算
甲苯转化率与邻甲酚、对甲酚和苯甲醛的选择性计算见式(1)~(4)。

式中:X(甲苯)为甲苯转化率,S(邻甲酚)为邻甲酚选择性,S(对甲酚)为对甲酚选择性,S(苯甲醛)为苯甲醛选择性,n0为加入的甲苯物质的量,n1为所消耗的甲苯物质的量,n2为邻甲酚物质的量,n3为对甲酚物质的量,n4为苯甲醛物质的量。
2 结果与讨论
2.1 结构表征
甲苯羟基化反应亲电取代反应产物为邻/对甲酚,自由基反应产物为苯甲醛。甲苯直接氧化过程产物中邻甲酚、对甲酚和苯甲醛样品的质谱图和1H NMR谱图如图2和3所示。

图2 氧化产物的质谱图
2.2 催化剂种类对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、m(催化剂):m(甲苯)=0.10∶1、乙腈为溶剂、反应温度80 ℃、反应1.0 h 的条件下,考察不同催化剂对氧化反应的影响,结果如表1所示。
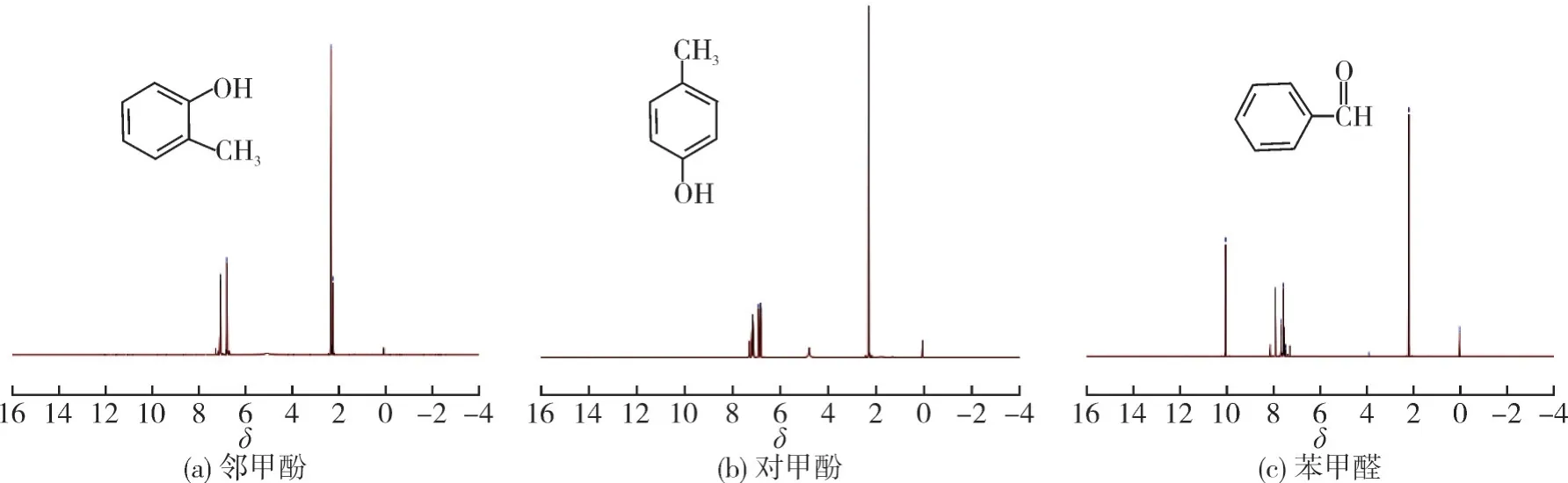
图3 氧化产物的1 H NMR谱图

表1 不同催化剂对氧化反应的影响
由表 1 可知:以 Fe2O3和 FeO 为催化剂时,由于催化剂在溶剂乙腈和原料甲苯中溶解度较小,导致甲苯转化率较低;以Co、V 和Cu 等金属盐为催化剂时,甲酚的选择性小于苯甲醛的选择性;以含Fe 硫酸盐为催化剂时,H2O2溶液容易和Fe2+形成Feton 氧化体系,提高催化氧化能力,苯甲醛的选择性小于甲酚的选择性。实验表明,过渡金属盐对氧化反应有一定的催化活性,芳环上侧链容易发生自由基反应,大部分氧化产物为苯甲醛,当FeSO4为催化剂时,芳香环侧链容易发生亲电取代反应,甲酚的区域选择性较高,酚/醛比高,此时甲苯转化率为12.8%,邻甲酚选择性为25.7%,对甲酚选择性为25.5%。
2.3 催化剂用量对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、FeSO4为催化剂、乙腈为溶剂、反应温度80 ℃、反应1.0 h的条件下,考察催化剂用量对氧化反应的影响,结果如图4所示。
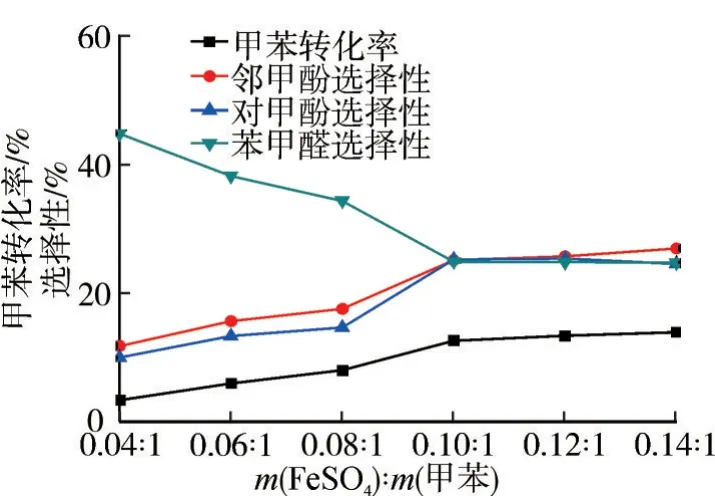
图4 催化剂用量对氧化反应的影响
由图4 可知:催化剂是H2O2直接氧化甲苯制备邻/对甲酚的关键因素。从反应机制可知,由于过渡金属离子促使H2O2释放出·OH,进攻甲苯形成甲基环己二烯自由基,此中间体非常不稳定,在催化剂作用下生成目标产物。催化剂浓度越高,H2O2释放的•OH越多,甲苯转化率就越高;但是过渡金属离子用量过高,会加快H2O2分解速率,导致氧化剂有效含量减少,不利于反应的进行。实验表明,当m(FeSO4)∶m(甲苯)=0.10∶1时,反应效果较好,甲酚的选择性小于苯甲醛的选择性,此时甲苯的转化率为12.6%,邻甲酚选择性为25.1%,对甲酚选择性为25.2%。
2.4 溶剂对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1.0、反应温度80 ℃、反应1.0 h 的条件下,考察不同溶剂对氧化反应的影响,结果如图5所示。

图5 不同溶剂对氧化反应的影响
由图5 可知:溶剂的极性对邻/对甲酚和苯甲醛选择性影响较大。以叔丁醇为溶剂时,苯甲醛的选择性小于邻甲酚的选择性,甲苯转化率低,这是由于叔丁醇-水-甲苯三者沸点相近,形成三元共沸,难以分离;以水为溶剂时,甲苯与水容易形成油水两相,存在传质障碍,原料和溶剂难以充分混合,催化剂分散性较差,致使甲苯转化率较低;以丙酮为溶剂时,邻/对甲酚的选择性均小于苯甲醛的选择性;以乙酸为溶剂时,对甲酚的选择性和苯甲醛的选择性均较低;但以乙腈为溶剂时,邻/对甲酚的选择性较其他溶剂的选择性大,乙腈为非质子极性溶剂,对水相和有机相均有较好的溶解性,反应效率高。当芳环上侧链发生自由基反应,溶剂乙腈能传递自由基,副反应概率增大,苯甲醛含量也增加显著。以乙腈为溶剂时,甲苯转化率为12.8%,邻甲酚选择性为24.8%,对甲酚选择性为25.1%。
2.5 反应温度对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈为溶剂、反应1.0 h 的条件下,考察反应温度对氧化反应的影响,结果如图6 和7所示。

图6 反应温度对氧化反应的影响

图7 H2O2浓度随温度的变化
反应温度是影响氧化反应的重要因素之一,温度升高10 ℃,反应速率加快2~4 倍,即反应温度越高,反应速率越快,转化率越高。由图6 和7 可知:当温度较低时,甲苯转化率低;当温度较高时,反应物得到活化,强化了传质,甲苯的转化率明显提高,邻/对甲酚的选择性也有一定的提高,苯甲醛选择性反而降低;继续升高温度,体系中H2O2分解严重,氧化剂有效浓度大幅度衰减,氧化反应速率减慢,甲苯的转化率和甲酚选择性变化不明显。实验结果表明,当温度为80 ℃时,反应效果较好,此时甲苯转化率为12.6%,邻甲酚选择性为25.6%,对甲酚选择性为25.1%。
2.6 氧化剂用量对氧化反应的影响
在m(FeSO4)∶m(甲苯)=0.10∶1、乙腈为溶剂、反应温度80 ℃、反应1.0 h 的条件下,考察氧化剂用量对氧化反应的影响,结果如图8所示。

图8 氧化剂用量对氧化反应的影响
H2O2直接氧化甲苯制备邻/对甲酚反应,理论上来说,是一个原子利用率100%的反应,即甲苯和H2O2的摩尔比为1∶1,但是H2O2极易分解,实验中H2O2常常需要过量。由图8 可知:增加氧化剂用量,甲苯转化率和邻/对甲酚选择性有所提高,随着反应的进行,生成的苯甲醛、邻/对甲酚活性高于甲苯,再增加氧化剂用量,会促进副反应的产生。实验发现,苯环由于本身活化难度大,甲苯的氧化速率相对较慢,芳环上甲基先活化,生成苯甲醛以及邻/对甲酚。实验结果表明,n(H2O2)∶n(甲苯)=5∶1时,效果最佳,此时甲苯转化率为12.6%、邻甲酚选择性为25.6%,对甲酚选择性为25.1%。
2.7 H2O2质量分数对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈为溶剂、反应温度80 ℃、反应1.0 h 的条件下,考察H2O2质量分数对氧化反应的影响,结果如图9所示。
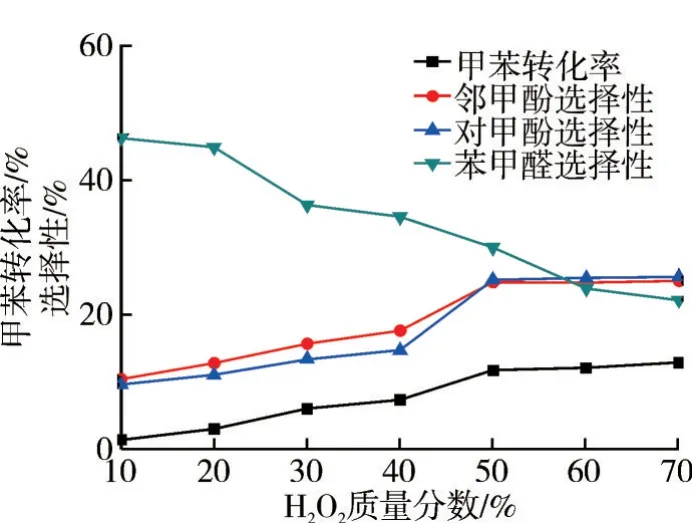
图9 H2O2质量分数对氧化反应的影响
由图9 可知:H2O2质量分数越大,甲苯的转化率越高,邻/对甲酚选择性有明显的提高。若使用低浓度H2O2,那么反应体系中含水量较大,由于甲苯与水不互溶,原料和氧化剂未能充分混合,传质效果较差,导致甲苯转化率低。实验结果表明,高浓度氧化剂有利于氧化反应,但高浓度H2O2存在安全隐患,从安全性和氧化产物分布来看,实验过程中需将H2O2配制成质量分数为50%的溶液,再进行氧化甲苯实验。
2.8 反应时间对氧化反应的影响
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈为溶剂、反应温度80 ℃的条件下,考察反应时间对氧化反应的影响,结果如图10和11所示。
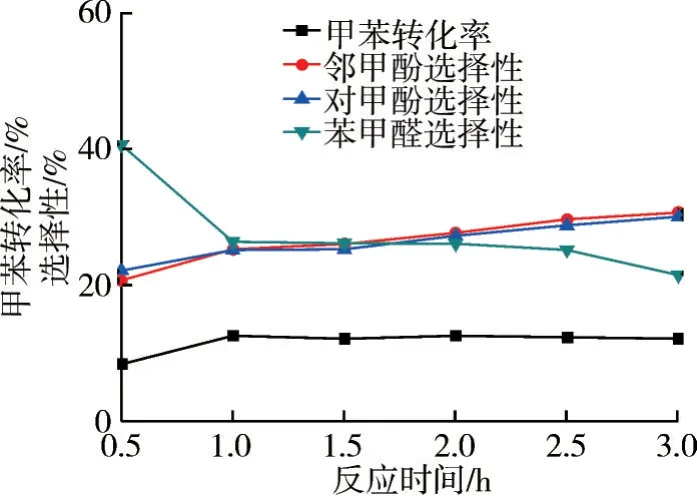
图10 反应时间对氧化反应的影响

图11 H2O2浓度随时间的变化
由图10 和11 可知:反应初期,反应时间对邻/对甲酚选择性的影响较大,H2O2滴加缓慢,会降低体系的温度,且甲苯还处于活化阶段;反应中后期,由于H2O2发生自身分解,此时反应体系中H2O2浓度快速减少,H2O2也因参与反应和分解几乎消耗完全。因此,随着反应时间的延长,甲苯转化率以及甲酚收率趋于稳定。实验结果表明,当反应时间为1.0 h 时,反应效果较好,此时甲苯转化率为12.5%,邻甲酚选择性为25.2%,对甲酚选择性为25.1%。
2.9 实验重复性
在FeSO4为催化剂、乙腈为溶剂、H2O2质量分数50%,n(H2O2)∶n(甲苯)=5∶1、m(催化剂)∶m(甲苯)=0.10∶1、反应温度80 ℃、反应1.0 h 的最优条件下,进行了5 次重复实验,测得甲苯转化率均约为12.6%、邻甲酚选择性均约为25.6%、对甲酚选择性均约为25.1%。
重复实验结果表明,在乙腈溶剂下,FeSO4过滤金属盐催化剂与H2O2形成的氧化体系,对甲苯羟甲基化反应中邻/对甲酚选择性起到很好的调控作用,有效地控制了酚/醛比,催化性能稳定。
3 结论
1)过渡金属盐及其氧化物与H2O2形成的Fe⁃ton氧化体系,对H2O2直接氧化甲苯羟甲基化反应中氧化产物的分布和区域选择起到关键作用。
2)对H2O2液相氧化甲苯羟基化制备邻/对甲酚提供了新的思路,但甲苯羟基化制备邻/对甲酚产物中,侧链氧化产物居多,邻/对甲酚较少,且甲苯转化率较低,苯环羟基化产物邻/对甲酚选择性不高,需进一步提高催化反应活性,增加甲苯转化率,提高H2O2的利用率,优化反应分离耦合工艺。
3)以 FeSO4为催化剂、乙腈为溶剂,在H2O2与甲苯的物质的量之比为5、催化剂与甲苯质量比为0.10、反应温度80 ℃、反应时间1.0 h条件下,甲苯转化率达12.6%,邻甲酚选择性为25.6%,对甲酚选择性为25.1%。
