双镜联合微创技术在胃间质瘤治疗中的效果
2023-01-16孙锴
孙 锴
(佳木斯市中心医院普外二科,黑龙江 佳木斯 154002)
胃间质瘤(gastric stromal tumors,GSTs)是起源于胃壁固有肌层的间叶源性肿瘤,多伴有一定的恶变倾向,其恶性潜能无法预测,多与肿瘤大小、发生部位及核分裂象存在密切相关,其早期治疗尤为重要[1,2]。近年来,手术一直是非转移性GSTs 的标准治疗方案[3]。随着微创技术的不断普及,腹腔镜楔形切除术已成为GSTs 首选治疗方式,相较于传统开腹手术,该术式具有创伤小、恢复快、灵活度高等优势[4]。但GSTs 大多位于肌层,其病灶定位困难,单一腹腔镜通常难以实现肿瘤的精确定位,易影响手术操作,导致切除不完整或胃壁切除过多等情况[5,6]。对此,将内镜技术应用于GSTs 治疗中,可完成肿瘤侵犯深度及范围的准确定位,确保手术操作的精确性,二者联合可有效弥补单一技术的不足,拓展微创技术的应用领域[7]。现本研究结合2020 年1 月-2021 年10 月佳木斯市中心医院收治的40 例GSTs 病例,观察双镜联合微创技术在GSTs 治疗中的临床效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2020 年1 月-2021 年10 月佳木斯市中心医院收治的40 例GSTs 患者作为研究对象,采用随机数字表法分为对照组与观察组,每组20 例。对照组男13 例,女7 例;年龄38~67 岁,平均年龄(53.18±9.09)岁;病变直径1~4 cm,平均病变直径(2.67±0.74)cm;肿瘤位置:胃底6 例、胃体10 例、胃窦3 例、贲门1 例。观察组男12 例,女8 例;年龄38~66 岁,平均年龄(53.24±9.12)岁;病变直径1~4 cm,平均病变直径(2.73±0.80)cm;肿瘤位置:胃底7 例、胃体10 例、胃窦2 例、贲门1 例。两组性别、年龄、肿瘤直径、肿瘤位置比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者均知情且自愿参加,并签署知情同意书。
1.2 纳入和排除标准 纳入标准:①经CT、超声内镜检查及术后病理检查确诊为GSTs;②单发病症,病变直径<5 cm;③无脏器转移;④无手术禁忌;⑤无腹部手术史者。排除标准:①肿瘤破溃、出血、坏死者;②合并胃癌等恶性肿瘤者;③合并严重脏器衰竭疾病者;④腐蚀性炎症及食管、胃病变急性炎症者。
1.3 方法
1.3.1 对照组 行腹腔镜手术治疗:患者取头低脚高仰卧位,两腿分开,气管插管麻醉后,于脐孔建立气腹(压力12~15 mmHg),采用5 孔法治疗:①于脐部做观察孔(1 个);②主操作孔(1 个):左锁骨中线脐2 cm 位置,置入Trocar(12 mm);③辅助操作孔(3个):分别于左、右锁骨中线肋缘下及右锁骨中线脐上2 cm 处,置入Trocar(5 mm),结合术前检查资料,完成病灶初步定位,游离瘤体附近网膜及粘连组织,楔形完整切除瘤体,最后缝合切割处。
1.3.2 观察组 行双镜联合微创治疗:患者取头低脚高仰卧位,两腿分开,气管插管麻醉后,于脐孔建立气腹(压力12~15 mmHg),5 孔法进镜后(方案同上),采用胃镜辅助确定病变位置,若瘤体位于胃体前壁,通过腔镜行楔形切除,若瘤体靠近胃-食管交界处、幽门及贲门处,需先行内镜黏膜下剥离术,将病变部位分离至黏膜下层,并于胃镜定位下,切除3/4 肌层及浆膜层,最后通过腹腔镜完成剩余病症的切除,随后缝合。
1.4 观察指标 比较两组围术期指标(手术时间、术中出血量、切除成功率、中转开腹率)、术后恢复情况(术后排气时间、术后下床时间、术后住院时间)、凝血功能[凝血酶原时间(PT)、活化部分凝血酶原时间(aPTT)、纤维蛋白原(Fbg)]、手术并发症(消化道穿孔、消化道出血、胃酸反流、贲门狭窄)。切除成功标准[8]:病变组织与肿瘤全面切除,切缘阴性,无病变转移迹象。
1.5 统计学方法 采用SPSS 21.0 软件进行数据处理,计量资料以(±s)表示,组间采用t检验;计数资料以[n(%)]表示,组间采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组围术期指标比较 观察组手术时间短于对照组,术中出血量少于对照组,且中转开腹率小于对照组(P<0.05);两组切除成功率比较,差异无统计学意义(P>0.05),见表1。
表1 两组围术期指标比较[±s,n(%)]

表1 两组围术期指标比较[±s,n(%)]
2.2 两组术后恢复情况比较 观察组术后排气时间、术后下床时间、术后住院时间短于对照组(P<0.05),表2。
表2 两组术后恢复情况比较(±s)

表2 两组术后恢复情况比较(±s)
2.3 两组凝血功能比较 两组术后PT、aPTT 低于术前,Fbg 高于术前,但观察组PT、aPTT 高于对照组,Fbg 低于对照组(P<0.05),见表3。
表3 两组凝血功能比较(±s)
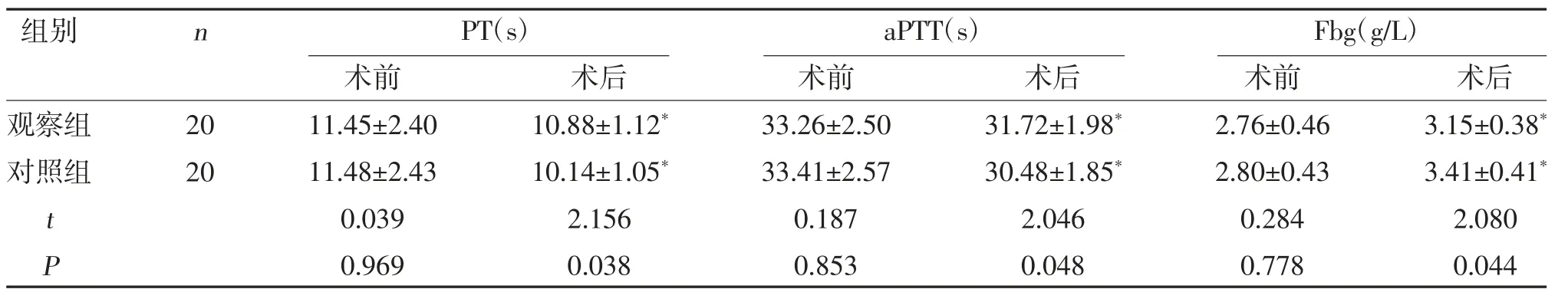
表3 两组凝血功能比较(±s)
注:与同组术前比较,*P<0.05
2.4 两组手术并发症发生情况比较 观察组手术并发症发生率低于对照组(P<0.05),见表4。

表4 两组手术并发症发生情况比较[n(%)]
3 讨论
GSTs 属于临床常见的潜在恶性肿瘤,多起源于间充质Cajal 细胞或其前体,既可向外形成浆膜下肿块,又可向内发展为息肉样肿块,易导致出血、糜烂等并发症,且伴有一定的非定向分化及潜在恶性特征,及早完整切除肿瘤是改善患者预后生存的重要方式[9,10]。研究指出[11],GSTs 多为单发,且淋巴结转移风险普遍较低,因此该病通常无需淋巴结清扫,这为腹腔镜等微创方案提供了广阔应用空间。目前,腹腔镜楔形切除术已成为GSTs 标准治疗术式之一,该术式可满足GSTs 的治疗原则,其有效率与开腹手术相当,且具有显著微创优势,有利于患者术后恢复[12,13]。但腹腔镜技术对体积较小及腔内型肿瘤定位困难,需内镜技术进行辅助,方可实现切缘的准确定位[14,15]。在此背景下,双镜联合方案可有效弥补单一微创技术的局限性,充分发挥二者优势,通过内镜与腹腔镜的双重定位,确保GSTs 的完整切除,同时最大限度保留胃壁的正常组织,进一步提高手术的有效与安全性[16-18]。
本研究结果显示,观察组手术时间短于对照组,术中出血量少于对照组,且中转开腹率小于对照组(P<0.05),提示双镜联合方案可缩短患者的手术时间,减少其术中出血,同时降低中转开腹风险,与王金申等[19]研究一致。分析认为,内镜联合腹腔镜可准确定位肿瘤的侵犯深度与范围,有利于手术切缘的快速判断,提高操作精确度的同时,缩短了手术时间,且大大避免了胃壁的过多切除,减少了术中出血,降低了肿瘤破裂风险,因而中转开腹率相对较低[20,21]。同时,观察组术后排气时间、术后下床时间及术后住院时间均短于对照组(P<0.05),表明双镜联合方案可缩短患者的术后恢复时间,这与其准确性高、创伤小、出血少等原因存在直接关联,与张震等[22]研究相吻合。
围术期凝血功能是外科手术患者的重点监测项目之一,其中PT、aPTT 指标的缩短通常预示着血栓事件风险的增加,而Fbg 作为一种凝血因子,其指标升高亦代表凝血状态的增强[23]。本研究中两组术后组PT、aPTT 水平下降、Fbg 升高,但观察组PT、aPTT高于对照组,Fbg 低于对照组(P<0.05),提示双镜联合方案可减小患者的凝血功能变化,降低其术后血栓形成风险。分析原因,二氧化碳气腹可引起血管内膜撕裂、血流减缓,是导致术后高凝状态的重要危险因素,而双镜方案可缩短患者的手术时间,大大降低了气腹对机体凝血功能的影响,血栓形成风险明显更低[24]。此外,观察组手术并发症发生率低于对照组(P<0.05)。究其原因,腹腔镜对胃-食管交界处、幽门及贲门等部位肿瘤的切除操作相对困难,盲目切除易导致管腔狭窄、出血等并发症,而双镜可清晰识别肿瘤组织部位及层次,同时判定其浸润深度,有利于正常胃壁组织的最大化保留,对胃功能具有较好保护作用,避免了创面过大引起的并发症情况。
综上所述,双镜联合微创技术在GSTs 治疗中具有手术时间短、术中出血少、术后恢复快,且血栓形成风险低、手术并发症少等优势,值得临床应用。
