奶牛趾间皮肤外植体模型的构建及效果评价
2023-01-15张鹤飞周志新杨春雪郑家三
张鹤飞 周志新 孙 悦 杨春雪 郑家三
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319)
奶牛肢蹄病是指由环境、管理、营养以及生理等多种不良饲养因素引起奶牛四肢及蹄部发生病变的总称,其中蹄病约占90%以上[1]。近年来的调查结果显示,我国各省份、地区奶牛肢蹄病的发病率可达14.6%~37.6%[2],每年因肢蹄病被迫淘汰的奶牛占总数的20%[3],给奶牛养殖业的健康发展带来重大的负担。根据表现形式奶牛蹄病可分为感染性和非感染性两类,常见的感染性蹄病主要包括由严格厌氧细菌、兼性厌氧细菌和需氧细菌感染引起的腐蹄病、蹄跟糜烂、蹄趾皮炎和趾间皮炎等[4]。当前对奶牛非感染性蹄病的临床研究已有较为详细的报道,而对感染性蹄病的研究报道相对较少。以往对奶牛蹄部感染性疾病的研究多采用活体试验[5-6],不仅给研究带来诸多不便,而且违背动物福利原则,因此寻找一种可替代的离体试验模型具有重要意义。
皮肤外植体模型是以活体动物取下的皮肤组织(器官)为体外培养对象,构建具有三维结构的模型。作为体外研究的重要工具,皮肤外植体模型发展至今已有数十年历史[7],在此期间经过不断的优化和改进,已成为当前替代动物试验的热点模型之一[8],在皮肤体外研究领域中更是被视为金标准[9]。此类模型在保持皮肤相对完整性的同时,可进一步观察皮肤组织细胞间在正常联系和排列情况下的活性特征[10],并通过免疫组化技术对细胞凋亡情况加以检测。
迄今为止,国内外已报道多种动物皮肤外植体模型及构建方法,在细菌感染引起的皮肤病研究中发挥了重要的作用[11-14],然而当前尚未有奶牛蹄部皮肤相关模型被报道。本研究拟构建奶牛趾间皮肤外植体模型,并通过病理组织学检查和免疫组化方法对建模效果进行评估,以期补充奶牛趾间皮肤外植体模型研究的空缺,为奶牛蹄部感染性疾病的发病机制研究提供方法学基础。
1 材料与方法
1.1 主要试剂和仪器
本研究所用健康牛蹄采集于当地屠宰场;DMEM/F-12 1∶1培养基、DMEM高糖培养基购于Giebco公司;青霉素-链霉素-两性霉素B溶液(100×)、TUNEL细胞凋亡检测试剂盒(显色法)购于碧云天生物技术有限公司;苏木素伊红(HE)染色试剂盒、硫酸庆大霉素溶液、L-谷氨酰胺溶液购于北京索莱宝科技有限公司;免疫组化染色试剂盒、兔抗牛Caspase-3多克隆抗体购于北京博奥森生物技术公司;8 mm皮肤活检打孔器购于Biopuunch公司。
1.2 试验方法
1.2.1培养基配制
运输培养基:每100 mL运输培养基中,青霉素-链霉素-两性霉素B溶液(100×) 1 mL、L-谷氨酰胺溶液1 mL、5 μg/mL硫酸庆大霉素9 μL,余量为DMEM/F12 1∶1培养基。
洗涤培养基:每100 mL洗涤培养基中,青霉素-链霉素-两性霉素B溶液(100×) 1 mL、2 μg/mL硫酸庆大霉素4 μL,余量为DMEM/F-12 1∶1培养基。
组织培养基:每100 mL洗涤培养基中,青霉素-链霉素-两性霉素B溶液(100×) 1 mL、L-谷氨酰胺溶液1 mL、5 μg/mL硫酸庆大霉素10 μL,胎牛血清10 mL,余量为以3∶1比例混合的DMEM高糖与DMEM/F12培养基。
1.2.2样本采集
将刚屠宰的牛蹄用清水反复冲洗表面及趾间至无污物附着,75%乙醇和2%葡萄糖盐酸氯己定皮肤消毒剂反复清洗消毒,随后用无菌手术刀和剪刀去除趾间皮肤毛发。更换新的无菌手术刀切除全部趾间皮肤,PBS反复冲洗后立即浸入运输培养基中,冰上运输回实验室。
1.2.3皮肤外植体模型的构建
使用无菌手术刀和剪刀去除趾间皮肤多余的皮下脂肪,8 mm皮肤活检打孔器无菌收集皮肤外植体,并浸入预热至37 ℃的洗涤培养基中,室温下洗涤3次,15 min/次。
将洗涤后的皮肤外植体固定在细胞培养小室的内室中(图1),从外室中加入2 mL组织培养基,并向内室中添加组织培养基至外植体的表皮与真皮交界处,形成气相与液相交替的培养体系[15]。将外植体模型置于37 ℃、5% CO2湿化培养箱中培养,每12 h换液1次,分别于培养0、12、24、36、48和72 h收集2块皮肤外植体固定于4%多聚甲醛中,以0 h皮肤外植体为对照组,其余培养时期组织为试验组。

图1 奶牛趾间皮肤外植体模型组装图Fig.1 Assembly diagram of cow interdigital skin explant model
1.2.4病理组织切片制备及Caspase-3蛋白测定
采用动物组织石蜡切片的绿色环保制作技术[16]进行病理组织切片和苏木素伊红染色,观察皮肤外植体的病理变化;运用免疫组织化学的方法检测皮肤外植体中Caspase-3蛋白的阳性程度及表达情况。
免疫组织化学方法主要步骤如下:将石蜡切片先后置于松节油和梯度酒精(100%、95%、90%、80%和70%)中脱蜡、脱水,随后流水及PBS冲洗,吸水纸擦干。胰酶法修复抗原,PBS冲洗。滴加3% H2O2消化内源性过氧化物酶,PBS冲洗。用非免疫性动物血清封闭后弃血清,滴加一抗(Caspase-3),滴度为1∶300,4 ℃冰箱过夜。次日PBS冲洗后滴加链霉素抗生物素-过氧化物酶溶液孵育,PBS冲洗后滴加DAB显色液,显微镜下控制显色情况。滴加苏木素复染细胞核,流水冲洗,烤干后封片观察。
1.2.5细胞凋亡检测
TUNEL细胞凋亡检测方法主要步骤如下:石蜡切片脱蜡、脱水步骤同免疫组织化学方法。向组织切片滴加不含DNase的蛋白酶K孵育,PBS冲洗。滴加3% H2O2消化内源性过氧化物酶,PBS冲洗。滴加生物素标记液避光孵育,PBS冲洗。滴加标记反应终止液室温孵育,PBS冲洗。滴加Streptavidin-HRP工作液室温孵育,PBS冲洗。滴加DAB显色液,显微镜下控制显色情况。滴加苏木素复染细胞核,流水冲洗,随后烤干,封片观察。
1.2.6细胞计数与统计分析
选取不同培养时期皮肤组织切片高倍视野各3张,使用Fiji/ImageJ-win 64软件对视野下的阳性细胞和总细胞进行计数,并根据阳性率=阳性细胞数/细胞总数×100%公式计算阳性率。应用GraphPad Prism 8系统软件对试验结果进行单因素方差分析(One-way ANOVA),P<0.05为差异显著,具有统计学意义。
2 结果与分析
2.1 皮肤外植体病理学变化
HE染色结果如图2所示,对照组0 h皮肤组织的表皮完整,各层结构清晰可见;真皮层的结缔组织排列规则;肌层的肌纤维紧密排列,毛囊、皮脂腺及汗腺等散在分布,真皮层中可见少量的淋巴细胞(图2(a))。与之相比试验组各培养时期皮肤组织的表皮层均发生不同程度角化过度,真皮层胶原纤维紊乱并伴有不同程度中性粒细胞浸润等病理变化,除72 h皮肤组织表现为中度炎症反应外,其余均表现为轻度炎症反应。12和24 h皮肤组织的表皮结构完整,真皮层胶原纤维排列紧密,无明显病理变化(图2(b)和(c));36 h皮肤组织角质层呈网篮状,偶见上皮细胞变性(图2(d));48 h皮肤组织可观察到大量上皮细胞变性及少量上皮细胞坏死,同时伴随细胞核固缩(图2(e));72 h皮肤组织可见表皮脱落、缺失,毛囊、皮脂腺等皮肤附属器官发生程度不同的坏死(图2(f))。HE染色结果表明,皮肤外植体在培养24 h组织结构完整,并未出现明显病理变化;培养36 h出现细胞凋亡早期的变性迹象,提示此时已不适用于体外研究。

(a)~(f)依次为0、12、24、36、48及72 h皮肤外植体。(a)-(f) are skin explants at 0 h, 12 h, 24 h, 36 h, 48 h and 72 h, respectively.蓝色箭头:真皮层淋巴细胞浸润;黑色箭头:表皮层角化过度;红色箭头:毛囊、汗腺、皮脂腺坏死;绿色箭头:细胞变性、坏死,细胞核固缩。Blue arrow: lymphocyte infiltration in the dermis; Black arrow: hyperkeratosis of the epidermis; Red arrow: hair follicle, sweat gland, sebaceous gland necrosis; Green arrows: cell degeneration, necrosis, nuclear pyknosis.
2.2 皮肤外植体TUNEL细胞凋亡检测
TUNEL染色结果如图3所示,对照组0 h皮肤外植体可见少量细胞发生凋亡;试验组12、24、36、48和72 h的皮肤外植体表皮和真皮中凋亡细胞呈明显阳性表达,根据分布情况可知,表皮中凋亡细胞数量高于真皮,组间细胞凋亡率差异显著(P<0.05);与对照组相比,试验组12 h皮肤外植体细胞凋亡率差异不显著(P>0.05)(图4);24、36、48和72 h皮肤外植体细胞凋亡率差异显著(P<0.05)(图4)。TUNEL染色结果表明,体外培养72 h内的皮肤外植体凋亡细胞数量从1.72%上升至58.02%,其活性与离体培养时间呈正相关增长。
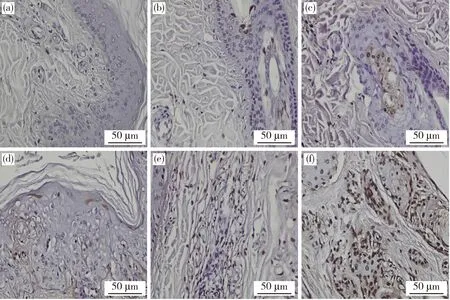
(a)~(f)依次为0、12、24、36、48 及72 h皮肤外植体。棕色为TUNEL显色下的凋亡细胞,蓝色为苏木素染色下的细胞核。(a)-(f) are skin explants at 0 h, 12 h, 24 h, 36 h, 48 h and 72 h, respectively. Brown is TUNEL stained apoptotic cell, and blue is HE matoxylin stained nucleus.
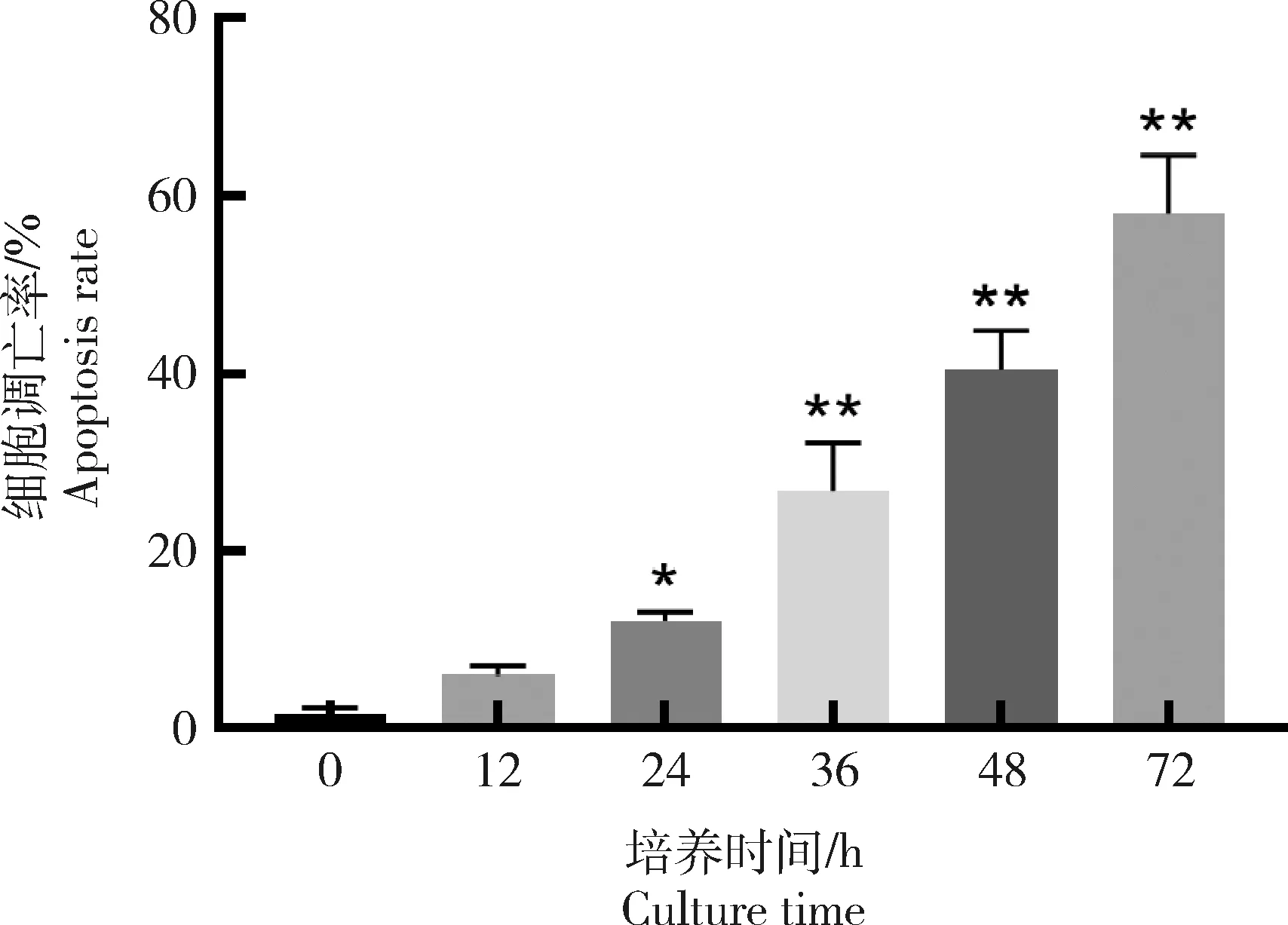
*表示与对照组相比,各试验组细胞凋亡率差异显著(P<0.05),**表示差异极显著(P<0.01)。* indicates that compared with the control group, the apoptosis rate of experimental groups was significantly different (P<0.05), ** indicates extremely significant difference (P<0.01).
2.3 皮肤外植体Caspase-3凋亡蛋白表达分析
免疫组化结果如图5所示,对照组0 h皮肤外植体中可见轻微的Caspase-3蛋白阳性表达;试验组12、24、36、48和72 h皮肤外植体表皮及真皮中Caspase-3蛋白明显阳性表达,根据分布情况可知,表皮中Caspase-3蛋白阳性表达情况高于真皮,组间阳性表达率差异显著(P<0.05);与对照组相比,试验组12和24 h皮肤外植体中Caspase-3蛋白的阳性率差异不显著(P>0.05)(图6),无统计学意义;试验组36、48和72 h皮肤外植体中Caspase-3蛋白的阳性率差异显著(P<0.05)(图6),具有统计学意义。免疫组化结果表明,体外培养72 h内皮肤外植体凋亡细胞数量从0.86%上升至46.96%,与TUNEL染色结果相比二者间存在一定差异,Caspase-3蛋白阳性率要低于细胞凋亡率。

(a)~(f)依次为0、12、24、36、48及72 h皮肤外植体。(a)-(f) are skin explants at 0 h, 12 h, 24 h, 36 h, 48 h and 72 h, respectively.黄色为DAB显色下Caspase-3蛋白阳性表达细胞。Yellow cells with positive expression of Caspase-3 protein by DAB staining.

*表示与对照组相比,各试验组Caspase-3蛋白阳性率差异显著(P<0.05),**表示差异极显著(P<0.01)。* indicated that compared with the control group, the positive rate of caspase-3 protein in experimental groups was significantly different (P<0.05), ** indicated extremely significant difference (P<0.01).
3 讨 论
3.1 皮肤外植体模型效果评价
本研究通过采集屠宰场淘汰奶牛的趾间皮肤进行体外培养,在已有皮肤器官培养模型[17-18]的基础上构建外植体模型。以真实的离体皮肤组织作为研究对象,不仅符合动物实验3R(Replacement, Reduction, Refinement)原则[9],同时与奶牛活体试验高昂的研究费用相比,还大幅缩减了研究成本,提高了研究的便利性,本方案无论在经济成本还是动物福利方面均具有较大优势。
HE染色表明,体外培养36 h皮肤外植体出现上皮细胞变性的迹象,而变性的细胞会发生形态学改变并伴有结构和功能的变化,通常表现为细胞功能下降,甚至发展为坏死。发生变性、坏死的细胞对试验结果会产生一定影响,故此时的皮肤外植体已不适用于体外研究;免疫组化结果显示,72 h皮肤外植体Caspase-3蛋白阳性表达和细胞凋亡情况均保持在50%左右,活性良好,但与对照组相比,在36 h已出现显著性差异(P<0.01);体外培养24 h皮肤外植体表皮结构完整,真皮层胶原纤维排列紧密,未见明显病理变化;且Caspase-3蛋白阳性表达与细胞凋亡情况均保持在10%左右,细胞凋亡情况较弱,可用于体外研究,模型构建成功。
3.2 皮肤外植体活性影响因素
营养物质和氧气是组织细胞生长所必需的,而离体的皮肤组织缺乏供应养分的血液系统,仅能靠吸收培养基中的养分维持生长[19]。本研究将DMEM/F12 1∶1培养基与DMEM高糖培养基以一定比例混合以提高培养基中营养成分的含量,在保证营养物质丰富的基础上同时还增加了营养成分的浓度,可满足皮肤组织生长所需的营养需求;在获取氧气方面,将皮肤组织培养于细胞培养小室中形成气液交界面培养体系,使更加充足的氧气可以渗透到组织内部细胞。结果表明,体外培养12和24 h皮肤外植体结构完整、无明显病理变化,在保持组织结构和功能完整的同时,Caspase-3蛋白阳性表达和细胞凋亡情况均维持在较低的范围内,仍可保持较高的活性,说明本方案可满足皮肤组织生长的营养需求,效果良好。
皮肤外植体直径大小和厚度是影响其活性的另一重要因素,李新华等[19]曾在早期报道中提出皮肤组织的直径和厚度应在保持组织形态学特征的基础上尽可能小,以避免组织中心细胞发生坏死。本研究通过查阅相关文献将皮肤组织大小设定为 8 mm,结果表明在离体培养48 h皮肤外植体仅出现少量细胞坏死的现象,故推测其厚度和直径在短期培养中对细胞坏死影响不大,将在接下来的研究中进一步验证厚度和直径对细胞坏死的影响。
3.3 细胞凋亡影响因素
末端脱氧核苷酸转移酶(TdT)介导dUTP缺口末端标记(TUNEL)法是通过识别发生断裂DNA末端游离的3′-OH检测细胞凋亡的免疫组化技术,因其操作简单、应用范围广泛及检测结果灵敏等特点已成为实验室、动物模型和临床研究中检测细胞凋亡的首选方法[20]。然而一些学者的研究表明TUNEL对于凋亡细胞的检测并非是特异性的,因为它会将发生变性坏死、进行DNA修复、受到外力导致破坏甚至进行基因转录激活等细胞游离的3′-OH标记上,从而导致检测结果的假阳性[21-22]。为保证试验结果的准确性,本研究随机检测了皮肤外植体中凋亡相关蛋白Caspase-3的表达情况对TUNEL染色结果加以验证。Caspase-3蛋白是Caspase家族是介导细胞凋亡过程中的主要凋亡相关效应因子,扮演着主要执行者的身份[23-24],对于大量蛋白质的分裂以及凋亡过程中与凋亡相关的染色质凝集、DNA片段化及细胞和细胞核固缩都是必需的[25]。结果表明,上述两种方法检测的细胞凋亡情况的确存在一定差异,并且从36 h皮肤外植体出现变性的细胞开始,两者之间的差异逐渐加大,进一步证实了TUNEL法在检测凋亡细胞中的非特异性。
4 结 论
1) 体外培养24 h皮肤外植体在保持组织结构和功能完整的基础上,Caspase-3蛋白阳性表达和细胞凋亡情况可维持在较低的范围内(10%左右),皮肤外植体活性较高,成功构建了一种奶牛趾间皮肤外植体模型。
2) 皮肤外植体Caspase-3蛋白和细胞凋亡情况均呈阳性表达,且随体外培养时间增长成正相关性,即离体培养时间是影响模型活性的重要因素。
