八味沉香散含药血清对H9c2细胞氧糖剥夺损伤的保护机制研究 Δ
2023-01-14宫佰会岳栋芳李彩霞官敏李永芳青海大学医学院西宁810001
宫佰会,岳栋芳,李彩霞,官敏,李永芳 (青海大学医学院,西宁 810001)
心肌缺血是心血管系统的常见病,严重威胁人类生命健康,临床迫切需要安全有效的药物防治心肌缺血。八味沉香散是中国传统藏药复方之一,其源于藏族医药经典著作《四部医典》。该复方由沉香200 g、肉豆蔻100 g、广枣100 g、石灰华100 g、乳香100 g、木香100 g、诃子(煨)100 g、木棉花100 g组成,气芳香,味咸、涩、微苦,具有清心热、养心、安神、开窍之功效,主要用于热病攻心、神昏谵语,临床上主要用于治疗冠心病、心绞痛等[1]。作者课题组前期研究发现,八味沉香散能够降低由于冠状动脉结扎引起的心肌缺血再灌注损伤和氧化应激反应[2—4]。不同方式的八味沉香散提取液对异丙肾上腺素、垂体后叶素导致的大鼠心肌收缩功能和舒张功能的下降[4—6]、心电图 J点位移的程度[2,7]等均有显著的改善作用,可抑制氧化应激反应并促进抗凋亡基因的表达等[8]。血清药物化学研究发现,给予八味沉香散后大鼠血清中共鉴定出16种非挥发性成分、24种挥发性成分,其中30种为原型化合物的入血成分[9]。本实验采用血清药理学方法,进一步研究在氧糖剥夺损伤细胞模型中,八味沉香散含药血清改善心肌缺血损伤的可能机制,以期为八味沉香散的临床应用提供实验依据,促进其现代化研究。
1 材料
1.1 细胞与动物
本研究所用细胞为大鼠H9c2细胞(货号CL-0089),购自武汉普诺塞生命科技有限公司。SPF级雄性SD大鼠50只,体质量200~220 g,购自西安交通大学[实验动物使用许可证号:SYXK(青)2020-0001],饲养于青海大学医学院药学系实验中心(正常光照、自由饮食)。本实验所有操作均符合实验动物伦理学要求,并通过青海大学动物伦理委员会批准(伦理号2021-01)。
1.2 主要仪器
本研究所用主要仪器有SW-CJ-1F型超净工作台(苏州安泰空气技术有限公司),51119770DP型酶标仪、Pico21型台式高速低温冷冻离心机(美国Thermo Fisher Scientific公司),DMi8型荧光显微镜、DMi1型倒置显微镜(德国Leica公司),Amersham Imager 600型显影仪(美国通用电气公司),CytoFLEX S型流式细胞仪(美国Beckman Coulter公司)。
1.3 主要药品与试剂
本研究所用主要药品为八味沉香散,购自西藏神猴药业有限责任公司(批号20210601),由西藏神猴药业有限责任公司进行分析与鉴定,符合2020年版《中国药典》(一部)中的要求。用蒸馏水将八味沉香散配制成0.5、0.7、0.8 g/mL的混悬液,备用。
本研究所用主要试剂为胎牛血清(上海依科赛生物制品有限公司,批号FSP500),DMEM无糖培养基、DMEM培养基(武汉普诺赛生命科技有限公司,批号分别为WH0521A291、WH0021D231),RIPA裂解液、青霉素链霉素混合液、磷酸盐缓冲液(PBS)(北京索莱宝科技有限公司,批号分别为R0010、P1400、20201219),乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(南京建成生物工程研究所,批号20201225),肌酸激酶(creatine kinase,CK)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二 醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒和线粒体呼吸链复合酶Ⅰ(respiratory chain complexⅠ,ComplexⅠ)试剂盒(上海科兴商贸有限公司,批号分别为 F3651-A、F3262-A、F8503-A、F8502-A、F3642-A、F40416-A),BCA蛋白定量试剂盒、Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒(JC-1)(上海碧云天生物技术有限公司,批号分别为P0009、C1062L、C2003S),2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)活性氧(reactive oxygen species,ROS)荧光探针(德国Sigma公司,批号4091990),兔源凋亡蛋白B细胞淋巴瘤2(B-cell lymphomaz,Bcl-2)相关X蛋白(Bcl-2-associated X protein,Bax)、胱天蛋白酶3(Caspase-3)、细胞色素C(cytochrome C,Cytc)抗体(美国CST公司,批号分别为2772T、14220T、11940S),兔源核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体、Kelch样ECH关联蛋白1(Kelch ECH association protein 1,Keap1)抗体、血红素加氧酶1(heme oxygenase 1,HO-1)抗体、硫氧还蛋白(thioredoxin,Trx)抗体、抗凋亡蛋白Bcl-2抗体(美国Abcam公司,批号分别为ab92946、ab139729、ab68477、ab109385、ab196495),NADH 氧化还 原酶辅酶 10(NADH oxidoreductase coenzyme 10,Ndufa10)抗体(美国Thermo Fisher Scientific公司,批号336BEA22),内参兔源β-肌动蛋白(β-actin)抗体(美国Proteintech公司,批号236601-1-AP),辣根过氧化物酶标记的兔抗IgG二抗、SuperECL Plus超敏发光液、CCK-8试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为E-AB-1004、E-IR-R308、E-CK-A362)。
2 方法
2.1 八味沉香散含药血清的制备
将50只大鼠随机分为空白血清组(20只)和八味沉香散低、中、高剂量组(每组10只),适应性饲养1周。根据药品说明书剂量和动物体表面积剂量换算公式换算,八味沉香散灌胃剂量为:低剂量2.5 g/kg,中剂量8 g/kg,高剂量12 g/kg(以每日人用剂量进行换算作为低剂量,以该剂量约3倍、5倍作为中、高剂量),空白血清组大鼠灌胃等量生理盐水,每日3次,共10 d。在末次给药30 min后腹主动脉取血,于4 ℃冰箱中静置2 h,以3 000 r/min离心15 min,吸取血清,0.45 μm过滤器过滤、分装、封口、标记日期和编号,-80 ℃冰箱中保存备用。
2.2 细胞培养
取H9c2细胞株,观察细胞形态是否异常,若无异常,于常氧培养箱(37 ℃、5% CO2)中适应环境,弃上清,PBS洗3遍,消化细胞,培养基终止消化并吹打均匀,更换新的培养皿继续培养。细胞融合度达80%左右开始实验。
2.3 细胞分组、造模与给药
待H9c2细胞生长至对数生长期时消化、计数并进行培养,置于常氧培养箱(37 ℃、5% CO2)培养24 h。将细胞分为空白组、模型组和八味沉香散低、中、高剂量组(含药血清剂量依次为2.5、8、12 g/kg,剂量依据同“2.1”项下)。空白组和模型组细胞培养液中加入20%的空白血清,八味沉香散低、中、高剂量组细胞培养液中加入20%相应剂量的八味沉香散含药血清。空白组置于常氧培养箱(37 ℃、5% CO2)培养。模型组和八味沉香散低、中、高剂量组置于三气培养箱(2%O2)培养,待培养箱内气体浓度达到缺氧条件时开始计时,缺氧时间为8 h(此时若LDH释放量与空白组比较有显著性差异表示氧糖剥夺损伤模型建立成功)[10]。
2.4 细胞存活率检测
采用CCK-8法检测。H9c2细胞接种于96孔板中,按“2.3”项下方法分组与给药。缺氧结束后,各组细胞加入CCK-8溶液(总体积的10%)并孵育(37 ℃)1 h,用酶标仪检测450 nm 波长处吸光度(A)值,按试剂盒说明书方法计算细胞存活率(n=6)。
2.5 细胞生化指标检测
按“2.3”项下方法对H9c2细胞分组与给药,缺氧结束后,每孔吸出细胞上清液作为待测样品(n=6)。按LDH、CK、CAT、MDA、SOD、GSH-Px和ComplexⅠ试剂盒要求加入相应试剂检测其A值,再根据相应的标准曲线计算对应生化指标的水平。
2.6 细胞形态观察
选取八味沉香散中剂量(最佳药物浓度血清,下同)作为药物组浓度[11],按“2.3”项下所述方法对H9c2细胞处理后,于倒置显微镜下观察细胞状态(如细胞壁结构、死亡细胞数量)并拍照。
2.7 细胞内ROS检测
选取八味沉香散中剂量作为药物组浓度,按“2.3”项下方法对H9c2细胞分组与给药(n=3)。按照 DCFHDA ROS试剂盒说明书方法进行染色,荧光显微镜下观察并通过流式细胞仪检测:收集各组细胞并用PBS洗涤2次,结合缓冲液重悬后,加入DCFH-DA探针和适量ROS供氢体,37 ℃孵育30 min后,分别用荧光显微镜和流式细胞术进行观察和检测H9c2心肌细胞氧糖剥夺损伤后的ROS含量(绿色荧光强度越大,表示ROS含量越高)。
2.8 细胞线粒体膜电位检测
选取八味沉香散中剂量作为药物组浓度,按“2.3”项下方法对H9c2细胞分组与给药(n=3)。按照JC-1试剂盒说明书方法进行染色,荧光显微镜下观察并通过流式细胞仪检测各组细胞线粒体膜电位:收集各组细胞并用PBS洗涤2次,结合缓冲液重悬后,加入JC-1工作液,37 ℃孵育20 min后,分别用流式细胞仪和荧光显微镜检测H9c2细胞氧糖剥夺损伤后线粒体膜电位情况(红色荧光代表完整细胞膜,绿色荧光代表细胞膜破损)。
2.9 细胞凋亡检测
选取八味沉香散中剂量作为药物组浓度,按“2.3”项下方法对H9c2细胞分组与给药(n=3)。按照 AnnexinⅤ-FITC /PI 试剂盒说明书方法进行染色,荧光显微镜下观察并通过流式细胞仪检测各组凋亡率:收集各组细胞并用PBS洗涤2次,结合缓冲液重悬后,加入Annexin Ⅴ-FITC、碘化丙啶染色,37 ℃孵育20 min后,分别用流式细胞仪和荧光显微镜检测细胞凋亡率(绿色荧光代表细胞早期凋亡,红色荧光代表细胞晚期凋亡)。
2.10 细胞氧化应激和凋亡相关蛋白的检测
选取八味沉香散中剂量作为药物组浓度,按“2.3”项下方法对H9c2细胞分组与给药(n=3)。提取各组细胞总蛋白,用BCA试剂盒进行定量。各组蛋白上样量10 μL,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转移至PVDF膜上,用5%脱脂牛奶室温封闭,然后加入一抗(Keap1、Nrf2、Ndufa10、HO-1、Trx、Bcl-2、Cytc、Bax、β-actin和Caspase-3,稀释度均为1∶1 000)4 ℃孵育过夜,PBS洗涤3次,加入辣根过氧化物酶标记的IgG二抗(稀释度为1∶2 000)室温孵育1 h,PBS洗涤3次,暗室中曝光显影、定影,用Image J软件检测各组蛋白条带灰度值,以目的蛋白条带与内参蛋白条带的灰度值比值表示目的蛋白的表达水平。
2.11 统计学处理
采用GraphPad 9.0软件进行数据分析,计量资料满足正态分布以±s表示,多组间比较采用单因素方差分析,进一步两两比较使用LSD-t检验。检验水准α=0.05。
3 结果
3.1 含药血清对氧糖剥夺损伤模型细胞存活率的影响
与空白组(100%)比较,模型组细胞存活率[(80.85±4.73)%]显著降低(P<0.01);与模型组比较,八味沉香散低、中、高剂量组细胞存活率[依次为(93.08±2.34)%、(106.02±6.22)%、(89.20±8.01)%]均显著升高(P<0.01,n=6)。
3.2 含药血清对氧糖剥夺损伤模型细胞生化指标的影响
与空白组比较,模型组细胞上清液中LDH、CK、MDA水平均显著升高,CAT、GSH-Px、SOD、ComplexⅠ水平均显著降低(P<0.01);与模型组比较,八味沉香散低、中、高剂量组细胞上清液中LDH、CK、MDA水平均显著降低(P<0.01),CAT(低剂量组除外)、GSH-Px(低、高剂量组除外)、SOD、ComplexⅠ(低剂量组除外)水平均显著升高(P<0.01)。结果见表1。
表1 各组细胞上清液中生化指标比较(±s,n=6)
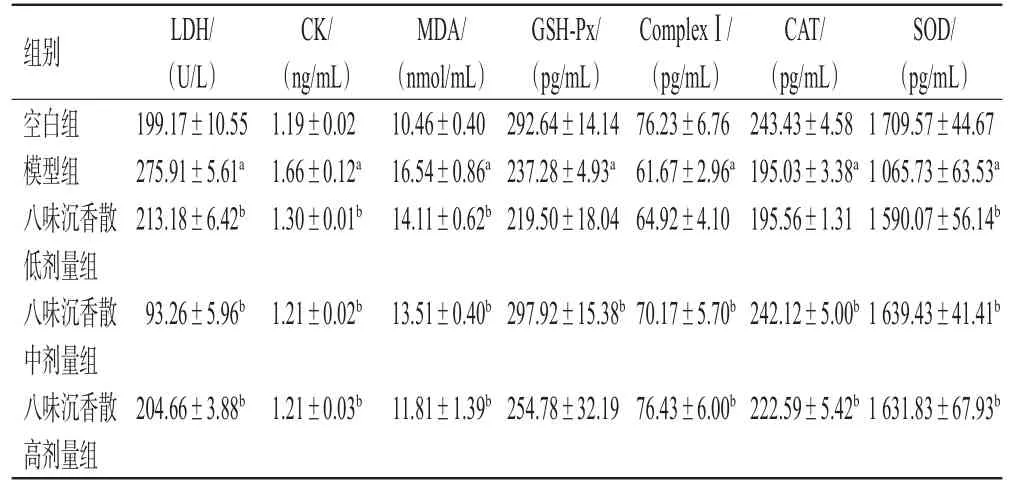
表1 各组细胞上清液中生化指标比较(±s,n=6)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01
组别空白组模型组八味沉香散低剂量组八味沉香散中剂量组八味沉香散高剂量组LDH/(U/L)199.17±10.55 275.91±5.61a 213.18±6.42b CK/(ng/mL)1.19±0.02 1.66±0.12a 1.30±0.01b MDA/(nmol/mL)10.46±0.40 16.54±0.86a 14.11±0.62b GSH-Px/(pg/mL)292.64±14.14 237.28±4.93a 219.50±18.04 ComplexⅠ/(pg/mL)76.23±6.76 61.67±2.96a 64.92±4.10 CAT/(pg/mL)243.43±4.58 195.03±3.38a 195.56±1.31 SOD/(pg/mL)1 709.57±44.67 1 065.73±63.53a 1 590.07±56.14b 93.26±5.96b 1.21±0.02b 13.51±0.40b 297.92±15.38b 70.17±5.70b 242.12±5.00b 1 639.43±41.41b 204.66±3.88b 1.21±0.03b 11.81±1.39b 254.78±32.1976.43±6.00b 222.59±5.42b 1 631.83±67.93b
3.3 含药血清对氧糖剥夺损伤模型细胞形态的影响
显微镜观察结果显示,空白组细胞的细胞壁结构完整、边缘清晰,死细胞数量较少;模型组细胞的细胞质内颗粒物增多,大多数心肌细胞形状变得短粗,细胞壁破损明显、结构不完整,死细胞数量显著增加,损伤加重。八味沉香散中剂量组细胞的细胞壁结构完整、边缘清晰,形状较少改变,死细胞数量较少。结果见图1。

图1 各组H9c2细胞形态的显微图
3.4 含药血清对氧糖剥夺损伤模型细胞内ROS的影响
与空白组[(33.80±2.82)%]比较,模型组细胞内ROS含量[(68.63±8.66)%]显著升高;与模型组比较,八味沉香散中剂量组细胞内ROS含量[(35.40±11.44)%]显著降低(P<0.01)。结果见图2、图3。
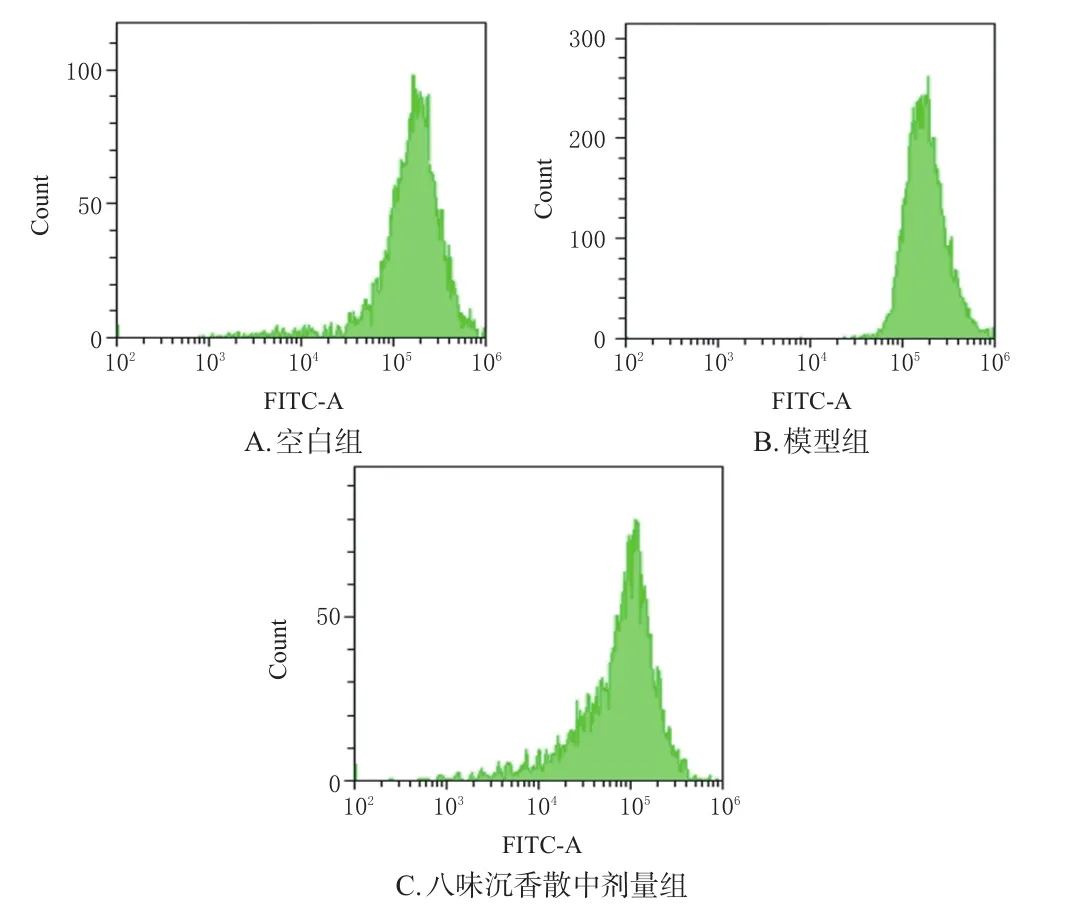
图2 各组细胞内ROS流式图
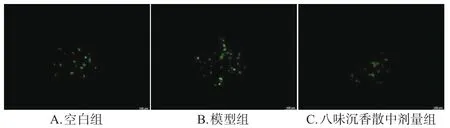
图3 各组细胞内ROS荧光显微图(×40)
3.5 含药血清对氧糖剥夺损伤模型细胞线粒体膜电位的影响
与空白组[(85.02±0.72)%]比较,模型组细胞线粒体膜电位[(74.70±1.43)%]显著降低;与模型组比较,八味沉香散中剂量组细胞线粒体膜电位[(87.36±0.59)%]显著升高(P<0.01)。结果见图4、图5。
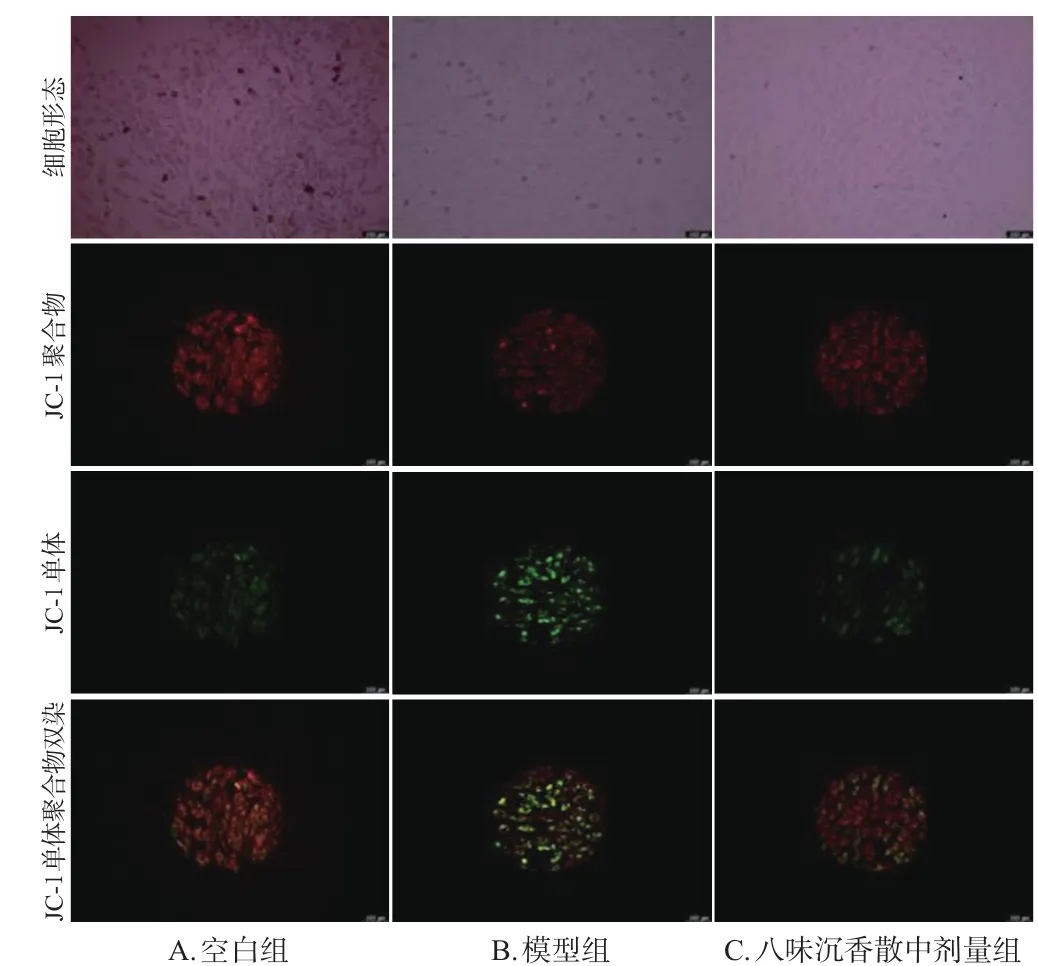
图4 各组细胞线粒体膜电位荧光显微图(×40)

图5 各组细胞线粒体膜电位流式图
3.6 含药血清对氧糖剥夺损伤模型细胞凋亡的影响
与空白组[(17.50±2.35)%]比较,模型组细胞凋亡率[(44.52±3.75)%]显著升高;与模型组比较,八味沉香散中剂量组细胞凋亡率[(32.50±5.09)%]显著降低(P<0.01)。结果见图6、图7。
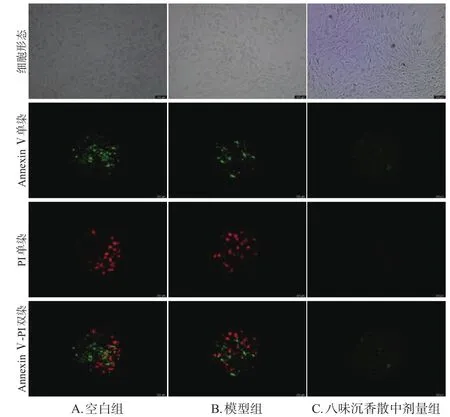
图6 各组细胞凋亡荧光显微图(×40)

图7 各组细胞凋亡流式图
3.7 含药血清对氧糖剥夺损伤模型细胞氧化应激相关蛋白表达的影响
与空白组比较,模型组细胞中Keap1、Nrf2、Ndufa10、HO-1和Trx的蛋白表达水平均显著升高;与模型组比较,八味沉香散中剂量组细胞中Keap1、Nrf2、HO-1、Trx的蛋白表达水平均显著降低(P<0.05)。结果见表2、图8。
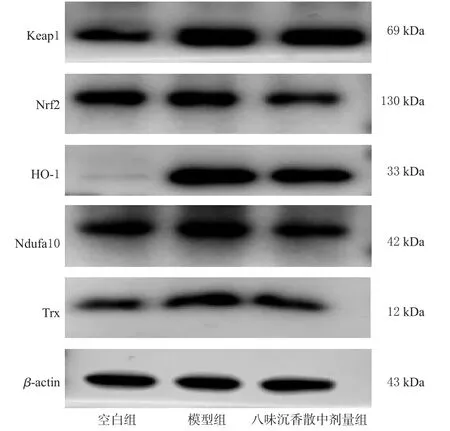
图8 各组细胞中氧化应激相关蛋白表达的电泳图
表2 各组细胞氧化应激相关蛋白表达水平的检测结果(±s,n=3)
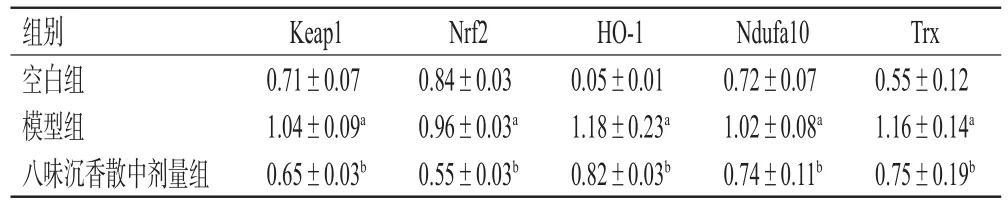
表2 各组细胞氧化应激相关蛋白表达水平的检测结果(±s,n=3)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05
组别空白组模型组八味沉香散中剂量组Trx 0.55±0.12 1.16±0.14a 0.75±0.19b Keap1 0.71±0.07 1.04±0.09a 0.65±0.03b Nrf2 0.84±0.03 0.96±0.03a 0.55±0.03b HO-1 0.05±0.01 1.18±0.23a 0.82±0.03b Ndufa10 0.72±0.07 1.02±0.08a 0.74±0.11b
3.8 含药血清对氧糖剥夺损伤模型细胞凋亡相关蛋白表达的影响
与空白组比较,模型组细胞中促凋亡蛋白Cytc、Bax和Caspase-3的表达水平显著升高,抗凋亡蛋白Bcl-2表达水平显著降低(P<0.05)。与模型组比较,八味沉香散中剂量组细胞中Cytc、Bax和Caspase-3蛋白表达水平均显著降低,Bcl-2蛋白表达水平显著升高(P<0.05)。结果见表3、图9。

图9 各组细胞中凋亡相关蛋白表达的电泳图
表3 各组细胞中凋亡相关蛋白表达水平的检测结果(±s,n=3)
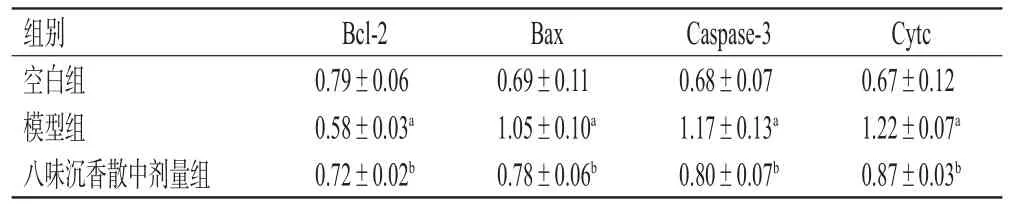
表3 各组细胞中凋亡相关蛋白表达水平的检测结果(±s,n=3)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05
组别空白组模型组八味沉香散中剂量组Bcl-2 0.79±0.06 0.58±0.03a 0.72±0.02b Bax 0.69±0.11 1.05±0.10a 0.78±0.06b Caspase-3 0.68±0.07 1.17±0.13a 0.80±0.07b Cytc 0.67±0.12 1.22±0.07a 0.87±0.03b
4 讨论
心肌缺血发病机制复杂,氧化应激和细胞凋亡是心肌缺血病理生理学中密切相关的两部分,自由基损伤和氧化应激是缺血再灌注损伤的关键环节并参与了损伤级联反应的每个步骤[12]。抑制细胞凋亡是心肌缺血治疗中的保护策略之一[13]。H9c2细胞被广泛用于心血管系统疾病药物作用的研究。氧糖剥夺损伤模型能最大程度模拟心肌缺血病理生理情况下的细胞状态,是心肌缺血研究的经典细胞模型。基于此,本文建立H9c2细胞的氧糖剥夺损伤模型,探讨八味沉香散含药血清对心肌缺血的保护机制。
“血清药理学”通过灌胃等方式让动物服药并在一段时间后采集血液、分离血清,将血清作为药源进行观察。该方法在给药后,使药物在体内产生药物效应,其原有成分可以在体内转化为活性成分或代谢后失活,或没有被体内吸收,或通过第二信使而间接起作用[14]。这是目前研究复方中药、民族药体外药理学常用的方法之一,且在一定程度上能反映出药物的有效作用和分子机制。因此本研究采用血清药理学方法探讨药物在细胞层面的抗氧化应激、抗凋亡机制。
本课题组前期通过超高效液相色谱-四极杆/静电场轨道阱高分辨质谱和气相色谱-质谱联用技术,对八味沉香散灌胃大鼠后的血清进行鉴定,入血成分中有7种成分具有抗氧化作用,其中秦皮乙素能有效清除自由基[15],绿原酸能够螯合金属离子和清除自由基[16],没食子酸甲酯和没食子酸乙酯均具有抗氧化损伤活性[17—18],山柰酚具有较强的抗氧化活性[19],槲皮素对因氧化应激导致的疾病有很好的预防和治疗作用[20],甲基丁香酚可抑制缺氧/复氧损伤后人肾小管上皮细胞内ROS的释放[21]。由此推测这些化合物可能是八味沉香散通过抗氧化应激作用发挥保护心肌细胞作用的有效成分。
相关文献研究表明,八味沉香散含药血清在不影响细胞存活率的前提下可提高氧糖剥夺损伤的H9c2细胞存活率,这可能与其降低细胞氧化损伤和抑制细胞凋亡相关。当细胞受到缺氧损伤时,细胞膜受损,导致细胞质内的LDH和CK释放,因此LDH和CK的释放量与细胞受损程度相关,可作为药物细胞毒性评价指标。本实验结果显示,H9c2细胞氧糖剥夺损伤后,给予八味沉香散含药血清可抑制LDH和CK的释放,保护细胞膜完整性。氧化应激是心肌细胞缺血损伤的主要病理机制之一。心肌缺血后持续的氧化应激导致细胞代谢副产物——ROS堆积,而此时在正常生理状态下机体维持氧化-抗氧化系统平衡的内源性抗氧化剂SOD和GSH等不足以清除ROS[22]。这种失衡导致细胞中调控ROS的相应蛋白、相关氧清除剂和ROS相关因子发生了改变,进而氧化细胞大分子如蛋白质和脂质等,加剧机体损伤。由此本研究进行了氧化应激相关指标的检测,结果显示,氧糖剥夺损伤后,ROS大量生成,抗氧化物质CAT、ComplexⅠ、SOD、GSH-Px等被大量消耗,持续生成的ROS自由基作用于脂质发生过氧化反应生成MDA,加剧细胞膜损伤,调控氧化应激的相关蛋白(Keap1、Nrf2、Ndufa10、HO-1和Trx)表达升高;而给予八味沉香散含药血清可降低细胞内ROS含量,提高以ROS为底物的抗氧化物质CAT、ComplexⅠ、SOD、GSH-Px水平,降低脂质过氧化产物MDA水平,降低氧化应激相关蛋白(Keap1、Nrf2、Ndufa10、HO-1、Trx)表达,初步验证了八味沉香散含药血清降低细胞氧化损伤的作用。
ROS簇的形成和积累没有得到有效清除并攻击线粒体造成线粒体渗透性转换孔开放,致使线粒体膜电位下降,并促使细胞色素C和凋亡诱导因子等凋亡蛋白释放到细胞质中,进而导致内源性细胞凋亡[23];而显微镜下可观察到细胞形态学表现为死细胞数量变多,细胞皱缩变圆,细胞壁边界不显著等[24]。因此本研究进一步对细胞凋亡指标进行检测,结果显示,给予八味沉香散含药血清后能够提高氧糖剥夺损伤的H9c2细胞的线粒体膜电位,并改善细胞壁边界形态和减少死细胞数量,同时减少Annexin Ⅴ-FITC/PI双染细胞凋亡的数量,升高抗凋亡蛋白Bcl-2的表达,降低促凋亡蛋白Bax、Cytc、Caspase-3的表达,提示八味沉香散含药血清具有良好的抗凋亡作用,进一步表明八味沉香散含药血清对H9c2细胞氧糖剥夺损伤具有保护作用。
综上所述,八味沉香散对H9c2细胞氧糖剥夺损伤具有保护作用,这一作用是通过平衡氧化应激反应、抑制凋亡的产生而实现的。本实验仍存在不足之处,如缺乏对药物量效关系的探究。在后续实验中,本课题组将结合经典动物模型对八味沉香散量效关系进行探索,进一步探讨八味沉香散对心肌缺血的保护作用。
