太子参连作根际土壤中3株真菌的分离鉴定及其生物学特性研究
2023-01-14周丹朱梅韦雪娇胡华林程搏幸
周丹,朱梅,韦雪娇,胡华林,程搏幸*
太子参连作根际土壤中3株真菌的分离鉴定及其生物学特性研究
周丹1,朱梅1,韦雪娇1,胡华林2,程搏幸1*
1. 贵州师范学院生物科学院, 贵州 贵阳 550018 2.贵州医科大学省部共建药物植物功效与利用国家重点实验室/贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550014
本文对太子参连作根际土壤分离培养的3株真菌进行分子生物学鉴定,并从温度、pH、碳源及光照等方面对其生物学特性影响进行了研究。结果表明,通过对菌株形态进行观察和结合系统发育树进行分析,初步判断菌株A为卵形球托霉(,菌株F为赭绿青霉(),菌株L为尖孢镰刀菌()。菌株A在以D-果糖为碳源、温度30 ℃、pH 11、连续黑暗培养条件下生长良好。菌株F在以糊精为碳源、温度25 ℃、pH值5和6、12 h光暗交替培养条件下生长良好。菌株L以α-乳糖为碳源,温度条件为25 ℃,碱性条件下,连续黑暗或12 h光暗培养条件下,生长较好。
太子参; 土壤微生物; 生物学特性
太子参()为石竹科植物,其异叶伪繁缕的块根为主要经济部位,被国家卫生部登记“可用于保健食品的中药材名录”[1]。至被贵州省列为重点中药材特色产业以来,种植面积迅速增加,持续位居全国第一[2]。太子参产业快速发展的同时,由于土地资源有限,连作成为太子参种植的主要方式,使得太子参种植过程中真菌病害频发,从而导致其连作障碍加剧,严重的影响了太子参的产量和品质[3]。连作导致作物土壤真菌增加,其指示真菌已经成为目前的研究热点[4,5]。高慧芳等[6]已从不同的太子参连作样地根际土壤中检测出优势属中两种常见真菌为致病菌,Chen J等[7]和Wu L等[8]已经证实真菌中的镰刀菌是引起太子参连作效应的一类高致病菌。而目前太子参连作过程的真菌研究多以叶片病原真菌、土壤微生物多样性研究为主[6,9],对其根际土壤真菌生物学特性的报道不够全面。根际真菌在作物生长过程中受温度、pH、碳源等因素的影响,明确其生物学特性可为防治病害奠定基础。鉴于根际土壤中病原真菌对太子参产业潜在的威胁,本研究从施秉县桐木榜村太子参连作三年根际土壤中,对已筛选获得的3株真菌进行分离鉴定和明确其种属类型后,对其生物学特性研究,探究温度、pH值、光照以及培养基碳源对其生长的影响,以期了解3株真菌的生长规律,为今后进一步探究太子参连作根际土壤中病原真菌或拮抗真菌在连作过程中对太子参的致病特性或拮抗特性的研究奠定基础,也为深入开展太子参连作过程病原真菌的防治提供一定的理论依据。
1 材料与方法
1.1 样本采集
2020年6月从贵州省施秉县桐木榜村太子参基地采集连作三年根际土,带回实验室进行分离培养。
1.2 真菌的分离纯化
将根际土壤用无菌水制备为土壤悬液后,移取0.5 mL接种到马铃薯葡萄糖琼脂(PDA)培养基上,25 ℃培养24 h。观察并记录菌株的菌落形态、颜色等,并对其进行分离纯化后,将菌株保存于试管斜面,4 ℃下保存[10]。
1.3 真菌的鉴定
1.3.1 形态学观察本实验共筛选出40余株真菌纯菌株。经多次纯化后,将其中3株形态特征较为稳定的菌株分别接种到PDA平板上,25 ℃恒温培养箱中培养5 d,观察并拍照记录菌落颜色、菌丝特征、菌落形态特征及生长情况。
1.3.2 分子生物学鉴定将纯化的3株真菌分别接种于液体培养基中,置于温度为25 ℃,转速120 r/min的摇床内培养3 d。将菌丝球按照真菌基因组DNA提取试剂盒(生工生物工程(上海)股份有限公司)说明书提取病原菌基因组DNA。使用PCR扩增试剂盒、引物ITS1(5-TCCGTAGGTGAACCTGCGG- 3)和ITS4ITS4(5-TCCTCCGCTTATTGATATGC-3)(上海生工公司合成)对所提取的菌株DNA进行扩增。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,30个循环;扩增后的PCR产物进行1.0%琼脂电泳后,送至上海生物工程有限公司进行测序。将所得的核苷酸序列提交至blastGenBank中的序列进行同源比较,以FASTA格式下载后,用MEGA7.0软件比较测序结果的同源性,用邻接法构建系统发育树。
1.4 生物学特性
1.4.1 不同温度对菌丝生长的影响取置于25 ℃恒温培养箱中培养5 d,菌丝生长良好的菌落平板,沿菌落边缘用打孔器取直径为5 mm的菌饼,分别在4、10、15、20、25、30、35、40 ℃八个不同温度的培养箱中培养[11],用十字交叉法测量并记录其5 d的菌落直径。每个处理重复5次。
1.4.2 不同pH值对菌丝生长的影响将培养基的pH值设置为5.0、6.0、7.0、8.0、9.0、10.0、11.0七个梯度,用1 mol/L盐酸和氢氧化钠将PDA培养基调到不同pH值。使用直径为5 mm的打孔器,沿置于25 ℃恒温培养箱中培养5 d的菌落平板边缘打取菌饼,接种于不同pH值的PDA培养基上,置于25 ℃恒温培养箱中培养5 d养[12],测量及培养方法同1.3.1,每个处理重复5次。
1.4.3 不同碳源对菌丝生长的影响本实验以麦芽糖、D-果糖、α-乳糖、糊精、蔗糖、葡萄糖和可溶性淀粉为供试碳源,按比例配制不同碳源类型培养基[13]。取于25 ℃恒温培养5 d的菌落平板,沿菌落边缘用打孔器取直径为5 mm的菌饼,接种到不同碳源培养基上,培养及测量方法同1.3.1,每个处理重复5次。
1.4.4 不同光照对菌丝生长的影响用打孔器沿菌落边缘取出直径为5 mm的菌饼,接种至PDA培养基平板中,培养及测量方法同1.3.1,每个处理重复5次。在全光、12 h光暗交替和黑暗条件下培养5 d[11,14,15]。
2 结果与分析
2.1 形态学观察
2.1.1 形态学观察如图1所示,3株菌株在PDA培养基上培养7 d的情况。菌株A菌落正面为白色,背面略呈放射轮纹状。中间菌丝浓密,边缘质地薄且呈半透明状;菌落近圆形,气生菌丝半透明,绒毛状平铺,透明圆形孢子囊。菌株F菌落正面为绿松石色,边缘为白色,菌落表面呈粉末状,以同心径向环的形式向外延伸,具横隔,气生菌丝松絮状。在PDA培养基上,菌株L的菌落呈圆形、隆起、絮状,菌丝为淡粉色或淡紫色,小型分生孢子无色,卵圆形。
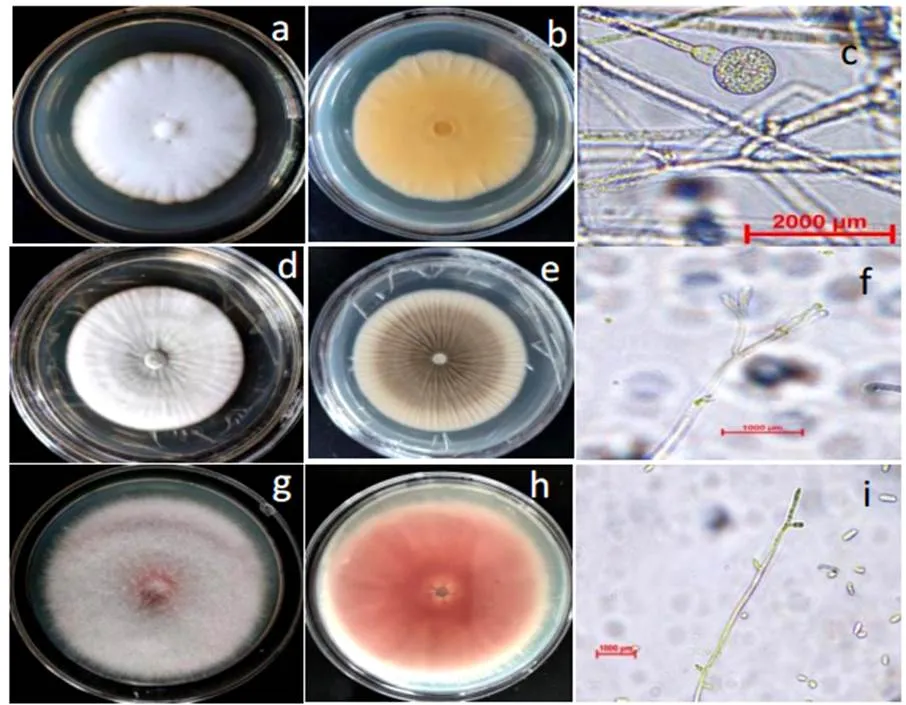
图 1 菌株A, F, L在PDA培养基上的形态特征和显微特征
注:a, b-菌落A形态;c-菌落A显微形态;d, e-菌落F形态;f-菌落F显微形态;g, h-菌落L形态; i-菌落L显微形态。
Note: a,b-Morphological characteristics of A;c-Microscopiccharacteristics of A;d,e-Morphological characteristics of F; f-Microscopiccharacteristics of F; g, h-Morphological characteristics of L; i-Microscopiccharacteristics of L.
2.2 分子生物学鉴定
对菌株A、F、L的ITS片段进行特异性扩增并测序,得到的序列于BLAST中,选取同源性较高的序列,用MEGA7构建系统发育树(图2)。结果表明,菌株A与卵形球托霉()同源高,菌株F与赭色青霉()同源性高,菌株L与尖孢镰刀菌()基因同源性高,结合形态特征初步判断三种菌株分别为卵形球托霉()、赭绿青霉()、尖孢镰刀菌()。

图 2 基于ITS基因序列片段构建的菌株A,F,L系统发育树
2.3 生物学特性
2.3.1 不同温度对菌丝生长的影响不同温度条件下培养5 d后,3株菌株的生长速度如图3(<0.05),不同温度条件下3株菌株生长量都存在显著差异。温度在15 ℃以下、35 ℃以上菌丝均难以生长,菌株A的最佳生长温度为25~35 ℃,平均菌落直径为35.9~47.8 mm,平均生长速度为7.18~9.56 mm/d,菌株F和菌株L的最佳生长温度为20~30 ℃,菌株F的平均菌落直径为30.2~44.8 mm,平均生长速度为6.04~8.96 mm/d,菌株L的平均菌落直径为29.3~39.6 mm,平均生长速度为5.86~7.92 mm/d。在15~35 ℃范围内,3株菌株菌丝生长均呈现由弱到强、再由强到弱的趋势。
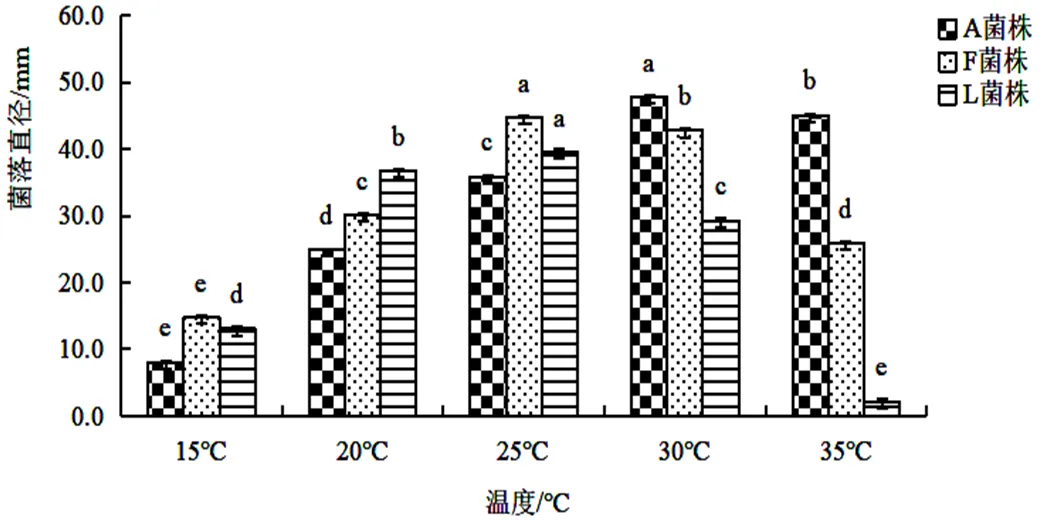
图 3 不同温度对菌株A, F,L菌丝生长的影响
2.3.2 不同pH对菌丝生长的影响3株菌株在不同pH条件下的菌落直径如图4(<0.05),在pH5~11的范围内3株菌株均能生长。pH10和11的情况下,菌株A的菌落直径略大于其他pH值的培养基。不同pH条件下菌株F生长具有显著差异,且在碱性条件下生长较好。菌株L在碱性条件下平均生长速率明显大于酸性与中性培养基,由此可知,菌株A和菌株L适于在碱条件下生长,菌株F适于在弱酸性和中性环境中生长。
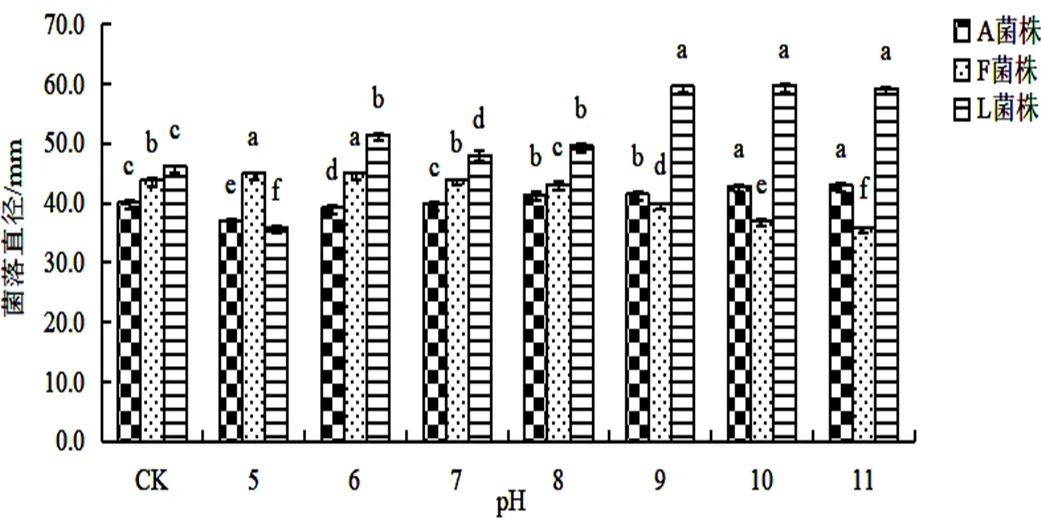
图 4 不同pH值对菌株A,F,L菌丝生长的影响
2.3.3 不同碳源对菌丝生长的影响培养5 d后,不同碳源条件下菌株A、F、L菌落生长直径如图5(<0.05)。根据实验结果显示,3株菌株在供试的七种碳源培养基菌落均生长良好。菌株A在不同碳源上的生长速率D-果糖>可溶性淀粉>糊精>麦芽糖>葡萄糖>蔗糖>α-乳糖,其中D-果糖上菌落平均生长速率为9.4 mm/d,而α-乳糖上平均生长速度为6.42 mm/d。菌株F在以糊精为碳源上平均生长速度为8.36 mm/d,在可溶性淀粉上平均生长速度为7.86 mm/d。菌株L在不同碳源条件下菌落直径差异显著,在不同碳源上的生长速率α-乳糖>可溶性淀粉>糊精>麦芽糖>葡萄糖>D-果糖>蔗糖,在α-乳糖平均生长速率达13.1 mm/d,而在蔗糖上的生长速率仅为6.76 mm/d。
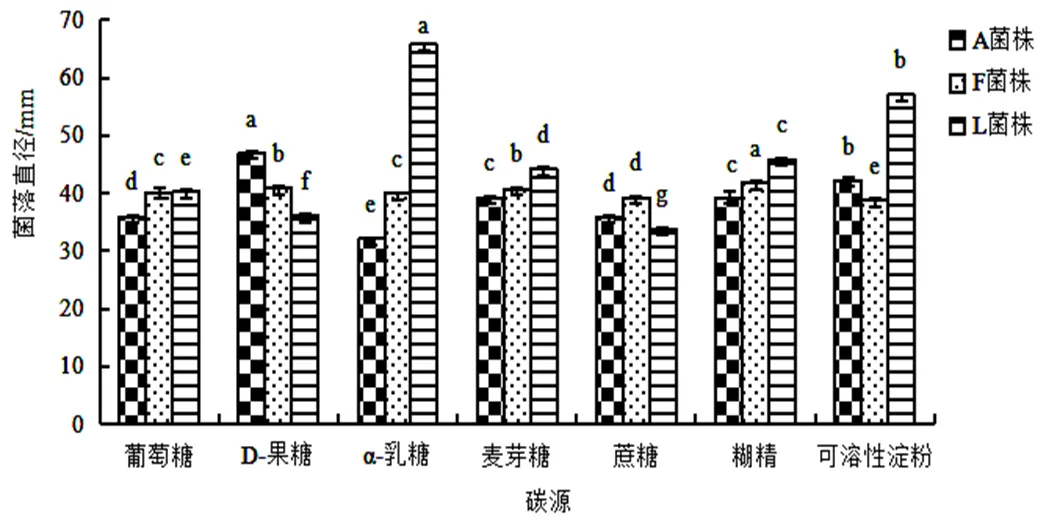
图 5 不同碳源对菌株A,F,L菌丝生长的影响
2.3.3 不同光照对菌丝生长的影响不同光照条件下培养5 d后株菌A、F、L菌落生长情况如图6(<0.05)。从图中可以看出,不同光照条件对菌株A、F、L菌落生长影响程度不同,但均能生长良好。菌株A与菌株F菌落直径生长差异明显,菌株A的生长速率在连续黑暗>12 h光暗交替>连续光照。菌株F在12 h光暗交替条件下菌丝生长速度最快。菌株L对光的敏感程度低于菌株A与菌株F,在12 h光暗交替和连续黑暗条件下菌生长量无显著差异,且生长速率大于连续光照条件下菌生长速率。

图 6 不同光照条件对菌株A,F,L菌丝生长的影响
3 讨 论
连作是导致太子参生长发育受阻、产量降低、品质变差、土传病增加的主要原因之一,目前学术界关于太子参连作障的研究碍日益增多,以期为太子参事业的发展提供理论基础。本研究针对所筛选出的3株真菌展开分子生物学鉴定与生物学特性研究,对其菌落形态和系统发育树进行比较分析,以了解所分离菌的生长环境因子。结果表明,菌株A与卵形孢球托霉()菌落形态相似[16],菌株A与卵形孢球托霉(MH857761.1)同源性为96%,初步鉴定为卵形孢球托霉。菌株F与王帆等[15]所研究的赭绿青霉在形态学和生物学特性上具有很高的相似性,与赭绿青霉()(MT072050.1)同源性高达99%,初步鉴定为赭绿青霉。本研究同时参考了国内报道的三七根腐病、设施韭菜根腐、甘草根腐病等研究报道尖孢镰刀菌的形态特征[17-21],以及对系统发育树分析发现,菌株L与菌株()(MW513784.1)同源性高达99.8%,初步鉴定菌株L为尖孢镰刀菌。并结合国内相关报道,卵形孢球托霉报道了因其产生乳酸使石灰石中Ca、Mg等离子溶出,从而对石灰石产生侵蚀作用[16]。赭绿青霉对棉铃虫幼虫、家蚕幼虫及柑橘全爪螨雌有一定的生防作用[19]。镰刀属菌则被报道为多数作物的主要致病菌之一,严重影响作物的产量及品质。如,汪静等[22]在三七根腐病的研究中发现其中一株致病菌为尖孢镰刀菌;肖荣凤等[23]研究发现导致太子参根腐病病原菌为尖孢镰刀菌。因此,可初步推测本次所分离的卵形孢球托霉和尖孢镰刀菌侵染太子参后具有一定的致病性,而赭绿青霉可能对太子参的虫害存在一定防治作用,且从太子参根际土壤中分离筛选出卵形孢球托霉和赭绿青霉属首次报道。
对于一种连作障碍严重的作物,明确其连作过程根际土壤真菌物种的同时,了解其生物学特性是开展连作障碍机理和缓解效应研究的前提,不仅可以明确其真菌在环境种的适应能力,也有利于了解连作障碍发生与环境因素之间的联系。本试验不同温度、pH值、碳源和光照条件下对3株真菌生长情况进行了了解,发现3株菌株对营养要求均不严格,在所有供试培养基上均可生长。关于菌株A的生物学特性研究报道较少,本研究发现其以D-果糖为碳源时生长速度最快,最适生长温度25~35 ℃,适合在碱性条件下生长。本研究得出菌株F的生长速度最快的碳源为糊精,与前人研究差异较大[15],这可能是赭绿青霉在不同环境下利用碳源的差异较大;最适生长温度为25 ℃,适宜于弱酸性和中性环境中生长。关于菌株L的生物学特性研究,研究者们认为其适宜多种碳源[17,24],但少有关注以糊精为碳源的生长情况,本研究得出其在糊精为碳源培养基也能较好的生长,但α-乳糖为最佳碳源;其适宜培养温度与敬雪敏等[24]研究结果基本一致,适宜于碱性条件。同时,3株菌株在三种光照条件下均能较好生长,说明光照对其的生长影响较小。
本研究通过菌落形态和系统发育树对太子参连作三年根际土壤中3株真菌进行了初步鉴定,并通过生物学特性试验初步明确了3株真菌菌丝的最适条件,对其生活习性有了初步的了解,为今后进一步探究太子参连作根际土壤中病原真菌或拮抗真菌在连作过程中对太子参的致病特性或拮抗特性的研究奠定基础,也为深入开展太子参连作过程病原真菌的防治提供一定的理论依据。但卵形孢球托霉和尖孢镰刀菌对太子参的侵染机制,以及赭绿青霉对太子参是否具有生防作用还有待于进一步研究。
4 结 论
(1)通过对菌株形态进行观察和结合系统发育树进行分析,初步判断菌株A为卵形球托霉(),菌株F为赭绿青霉(),菌株L为尖孢镰刀菌();
(2)菌株A在以D-果糖为碳源、温度30 ℃、pH值11、连续黑暗培养条件下生长良好。菌株F在以糊精为碳源、温度25 ℃、pH值5和6、12 h光暗交替培养条件下生长良好。菌株L以α-乳糖为碳源,温度条件为25 ℃,碱性条件下,连续黑暗或12 h光暗培养条件下,生长较好。
[1] 滕力庆,周涛,王晓.太子参化学成分及其药理作用研究进展[J].食品与药品,2021,23(1):73-79
[2] 王淑宜.大抓项目产业升级[N/OL].贵州日报,2021-12-18(1)[2022.10.21].https://baijiahao.baidu.com/s?id=171943119 3462189329&wfr=spider&for=pc
[3] 周丹,程搏幸,丁波.太子参真菌病害和防治研究进展[J].中国植保导刊,2020,40(9):23-27,32
[4] 段春梅.黄瓜连作障碍微生物修复研究[D].杨凌:西北农林科技大学,2010
[5] 任春光,苏文文,潘丽珊,等.基于高通量测序研究猕猴桃苗不同生育期根际真菌群落结构及多样性[J].土壤,2021,53(3):545-554
[6] 高慧芳,许佳音,孟婷,等.太子参根际土壤微生物多样性及其与土壤主要理化因子的相关性[J].福建农业学报,2021,36(3):345-357
[7] Chen J, Wu L, Xiao Z,. Assessment of the diversity ofspp. andspp. in radix pseudostell ariae rhizosphere under monoculture by combining DGGE and quantitative PCR [J]. Front Microbiol, 2017,8:1748
[8] Wu L, Chen J, Wu H,. Insights into the regulation of rhizosphere bacterial communities by application of bioorganic fertilizer inmonoculture regime [J]. Frontiers in Microbiology, 2016,7(400):1788
[9] 陈燕萍,肖荣凤,金国,等.太子参白绢病病原菌的分离鉴定及生防菌筛选[J].福建农业学报,2021,36(10):1203-1209
[10] 郭玲玲.微生物菌种保藏方法及关键技术[J].微生物学杂志,2019,39(3):105-108
[11] 牛世全,张雪莹,李静.岷县当归根腐病病原菌的分离鉴定及生物学特性研究[J].西北师范大学学报(自然科学版),2021,57(1):77-83
[12] 范文忠,冯时.紫穗槐叶斑病病原菌生物学特性及药剂敏感性[J].东北林业大学学报,2020,48(7):128-132
[13] 张国俊,梁霜,丁海霞.虎耳草黑斑病的病原分离鉴定及生物学特性研究[J].植物病理学报,2021,51(3):451-455
[14] 袁玉涛,史娟,马新.紫花苜蓿白粉病病原菌鉴定及其生物学特性[J].微生物学通报,2020,47(11):3539-3550
[15] 谢瑾卉,裴雪,林英.辽宁省花生褐斑病病原菌分离鉴定及生物学特性研究[J].中国植保导刊,2021,41(4):5-12
[16] 王广林,邓辉,聂丽.卵形孢球托霉NL-15对石灰岩的侵蚀机制[J].应用与环境生物学报,2018(2):374-378
[17] 王帆,向剑,胡军华,等.一株高致病力赭绿青霉的生物学特性及杀虫活性[J].中国生物防治学报,2019,35(4):576-585
[18] 文增叶,李定华,代梦瑶.三七根腐病病原菌尖孢镰刀菌的生物学特性分析[J].中药材,2019,42(9):1978-1984
[19] 高晓梅,吕国忠,李杨,等.设施韭菜根腐病致病镰孢菌鉴定及生物学特性研究[J].园艺学报,2022,49(4):893-906
[20] 代毅,杨文睿,吐逊艾力·艾孜提力.新疆甘草根腐病病原鉴定及生物学特性测定[J].北方园艺,2021(20):111-118
[21] 沈宝宇,刘坤.辽五味根腐病的病原菌鉴定与室内药剂筛选[J].中药材,2021(7):1554-1558
[22] 汪静,梁宗锁,康冰.文山三七根腐病病原真菌的鉴定与药剂防治[J].西北林学院学报,2015,30(1):158-163
[23] 肖荣凤,陈燕萍,陈梅春.太子参根腐病病原菌的鉴定及防治药剂筛选[J].植物保护学报,2020,47(6):1333-1342
[24] 敬雪敏,罗英花,秦忠成,等.尖孢镰刀菌生物学特性及杀菌剂毒力测定[J].中国草地学报,2019,41(5):144-151
Isolation, Identification and Biological Characteristics of Three Fungi from Continuous Cropping Rhizosphere Soil of
ZHOU Dan1, ZHU Mei1, WEI Xue-jiao1, HU Hua-lin2, CHENG Bo-xing1*
1.550018,2.550014,
Three strains of fungi isolated from Continuous Cropping RhizosphereSoil ofwere identified by molecular biology, and the effects of temperature, pH, carbon source and light on their biological characteristics were studied. The results showed that strain A was identified asand strain F was identified asby morphological observation and phylogenetic tree analysis. Strain L was. Strain A grew well under continuous dark culture condition with D-fructose as carbon source, temperature 30 ℃, pH 11. Strain F grew well under the condition of alternating light and dark culture with dextrin as carbon source, temperature 25℃, pH 5, 6, 12 h. Strain L grew well with α-lactose as carbon source under the condition of 25 ℃, alkaline, continuous dark or 12 h light dark culture.
;soil microbe;biological characteristics
S154.3
A
1000-2324(2022)06-0839-06
2022-10-21
2022-12-21
贵州省科技厅计划项目(黔科合支撑[2021]一般245);贵州省青年科技项目(黔教合KY字[2021]242);贵州师范学院“大地论文工程”科研成果(贵师院发[2020]99号);食用菌黑腹果蝇绿色防控关键技术研究(黔科合支撑[2019]2334)
周丹(1979-),女,硕士,高级实验师,主要从事连作障碍工作. E-mail:zhoudan_213@163.com
Author for correspondence. E-mail:kama225cbx@126.com
10.3969/j.issn.1000-2324.2022.06.004
