骨骼肌质量指数对胃肠道恶性肿瘤患者术后并发症及再入院率的影响
2023-01-13陈格亮
邱 琼, 张 静, 陈格亮, 花 超, 李 维, 刘 璟, 谢 华
(上海交通大学医学院附属同仁医院营养科,上海 200336)
随着我国老龄化进程的加快,恶性肿瘤发病率持续升高,一直是我国居民死亡原因中的第二位。无论男性还是女性,胃癌和结肠癌均排名恶性肿瘤发病率的前十位[1]。手术仍然是胃结肠癌治疗的主要手段,加速康复外科亦已作为胃肠道恶性肿瘤标准的手术路径开展多年。术前营养状况评估是加速康复外科的重要组成部分[2]。研究表明患者术前的营养状态与术后的临床结局密切相关,是影响外科术后患者预后的重要危险因素[3]。根据加速外科指南,常用NRS2002评估患者术前有无营养不良风险[4]。近年逐渐认识到,骨骼肌肌力、肌量或功能的下降与恶性肿瘤患者的营养状态和预后密切相关[5]。既往报道肌肉减少症是包括胃癌在内的多种疾病术后不良预后的独立危险因素,但也有研究得出不同的结论,因此这一结果仍存在一定争议[6]。CT是评估骨骼肌含量的“金标准”,但是费用高,操作不便限制了临床运用。通过生物电阻抗(bioelectrical impedance analysis, BIA)可以测得四肢骨骼肌量,进而获得骨骼肌质量指数。2019年亚洲肌肉减少症的专家共识中已将BIA作为肌肉减少症的诊断依据[7]。本研究探讨骨骼肌质量指数对胃肠道恶性肿瘤患者术后并发症及再入院率的影响。
1 资料与方法
1.1 一般资料
选择2020年7月—2021年3月在上海交通大学医学院附属同仁医院胃肠外科胃肠道恶性肿瘤住院患者。纳入标准: 年龄≥18岁,四肢健全,确诊为恶性肿瘤且可以接受手术治疗且进入胃肠道加速康复临床路径,术后至少1个月的有效随访;排除标准: 住院时间<24 h、心脏起搏器植入、不能配合进行人体成分测定的患者。
1.2 方法
1.2.1 一般情况调查 主要包括性别、年龄及主要诊断(胃癌、结肠癌,直肠癌);患者术前内科合并症采用查尔森合并症指数(Charlson comorbidity index, CCI)量化。查尔森合并症指数=合并症计分+年龄计分。营养风险筛查(nutrition risk screaning, NRS)根据NRS2002评分。
1.2.2 体格检查 患者的身高、体质量采用上海交通大学医学院附属同仁医院胃肠外科病区的体质量秤在入院时空腹着病房服统一测量,体质量指数(body mass index, BMI)=体质量(kg)/身高2(m2)。采用BIA法测得四肢肌肉量,根据公式计算骨骼肌质量指数(skeletal muscle mass index, SMI)=四肢肌肉质量(kg)/身高2(m2)。依据2019年亚洲肌肉减少症的专家共识[8]推荐,男性SMI<7.0 kg/m2,女性SMI<5.7 kg/m2判断为骨骼肌肉量减少。人体成分测定采用Inbody S10人体成分分析仪,受试者入院24 h内,选择卧姿测量模式,输入住院号、体质量、身高、年龄、性别及姿态,电极分别连接双手的大拇指、中指及双足踝骨下方两侧,双手自然放在身体的两边,身体的任何部位均不可碰触金属物体,通过测量人体在不同频率下的阻抗值,得出人体中各类成分的含量(包括四肢骨骼肌、体脂率、身体总水分、去脂体质量、上臂肌围、上臂围、相位角等)。握力测量: 受试者站立位,双臂自然下垂,掌心向内,用优势手持电子握力计(CAMRY-EH101,广州香山衡器集团公司),显示屏向外,勿与身体和衣物接触,一次性用力握紧握力计,读数并记录,休息30 s后重复测量1次,取最大值为优势手握力(精确到小数点后1位)。小腿围测量采用无弹性的皮尺,受试者站立位,两腿分开同肩宽,测量非优势侧小腿最粗壮处的周径,精确到0.1 cm,测量2次,取平均值。营养相关临床指标(包括总蛋白、白蛋白、前白蛋白,血红蛋白,淋巴细胞计数)采用西门子ADVIA2400全自动生化仪检测。
1.2.3 其他指标判定标准 患者术后病理分期采用美国癌症联合委员会(American Joint Committee on Cancer, AJCC)胃癌和结肠癌分期(第8版)。术后并发症通过查阅患者病程记录及护理记录、影像及化验指标、医嘱处置记录收集,按照Clavien-Dindo并发症评分系统进行统计[9]。查阅病史记录和医嘱获得患者手术方式、总住院时间、术后住院时间、住院总费用和术后恢复半流质时间。
1.3 统计学处理
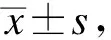
2 结 果
2.1 两组术前一般资料及营养状况比较
本研究共收集了94例胃肠道恶性肿瘤手术患者,其中SMI正常组61例,SMI降低组33例。术前,SMI正常组的BMI和肌肉量均高于SMI降低组,NRS2002评分显著低于SMI降低组,差异有统计学意义(P<0.001)。SMI正常组的前白蛋白均高于SMI降低组,差异有统计学意义(P<0.05),两组的总蛋白、白蛋白、合并症指数差异无统计学意义,见表1。
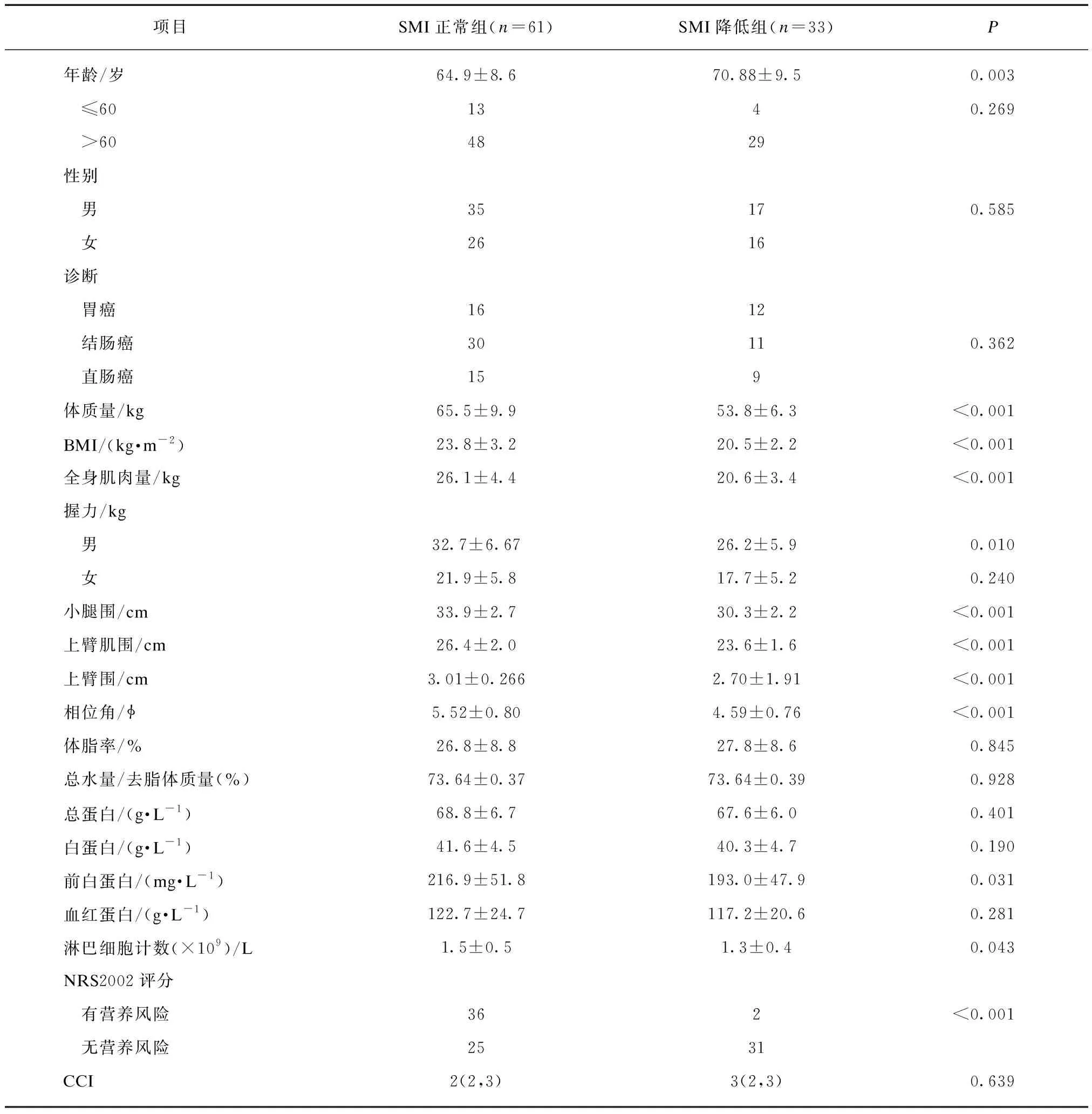
表1 骨骼肌质量指数正常组和降低组的基本临床资料比较
2.2 两组术中及术后临床结局比较
术后SMI正常组的并发症发生率低于SMI降低组,差异有统计学意义(P<0.05)。SMI正常组的总费用与SMI降低组相比,差异无统计学意义(P>0.05)。将两组术中及术后临床结局进行比较,手术方式、肿瘤原发位置、病理结果的肿瘤分期、恢复半流质时间、住院天数差异均无统计学意义(P>0.05),见表2。
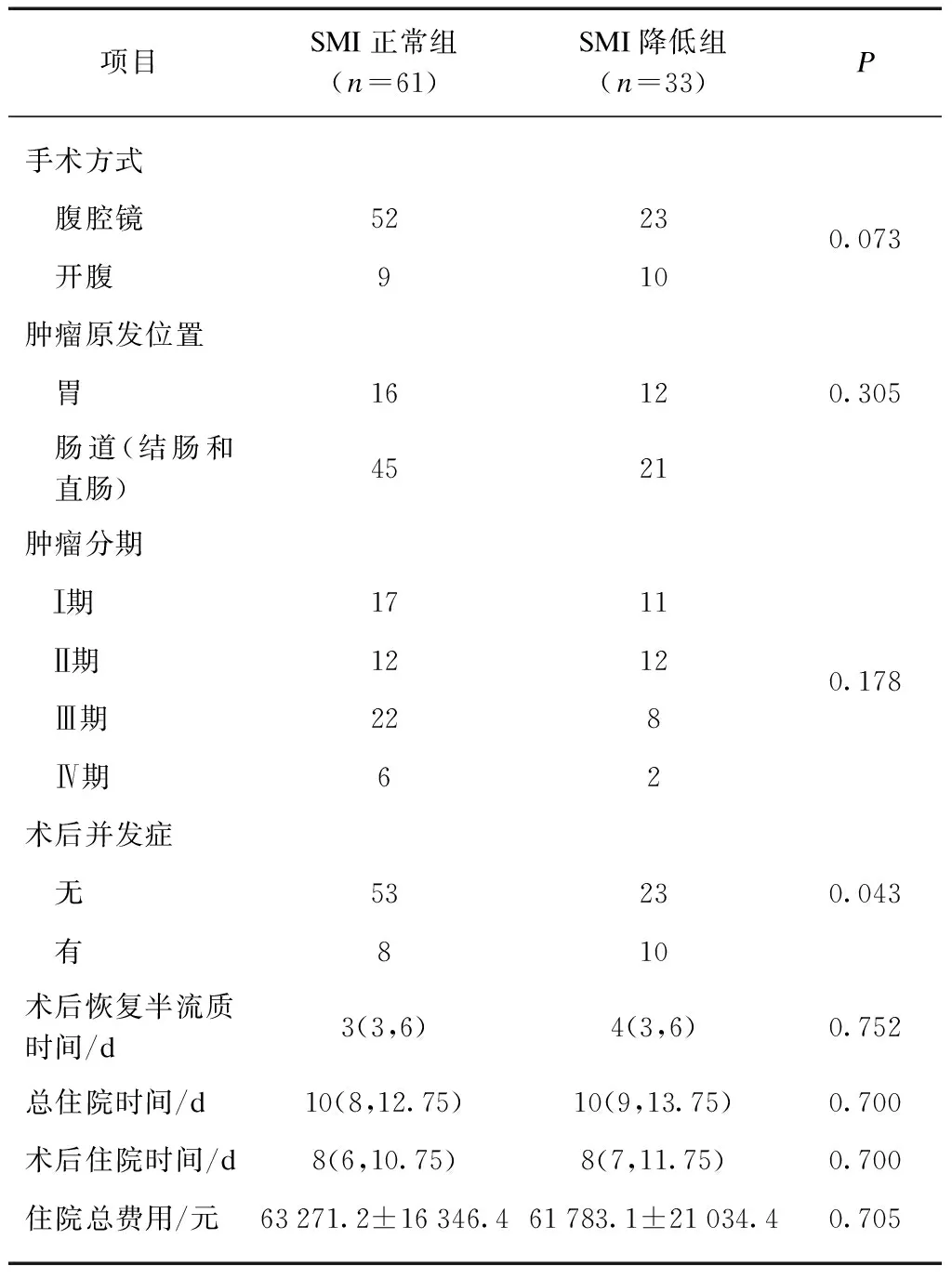
表2 骨骼肌质量指数正常组和降低组的术中及术后临床结局比较
2.3 术后并发症单因素和多因素分析


表3 胃肠道恶性肿瘤术后并发症的单因素分析
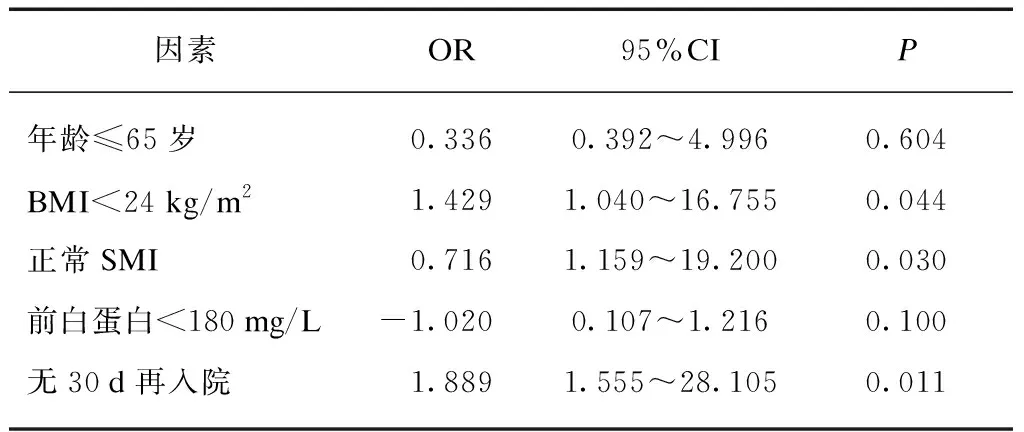
表4 胃肠道恶性肿瘤术后并发症的多因素分析
3 讨 论
本研究对94例进入胃肠道恶性肿瘤加速康复外科临床路径的患者进行分析发现,胃肠道恶性肿瘤患者术前SMI减少发生率为35.10%,并且术前SMI减少者其术后总并发症发生率明显高于骨骼肌质量指数正常组。本研究结果提示术前骨骼肌量的减少可增加胃肠道肿瘤术后的并发症,与Wagner等[10]和田浩等[11]研究结果一致。
胃肠道恶性肿瘤仍是我国居民肿瘤死亡的主要原因,根治性手术是胃肠恶性肿瘤最重要的治疗手段。临床上由于肿瘤等因素导致患者术前进食量改变、机体瘦组织丢失更多,增加患者营养不良及营养风险的发生。加速康复外科指南中指出,对于有营养风险的患者术前至少需要给予7 d的营养治疗,这样才能有利于减少术后并发症等临床结局[2]。目前,对于术前的营养评估仍采用NRS2002、患者主观综合评估(the patient-generated subjective global assessment, PG-SGA)、营养不良筛查工具(malnutrition screening tool, MST),尽管NRS2002、PG-SGA被作为主要的营养评估和筛查工具,但越来越多的证据表明骨骼肌量的减少与术后并发症和临床结局密切相关。

本研究结果中,术前SMI降低组的BMI、白蛋白、前白蛋白均低于正常组。NRS 2002评分中,SMI降低组的评分更高,提示更容易出现营养不良风险。这提示在加速康复外科肿瘤患者中,纳入对患者骨骼肌力和肌量的评估对于规范的营养治疗、改善患者术后临床预后有着重要的作用。
由于BIA测定骨骼肌力和肌量易于床边操作且无放射性,可以作为胃肠道肿瘤术前营养评估的工具。同时,对于术前存在肌少症的患者,应当及时给予充足的能量和蛋白质供应、积极的运动等预康复手段,减少术后并发症,从而实现加速康复的要求。
