膝骨关节炎患者血清细胞因子样蛋白1水平变化及临床意义
2023-01-13符林雄李儒琳
王 汉,符林雄 ,李儒琳
(1.中南大学湘雅医学院附属海口医院骨科,海口 570208;2.琼海市人民医院骨科,海南 琼海 571400)
骨关节炎(OA)是人类最常见的退化性骨关节疾病之一,其特征是关节软骨逐渐退化和丧失,可累及全身各关节,尤其以膝关节OA(KOA)发病率最高[1-2]。KOA临床症状通常只有在软骨已经不可逆转地被破坏时才会出现,因此若不能得到有效控制,患者常会面临关节疼痛、功能丧失等风险[3-4]。目前临床上对于KOA的预防治疗仍缺乏行之有效的手段,部分原因与其发病机制不明确有关。细胞因子样蛋白1(CYTL-1)是一种新型的自分泌型调节因子,在软骨细胞中高度表达,参与软骨的形成和发育以及关节炎的发生和发展[5]。CYTL-1最初被确定为调节造血干/祖细胞成熟的重要分子[6],有研究[7]发现CYTL-1亦具有细胞因子样特性和趋化因子活性,在组织再生方面发挥新的作用,并有可能成为疾病控制治疗药物输送的靶标。因此本研究旨在分析原发性KOA患者血清和滑液CYTL-1水平变化,以及与疼痛程度和身体残疾程度的相关性,从而为利用血清CYTL-1早期识别关节软骨破坏的高风险个体以及作为OA治疗的新靶点提供证据支持。
1 材料与方法
1.1 研究对象
纳入2016年2月至2021年10月中南大学湘雅医学院附属海口医院收治的122例KOA患者(KOA组)作为研究对象,所有患者均符合中华医学会骨科分会《骨关节炎诊治指南(2007年版)》[8]制定的诊断标准:1)近1个月内出现反复膝关节疼痛;2)X线片(站立或负重位)显示关节间隙变窄、软骨下骨硬化和(或)囊性变、关节缘骨赘形成;3)年龄>40岁;4)晨僵时间<30 min;5)活动时有骨摩擦音。满足上述1)和2)—5)中任意2条即可诊断为KOA。
纳入标准:1)符合上述KOA的诊断标准,且至少有一个膝关节Kellgren-Lawrence分级≥Ⅱ级,VAS评分≥4分;2)患者知情同意本研究内容,并签署知情同意书。排除标准:1)有膝关节手术史、外伤史或患肢有血管神经损伤史者;2)合并类风湿性关节炎、强直性脊柱炎、膝关节肿瘤或结核、严重骨质疏松症或合并其他部位OA者;3)合并严重内科疾病,严重精神疾病,严重心、肝、肾、凝血功能障碍,或服用抗凝剂,妊娠者。
所有患者均持续服用塞来昔布。另选取同期年龄、性别组成、体重指数(BMI)相匹配、于中南大学湘雅医学院附属海口医院体检的健康受试者165例作为对照组。对照组受试者均没有炎症性疾病或其他部位骨关节炎。本研究已获得本院伦理委员会批准,并遵循《赫尔辛基宣言》。
1.2 血清和滑液CYTL-1的检测
空腹、静脉穿刺获取血样5 mL,并静置1 h后分离血清。5 d内测量的样品保存在4 ℃冰箱中,1周以后测量的样品保存在-20 ℃冰箱中。
外侧入路采集膝关节滑液,对于双侧KOA患者,选择Kellgren-Lawrence分级更高的关节采集滑液。将支架放置在膝盖下方,膝盖弯曲30°,然后用5 mL无菌注射器插入髌骨侧部,将针头向下和向内侧推进至髌骨后外侧方向,到达滑膜间隙。从滑膜腔抽出约2 mL滑液,在-80 ℃储存。
采用美国BioTek Instruments公司生产的ELX800酶标记物,通过酶联免疫吸附试验(ELISA)测定血清和滑液CYTL-1水平。试剂盒购自上海酶联生物技术有限公司,所有步骤均按照制造商说明书严格操作。
1.3 身体残疾程度评估
KOA患者均采用西大略湖麦克马斯特大学骨关节炎指数(WOMAC)[9]作为身体残疾程度评估标准,双膝发病者以较重一侧的分数为依据。该量表包括疼痛、关节僵硬及日常活动3个部分,共24个项目,每个项目均采用5级评分法进行评分。总分越高,提示残疾程度越严重,95%置信区间(CI)最小可检测到的变化为16.1。根据总积分评估骨关节炎的轻重程度:轻度<80分,中度80~120分,重度>120分。
1.4 疼痛程度评估
根据视觉模拟数字评价量表(VAS)进行评分,用以评估KOA患者疼痛程度。询问患者下蹲、起立动作时的主观疼痛感受,分数0~10分,0分为无痛,10分为剧痛,VAS评分越高,表示患者疼痛程度越大。95%CI最小可检测到的变化为0.08。4~6分为中度疼痛,7~10分为重度疼痛。
1.5 统计学方法
采用SPSS19.0统计学软件进行数据处理。2组一般资料比较、KOA患者血清CYTL-1水平与临床病理特征的关系采用独立样本t检验或卡方检验。通过Spearman等级相关分析和多元线性回归模型分析血清CYTL-1与WOMAC评分、VAS评分的关系。绘制受试者工作特性(ROC)曲线分析血清CYTL-1水平对KOA患者重度疼痛及残疾的诊断价值的曲线下面积(AUC)和最佳cut-off值。以P<0.05为差异有统计学意义。
2 结果
2.1 2组受试者一般资料
2组年龄、性别、职业比较,差异无统计学意义(P>0.05),但KOA组BMI高于对照组,差异有统计学意义(P<0.05),见表1。

表1 2组受试者一般资料比较
2.2 2组受试者血清CYTL-1水平比较及其对KOA的诊断价值
KOA组血清CYTL-1水平低于对照组[169.10(114.24,233.28)ng·mL-1比316.11(240.17,379.12)ng·mL-1,P<0.001]。为了排除年龄、性别、BMI、职业等客观因素的干扰,经Logistic回归分析后,血清CYTL-1水平降低仍然是KOA发生的独立危险因素(β=-0.013,Walds=45.874,Exp(β)=0.987,95%CI:0.983~0.991,P<0.001)。经ROC曲线分析,血清CYTL-1用于KOA诊断的AUC为0.834(95%CI:0.787~0.881),见图1—2。
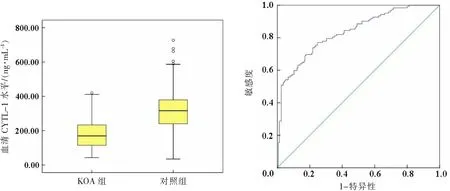
图1 2组受试者血清CYTL-1水平 图2 血清CYTL-1对KOA的诊断效能
2.3 KOA患者滑液和血清CYTL-1水平的关系
KOA患者滑液CYTL-1水平为328.92(206.80,495.54)ng·mL-1。经Spearman秩相关分析,与血清CYTL-1水平呈正相关(rS=0.521,P<0.001)。校正单膝和双膝发病因素后,多元线性回归分析显示,KOA患者血清和滑液CYTL-1水平仍保持正相关(β=0.243,95%CI=0.178~0.308,P<0.001)。
2.4 KOA患者血清CYTL-1水平与WOMAC及VAS评分相关性
Spearman秩相关分析显示,KOA患者的血清CYTL-1水平与WOMAC、VAS评分均呈负相关(rS=-0.455、-0.421,P<0.001),见图3。经多元线性回归分析,在校正年龄、性别、BMI、职业等混杂因素后,回归模型检验有统计学意义(F=8.314,P<0.001),血清CYTL-1水平与WOMAC总评分呈负相关(β=-0.373,95%CI=-0.004~-0.002,P=0.002),其中疼痛评分(β=-0.281,95%CI=-0.009~-0.002,P=0.041)、僵硬评分(β=-0.345,95%CI=-0.017~-0.001,P=0.011)、关节功能评分(β=-0.499,95%CI=-0.008~-0.001,P<0.001)。血清CYTL-1水平与VAS评分呈负相关(β=-0.218,95%CI=-0.003~-0.001,P<0.001)。
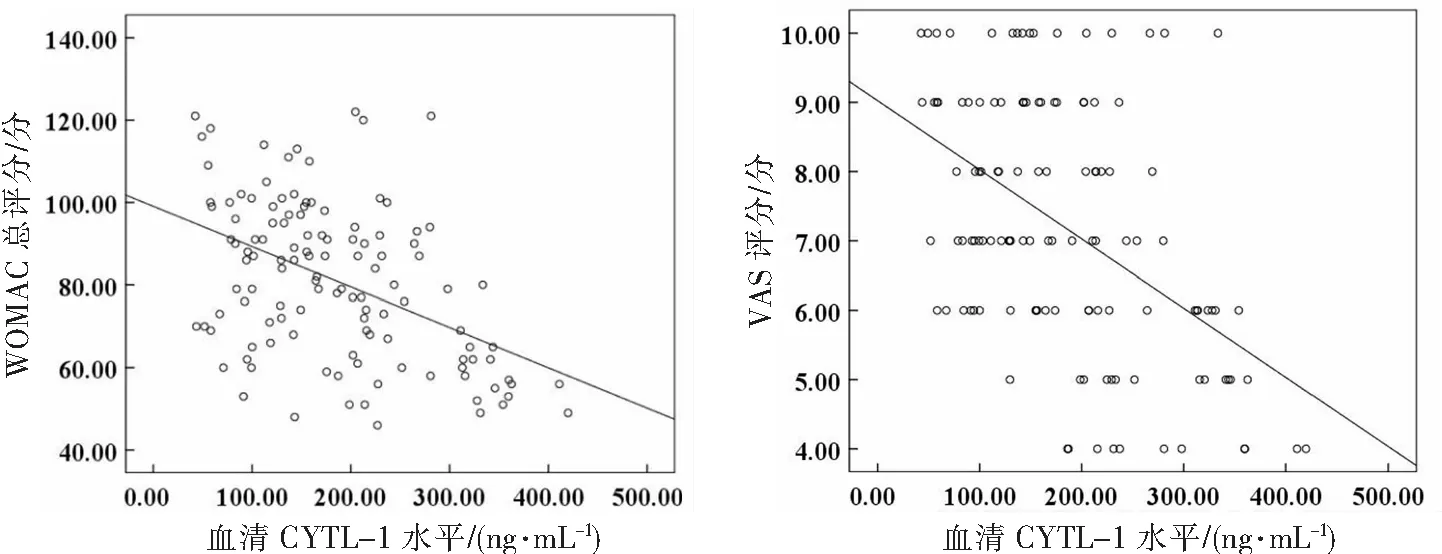
图3 KOA患者血清CYTL-1水平与WOMAC及VAS评分的Spearman相关性
2.5 KOA患者血清CYTL-1水平与临床病理特征的关系
根据KOA患者血清CYTL-1水平中位值(169.10 ng·mL-1),将KOA患者分为低水平组(<169.10 ng·mL-1)、高水平组(≥169.10 ng·mL-1)。结果显示低水平组较高水平组Kellgren-Lawrence分级、软骨缺损评分以及站起-走计时(TUG)测试秒数均更高(P<0.05),见表2。
2.6 血清CYTL-1水平对KOA患者重度疼痛及残疾的诊断价值
经ROC曲线分析,血清CYTL-1水平诊断KOA患者重度疼痛及残疾的AUC分别为0.774(95%CI:0.685~0.863)、0.704(95%CI:0.602~0.791)。见表3和图4—5。
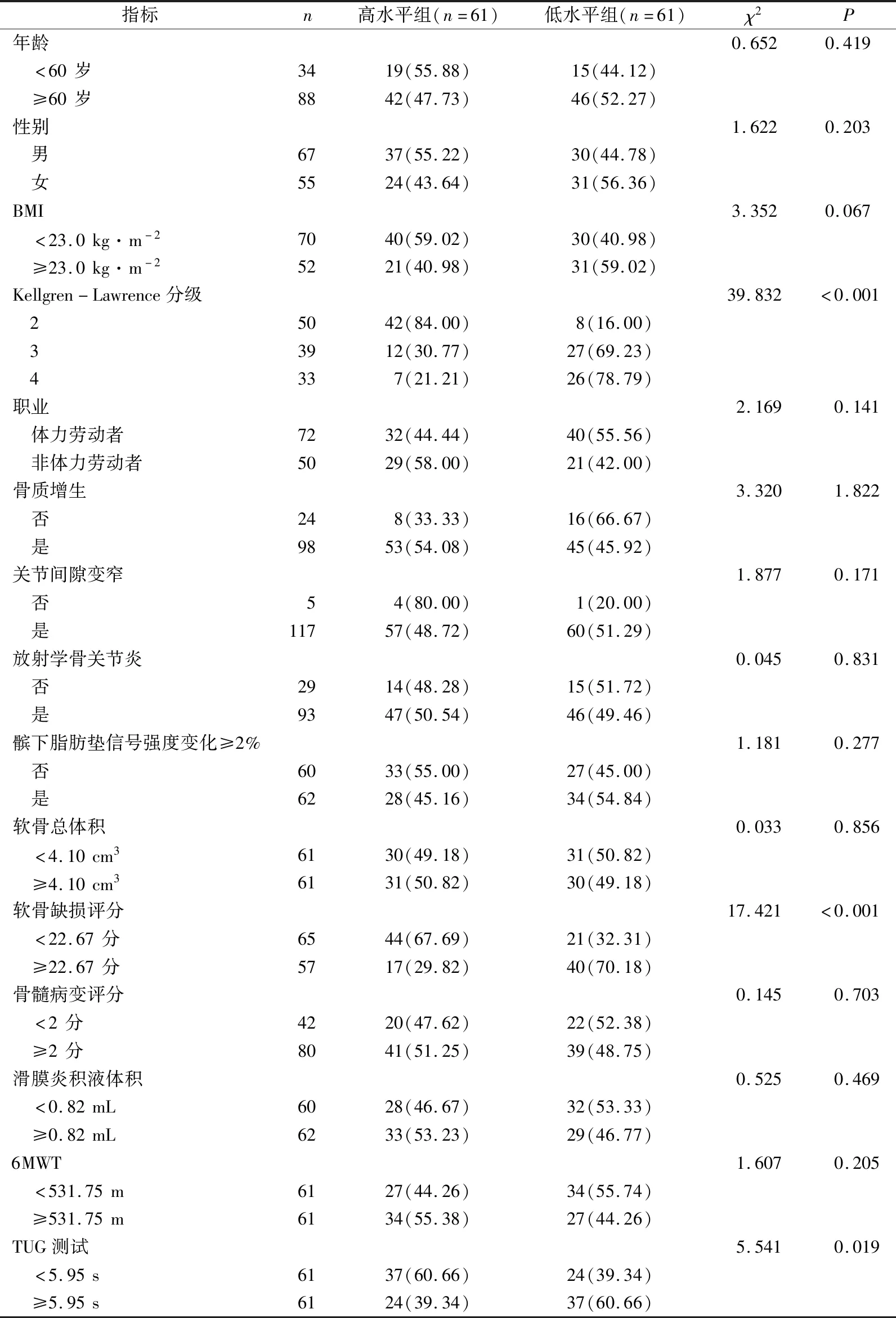
表2 KOA患者血清CYTL-1水平与人口统计学资料及临床病理特征的关系 n(%)

表3 血清CYTL-1水平对KOA患者重度疼痛及残疾的诊断价值
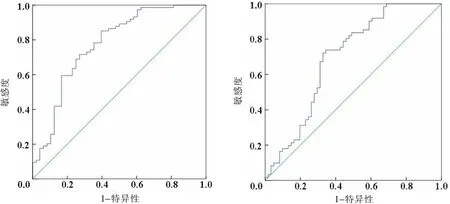
图4 血清CYTL-1水平诊断KOA患者重度疼痛ROC曲线 图5 血清CYTL-1水平诊断KOA患者重度残疾ROC曲线
3 讨论
KOA是一种进行性慢性疾病,其特征是软骨退行性变、软骨下骨形成和滑膜改变,并引起疼痛、肿胀和运动受限等临床症状[1]。临床上认为KOA发病隐匿,当患者因不适就医时往往膝关节已出现不可逆性损伤[11],因此KOA患者疼痛及身体残疾程度准确诊断对后续治疗是至关重要的。本研究根据既往研究结论,对CYTL-1与KOA的相关性进行分析,发现KOA患者血清CYTL-1水平显著低于对照组[169.10(114.24,233.28)ng·mL-1比316.11(240.17,379.12)ng·mL-1,P<0.001],此外,血清CYTL-1水平<169.10 ng·mL-1的患者Kellgren-Lawrence分级为4级(78.79%比21.21%)、软骨缺损评分≥22.67 分(70.18%比29.82%)以及TUG测试秒数≥5.95 s(60.66%比39.34%)的占比均更高,提示CYTL-1可能与KOA的疾病发生、发展相关。
WOMAC评分量表是评估下肢(髋关节、膝关节)OA患者疼痛、关节僵硬及日常活动的自我报告疾病特异性工具,WOMAC评分已经被临床应用于手术、药物、生物制剂、仪器及物理治疗后的疗效评估,且被证实可以提高患者的依从性[12-13]。但其评分的准确度常受到患者身体其他区域疼痛串扰的影响,从而易产生评估误差[4]。VAS评分使用范围更加广泛,如在腹股沟疝、腰间盘突出等疾病评估中使用[14-15],且受到患者主观感受差异影响,也易伴有误差。而生物标志物是指能客观测量并且可以评估正常生理代谢过程、病理变化以及治疗效果的生化指标,客观性、准确性更佳。本研究血清CYTL-1与WOMAC总评分(β=-0.373,95%CI:-0.004~-0.002,P=0.002)、疼痛评分(β=-0.281,95%CI:-0.009~-0.002,P=0.041)、僵硬评分(β=-0.345,95%CI:-0.017~-0.001,P=0.011)、关节功能评分(β=-0.499,95%CI:-0.008~-0.001,P<0.001)均存在独立负相关,提示血清CYTL-1在一定程度上能够反映疾病进展情况。
CYTL-1为具有136个氨基酸的分泌蛋白,是一种多功能新型细胞因子,它最初在来自人脐带血、外周血和骨髓的CD34+造血干/祖细胞中被发现,但后续研究发现在软骨细胞中CYTL-1也呈高表达[16-17]。细胞因子在OA的发生、发展过程中起着至关重要的作用,关节软骨细胞、滑膜细胞可产生多种细胞因子,如肿瘤坏死因子α、白介素-6等(IL-6),在OA的炎症反应中扮演着重要角色。CYTL-1为新型细胞因子,其在软骨细胞中特异性高表达[17],既往动物实验[6]已发现敲除CYTL-1的小鼠表现出正常的软骨内骨化和长骨发育,同时CYTL-1可负调节间充质细胞的成骨,正向调节破骨细胞的成骨,从而调节小鼠的骨量。软骨发育始于间充质细胞分化成软骨细胞,众多研究认为CYTL-1参与软骨的形成、发育以及OA的发生、发展[18]。已知CYTL-1可增加软骨形成过程中IL-1的表达。此外,CYTL-1具有很强的促血管生成作用,与血管内皮生长因子-A 作用相当。CYTL-1还被发现参与巨噬细胞迁移的调节,CYTL-1的结构-功能分析表明它可能采用IL-8样趋化因子折叠,特别类似于CCL2,并且CYTL-1还表现出对单核细胞和巨噬细胞的趋化作用[7,19-20]。本研究结果显示KOA患者血清CYTL-1水平普遍降低,且与滑液CYTL-1表达呈独立正相关(rS=0.521,P<0.001)。近年来,血清和滑液中的生物标记物代表了一组潜在的新工具,可作为常规诊断成像检查之外的辅助检测手段。虽然与血清相比,滑液中细胞因子水平的变化可能更能够直接反映关节病变的进展程度。但是滑液样本的采集属于侵犯性操作,而血清生物标记物更容易检测,本研究也证实血清CYTL-1与WOMAC及VAS评分均呈负相关,而且ROC曲线分析显示,血清CYTL-1水平对于KOA患者重度疼痛[0.774(95%CI:0.685~0.863)]及重度残疾[0.704(95%CI:0.602~0.791)]都有诊断价值,说明检测血清样本CYTL-1可以客观地评估疾病活动,有助于预测疾病预后和评估治疗反应。
4 结论
KOA患者血清CYTL-1水平降低与疾病发生和进展密切相关,因此有望成为KOA治疗的新靶点以及检测疾病进展的新型生化指标。然而本研究有一些不可避免的局限性需要考虑,首先,这项横断面研究纳入样本较少,有必要在更大的人群中进行研究加以验证;其次,出于伦理原因,未测量健康人滑液样本中CYTL-1水平;第三,没有研究透明质酸注射或手术是否会改变KOA患者滑液和血清CYTL-1水平;最后,只测量了CYTL-1水平,若增加其他潜在趋化因子可能会获得对KOA病情进展更有用的信息。
