miR-185-5p靶向AKR1C1抑制肺癌细胞的迁移和侵袭
2023-01-13贠宇辉杨三虎
贠宇辉,杨三虎,杨 锋
(空军军医大学唐都医院胸腔外科,西安 710000)
肺癌是一种常见的呼吸系统恶性肿瘤,包括非小细胞肺癌(non small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)[1-2]。NSCLC占所有肺癌的80%~85%,其中以腺癌、鳞状细胞癌和大细胞肺癌最常见[3]。转移、复发是NSCLC患者死亡的主要原因[4]。因此,阐明NSCLC转移机制,寻找新的转移相关因子,开发转移相关靶向药物在改善其预后方面具有重要意义。
微小RNA(miRNA)是一种短片段的单链内源性保守的RNA分子,通过调控靶基因在疾病中发挥作用[5]。miR-185-5p是新近发现的在肺癌中失调的miRNA之一,其参与乳腺癌、结肠癌、膀胱癌等多种实体瘤的发展[6-8]。醛酮还原酶1家族成员C1(aldehyde ketone reductase 1 family member C1,AKR1C1)是人类醛酮还原酶家族成员,该家族由AKR1C1、AKR1C2、AKR1C3、AKR1C4 4种酶组成,均具有催化还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)的作用[9]。有研究[10]证实,AKR1C1参与包括肺癌在内的多种癌症恶变过程,但是其与miR-185-5p在肺癌中的关系尚不清楚。本研究拟以肺癌为研究对象,观察miR-185-5p在肺癌组织和细胞中的表达及其对肺癌细胞迁移侵袭的影响,并探讨miR-185-5p与AKR1C1之间的靶向关系,为晚期肺癌治疗靶点的发现提供实验依据。
1 材料与方法
1.1 组织样本
收集空军军医大学唐都医院2018年4月至2021年1月期间行肺癌切除术患者的癌及对应癌旁组织标本各31例。所有患者及其家属均签署知情同意书。本研究经本院伦理委员会批准。入选标准:1)自愿参与并签署知情同意书;2)符合中华医学会肺癌临床诊疗指南(2019版)[10]诊断肺癌的标准。排除标准:1)合并其他恶性肿瘤;2)不符合医学伦理,如孕妇、晚期且生存期不足3个月者。
1.2 细胞系和主要试剂
人正常肺上皮细胞BEAS-2B、肺癌细胞A549、H460均购自美国菌种保藏中心;DMEM培养基购自美国Hyclone公司;胎牛血清购自杭州四季青公司;LipofectamineTM3500转染试剂盒、TRIzol液均购自美国Invitrogen公司;RT-qPCR试剂盒购自北京天根生物科技有限公司;Transwell小室(8.0 μm)购自美国Corning公司;兔抗人AKR1C1、基质金属蛋白酶(MMP)-2、MMP-9多抗和辣根过氧化物酶标记的山羊抗兔二抗均购自上海Abcam公司;ECL发光液购自上海伯乐生命医学科技公司;双荧光素酶报告基因检测实验试剂盒购自美国Promega公司;miR-185-5p、anti-miR-185-5p、AKR1C1-WT、AKR1C1-MUT及所有引物的设计合成均由上海吉玛科技有限公司完成。
1.3 方法
1.3.1 实验分组
将组织样本分为癌旁组和肺癌组;常规培养的BEAS-2B、A549、H460细胞分别标记为BEAS-2B组、A549组、H460组;A549细胞转染实验分为miR-NC组(转染miR-NC)、miR-185-5p组(转染miR-185-5p)、miR-185-5p+pcDNA组(共转染miR-185-5p和pcDNA)、miR-185-5p+pcDNA-AKR1C1组(共转染miR-185-5p和pcDNA-AKR1C1)。
1.3.2 细胞培养与A549细胞转染
于37 ℃、含5%CO2的饱和湿度细胞培养箱中,用含有10%胎牛血清的DMEM培养基常规培养BEAS-2B、A549、H460细胞。每隔2~3 d更换1次细胞培养基。按照脂质体:质粒或核酸序列为3:1的比例混匀后与A549细胞共培养12 h,更换新培养基,继续培养至48 h,RT-qPCR或蛋白免疫印迹实验验证转染效果。
1.3.3 RT-qPCR实验检测miR-185-5p、AKR1C1的表达
将需要检测的组织充分研磨,细胞收集待用。用TRIzol液提取总RNA,再将其反转录为cDNA作为模板。使用RT-qPCR试剂盒检测模板中miR-185-5p、AKR1C1的表达情况。以U6或GAPDH为内参,2-△△Ct计算miR-185-5p、AKR1C1的相对表达量。引物信息见表1。

表1 靶基因的引物序列
1.3.4 Transwell 实验检测细胞的迁移和侵袭
将需要检测的细胞用无血清培养基饥饿培养12 h,再用无血清培养基调整至5×104个·mL-1,待用。取200 μL置于Transwell小室的上层,均匀涂抹,下室置于600 μL的含血清培养基,37 ℃恒温细胞培养箱中培养48 h。取出小室,拭去未发生穿膜的细胞,用甲醇固定20 min,甲基蓝结晶紫染液染色15 min,显微镜下观察计数细胞的数目。计数3次,取平均值。细胞侵袭实验的操作步骤同上,Transwell小室更换为含有基质胶的上层膜。
1.3.5 划痕实验检测细胞伤口愈合
将待检测的细胞接种到6孔板,每孔5×105个。使用无血清培养基培养,待细胞融合度达90%,用无菌10 μL枪头,垂直细胞板划出“一”字伤口,再用无血清培养基漂洗。倒置显微镜下拍照记录原始的划痕宽度。再继续培养48 h后记录愈合后伤口宽度。使用Image J软件分析伤口的愈合率(%)=(初始伤口宽度-愈合后伤口宽度)/初始伤口宽度×100%。
1.3.6 蛋白免疫印迹实验检测AKR1C1、MMP-2、MMP-9的蛋白表达
充分无菌研磨组织,用4倍体积的裂解液充分裂解,提取总蛋白。待检测的细胞使用裂解液冰上裂解30 min,提取总蛋白。BCA法检测蛋白浓度,沸水浴法变性蛋白,取10 μg蛋白上样,进行SDS-PAGE蛋白电泳,并将胶上的蛋白用转膜仪转移至硝酸纤维素膜。将膜用含有2.5%脱脂奶粉的封闭液37 ℃孵育处理2 h。充分洗膜,浸入稀释好的一抗(AKR1C1、MMP-2、MMP-9)中4 ℃孵育过夜。充分洗膜,浸入稀释过的二抗溶液(辣根过氧化物酶标记的山羊抗兔)中,37 ℃孵育2 h。洗膜,滴加ECL电化学发光试剂显影、曝光。Image J软件分析蛋白的灰度值,以目的蛋白与内参β-actin的比值表示目的蛋白的相对表达。
1.3.7 双荧光素酶报告基因实验检测细胞荧光素酶活性
使用靶基因在线预测网站Starbase(https://starbase.sysu.edu.cn)预测miR-185-5p的下游靶基因。化学合成含有AKR1C1 3′UTR结合位点的片段(AKR1C1-WT)、不含AKR1C1 3′UTR结合位点的突变片段(AKR1C1-MUT),并插入荧光载体,构建荧光素酶报告基因载体。将载体分别与miR-NC、miR-185-5p、anti-miR-NC、anti-miR-185-5p共转染A549细胞,使用双荧光素酶报告基因检测试剂盒检测分析细胞的荧光素酶活性。
1.3.8 统计学方法
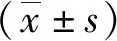
2 结果
2.1 miR-185-5p在肺癌组织和细胞系中的表达
RT-qPCR结果显示:肺癌组miR-185-5p的表达水平较癌旁组显著降低[(0.46±0.06)比(1.00±0.09),t=14.977,P<0.001];与BEAS-2B组(1.01±0.07)比较,A549组(0.25±0.07)和H460组(0.57±0.06)miR-185-5p的表达水平均显著降低(F=293.373,P<0.001)。
2.2 过表达miR-185-5p对A549细胞迁移、侵袭的影响
与miR-NC组比较,miR-185-5p组A549细胞的miR-185-5p表达[(3.79±0.46)比(0.99±0.07),t=18.053,P<0.001]显著升高,迁移细胞数[(77±8)比(100±8),t=6.099,P<0.001]和侵袭细胞数[(48±6)比(74±8),t=7.800,P<0.001]及划痕愈合率[(47.83±4.42)%比(81.79±8.85)%,t=10.294,P<0.001]均显著降低,MMP-2 [(0.59±0.07)比(0.98±0.08),t=11.006,P<0.001]、MMP-9 [(0.42±0.08)比(0.99±0.07),t=16.086,P<0.001]的蛋白表达均显著降低。见图1。
A:Transwell实验检测细胞迁移和侵袭;B:划痕实验检测细胞伤口愈合;C:蛋白免疫印迹检测蛋白表达。
2.3 miR-185-5p靶向AKR1C1
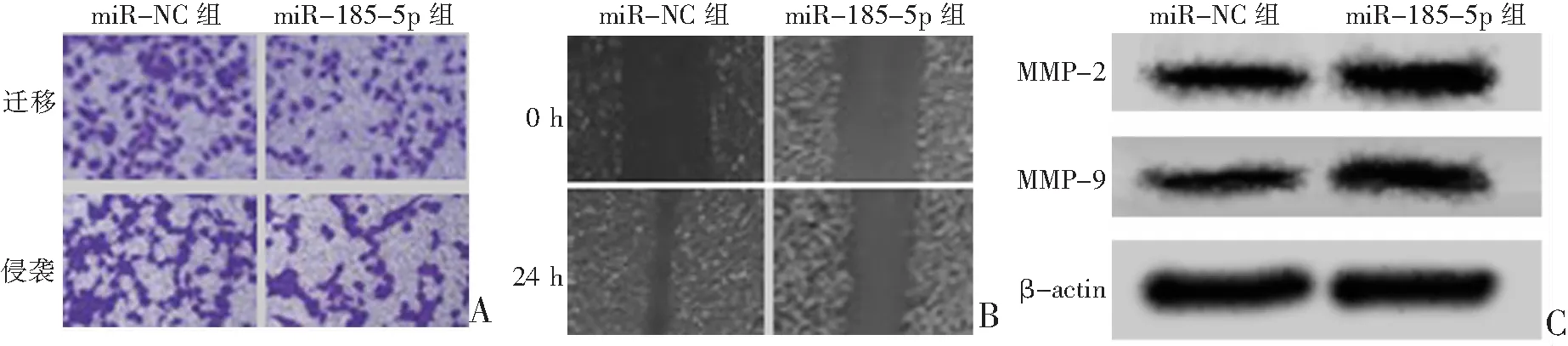
Starbase预测结果显示:miR-185-5p与AKR1C1之间存在连续的互补结合序列。见图2A。双荧光素酶报告实验结果显示:与miR-NC组比较,miR-185-5p组AKR1C1-WT细胞的荧光素酶活性显著降低(P<0.05)。见图2B。蛋白免疫印迹实验结果显示:与miR-NC组比较,miR-185-5p组细胞中AKR1C1蛋白表达显著降低(P<0.05);与anti-miR-NC组比较,anti-miR-185-5p组细胞中AKR1C1蛋白表达显著升高(P<0.05)。见图2C。
A:Starbase预测结果;B:双荧光素酶报告实验检测荧光素酶活性;C:蛋白免疫印迹实验检测AKR1C1蛋白表达;1为miR-NC组;2为miR-185-5p组;3为anti-miR-NC组;4为anti-miR-185-5p组;*P<0.05与miR-NC组比较;#P<0.05与anti-miR-NC组比较。
2.4 AKR1C1在肺癌组织和细胞系中的表达
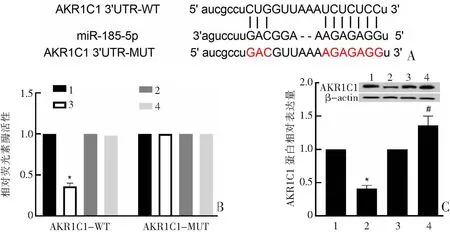
与癌旁组比较,肺癌组中AKR1C1 mRNA [(6.21±0.86)比(1.01±0.09),t=18.041,P<0.001]和蛋白表达[(1.87±0.19)比(0.99±0.10),t=12.296,P<0.001]均显著升高;与BEAS-2B组比较,A549组细胞中AKR1C1 mRNA [(3.78±0.52)比(1.00±0.09),t=15.804,P<0.001]和蛋白表达[(1.55±0.17)比(1.01±0.09),t=8.422,P<0.001]均显著升高。见图3。
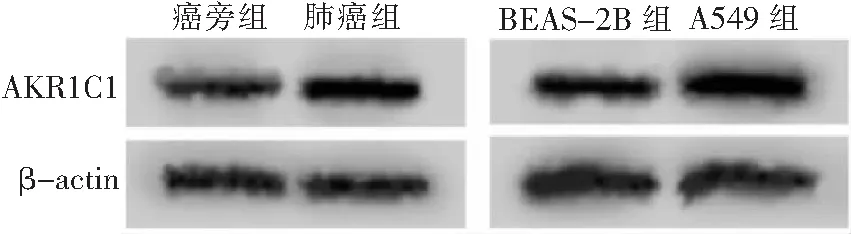
图3 蛋白免疫印迹法检测AKR1C1蛋白在肺癌组织和细胞系中的表达
2.5 过表达AKR1C1部分逆转过表达miR-185-5p对A549细胞迁移、侵袭的抑制
与miR-185-5p+pcDNA组比较,miR-185-5p+pcDNA-AKR1C1组A549细胞中miR-185-5p表达[(0.47±0.06)比(1.01±0.08),t=186.088,P<0.001]显著降低,迁移细胞数[(95±8)比(80±8),t=11.297,P<0.001]、侵袭细胞数[(71±8)比(50±6),t=30.640,P<0.001]及划痕愈合率[(83.15±8.86)%比(50.99±8.81)%,t=54.341,P<0.001]均显著升高;,MMP-2 [(1.38±0.17)比(0.99±0.10),t=26.171,P<0.001、MMP-9的蛋白表达[(1.66±0.09)比(0.98±0.04),t=84.991,P<0.001]均显著升高。见图4。

A:Transwell实验检测细胞迁移和侵袭;B:划痕实验检测细胞伤口愈合;C:蛋白免疫印迹检测蛋白表达;1为miR-185-5p组;2为miR-185-5p+pcDNA组;3为miR-185-5p+pcDNA-AKR1C1组。
3 讨论
miR-185-5p在多种人类癌症中发挥抗癌作用,但是其作用机制仍不明确。近期有研究[11]显示,miR-185-5p在NSCLC组织和细胞中表达失调,其通过靶向Rab鸟嘌呤三核苷酸磷酸酶家族成员(RAB35)参与癌细胞的增殖、迁移侵袭过程。CAO等[12]研究发现,在肺鳞癌中miR-185-5p不仅作为前列腺雄激素调节转录物1(lncRNA PART1)的下游靶点,还直接靶向下游的sineoculis同源框同源物1(Six1),调控肺鳞癌细胞的增殖、迁移、侵袭及凋亡,参与肺鳞癌的发生发展。LI等[13]发现,miR-185-5p作为长非编码RNA(LncRNAs)LINC00205的下游靶点,减弱LINC00205对肺腺癌增殖、迁移、侵袭及体内肿瘤生长的促进作用。本研究发现,miR-185-5p在肺癌组织和肺癌细胞系中的表达降低;过表达miR-185-5p可明显抑制肺癌细胞的迁移、侵袭及其相关基因MMP-2、MMP-9的蛋白表达。故本研究证实miR-185-5p作为抑癌因子在肺癌中发挥抗癌作用,这与前述研究报道相一致。同时,本研究还发现,miR-185-5p直接靶向AKR1C1,且负向调控肺癌细胞中AKR1C1蛋白的表达,这提示miR-185-5p抑制肺癌的作用可能与AKR1C1的表达有关。
AKR1C1及其家族成员参与肺癌的致癌物多环芳烃的代谢,因此长期烟草侵蚀会诱导肺组织中AKR1C1的表达,参与吸烟相关肺癌的发病,还在雄激素、孕酮等固醇类激素的代谢中发挥重要作用[14-15]。除与激素相关的卵巢癌、膀胱癌有关外,AKR1C1与肺癌的发展亦紧密相关[15]。ZHU等[16-17]报道,AKR1C1伴转移的NSCLC患者中的表达异常上调,且与患者发生肿瘤转移的风险和预后不良紧密相关;此外,AKR1C1的促肿瘤转移作用与其激活STAT3与JAK2之间的相互作用进而促进STAT3的反式激活紧密相关,而脱乙酰基酶Sirtuin 2(SIRT2)能够使AKR1C1脱乙酰基,抑制STAT3靶基因的反式激活,从而抑制细胞的迁移。HUANG等[18]发现AKR1C1是肺癌生存相关基因,在肺癌中高表达,沉默AKR1C1可明显抑制肺癌细胞的增殖、迁移、侵袭,促进铁死亡。本研究也发现肺癌组织和细胞系中AKR1C1的表达显著升高。而且,本研究还发现,过表达AKR1C1可部分逆转过表达miR-185-5p对肺癌细胞迁移、侵袭的抑制作用,这证实miR-185-5p抑制肺癌的作用是通过负性调控AKR1C1的表达来实现的。
综上,miR-185-5p可抑制肺癌细胞的迁移、侵袭,该作用可能与靶向调控AKR1C1有关。但是,本研究仅是基于细胞水平的研究,后续应从动物水平验证在肺癌中miR-185-5p与AKR1C1的关系及其作用。
