Salusinβ减轻内皮素-1诱导的大鼠离体心脏功能损伤
2023-01-13邵柯捷任安经
邵柯捷,任安经
(海军军医大学基础医学院a.学员五大队十三队2018级; b.基础医学实验教学中心,上海 200433)
Salusins蛋白由扭转应力障碍基因经选择性剪接后翻译而来,有salusinα(28个氨基酸)和salusinβ(20个氨基酸)2种形式[1-2]。Salusins广泛分布于骨髓、内分泌腺和脑等组织[3-4],具有降低血压、减慢心率和减少心输出量等作用[1,5-7]。笔者前期工作[8-9]发现,Salusins通过上调GRP78保护新生大鼠心肌细胞免受血清剥夺诱导的细胞死亡,表明其可通过降低内质网应激而减轻缺血-再灌注引起的心肌细胞损伤。此外,salusinβ可以抑制心肌细胞L型钙电流[10]和钠钙交换电流,增加瞬时外向钾通道电流和缩短动作电位时程[11]。
心肌缺血-再灌注损伤是Ca2+、K+、自由基、儿茶酚胺、内皮素-1(endothelin-1,ET-1)等多种内源性的化学介质共同参与并相互作用的结果。ET-1是一种作用强烈的缩血管活性物质,在心肌缺血-再灌注损伤中起着非常重要的作用[12-14]。心肌缺血时内源性ET-1合成和分泌增加,可收缩心脏冠状动脉从而加重心肌缺血[15];与此同时,由于内皮素A受体(endothelin receptor A,ETA)上调和血管内皮功能的障碍引起内皮素B受体(endothelin receptor B,ETB)所介导的舒血管反应减弱,冠状动脉对ET-1的缩血管反应增强。体内许多心血管活性物质之间存在相互作用,或协同、或拮抗。本研究以外源性ET-1诱导离体心脏灌流损伤为模型,观察salusinβ能否改善离体心脏的功能,旨在明确salusinβ对心肌的保护作用机制。
1 材料与方法
1.1 材料
SPF级8~10周龄雄性SD大鼠购自海军军医大学实验动物中心,体重280~350 g。Salusinβ和ET-1 1-21购自日本大阪肽研究所;其他盐类试剂均购自国药集团化学试剂有限公司。Langendorff灌流系统购自上海奥尔科特生物科技有限公司。Rm6240B型多道生物信号分析系统购自成都仪器厂。
1.2 方法
1.2.1 离体心脏灌流模型的构建
SD大鼠腹腔注射氨基甲酸乙酯(乌拉坦)1.0 g·kg-1麻醉,并注射300 U剂量的肝素抗凝,迅速开胸,取出心脏,置于4 ℃预冷的Krebs-Henseleit(KH)液中,分离大鼠主动脉,快速将主动脉结扎于Langendorff灌流装置上,经主动脉逆行以95% O2和5%CO2(V/V)混合气饱和的KH液恒温(37 ℃)恒压(8 kPa)灌注心脏。剪去部分左心耳后将一端扎有乳胶球囊的PE导管经左心房插入到左心室,球囊内充入少量水使左室舒张末压达到6 mmHg(1 mmHg=0.133 kPa),导管的另一端连接压力换能器,用Rm6240B型多道生物信号分析系统监测左室内压变化。操作完毕后预灌流15 min,待心脏状态稳定后开始正式实验。以0.5 nmol·L-1ET-1灌流10 min制备心肌损伤模型。
KH液成分(mmol·L-1):NaCl 118.0,KCl 4.7,MgSO41.2,KH2PO41.2,CaCl22.5,NaHCO325.0,Glucose 11.0。
1.2.2 实验分组及处理
18只雄性SD大鼠按照随机对照表法分为对照组、ET-1组和salusinβ+ET-1组,每组各6只。对照组:心脏平衡灌流20 min后继续用KH液灌流40 min。ET-1组:心脏平衡灌流20 min,0.5 nmol·L-1ET-1灌流10 min后继续用KH液灌流30 min。Salusinβ+ET-1组:心脏平衡灌流15 min,10 nmol·L-1salusinβ 灌流5 min,再以0.5 nmol·L-1ET-1灌流10 min后用KH液灌流30 min。
1.2.3 观察指标
从心脏开始平衡灌流到灌流结束期间记录心率(HR)和心功能指标,包括左室舒张末压(LVEDP)、左室收缩压(LVSP)和左室内压最大上升/下降速率(±dp/dtmax)。实验过程中每隔5 min收集1 min 的心脏流出液作为冠状动脉流量(CF),CF数值采用CF除以心脏湿重进行标准化。
1.2.4 统计学方法
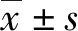
2 结果
2.1 各组HR的变化
以ET-1开始灌流为时间轴的0点,灌流之前3组各时间点的HR差异无统计学意义(均P>0.05),灌流后3组HR在灌流期间均保持相对恒定,各时间点差异均无统计学意义(均P>0.05)。见图1。
2.2 各组心功能的变化
以ET-1开始灌流为时间轴的0点,灌流之前3组LVSP、LVEDP、±dp/dt均无显著变化。与对照组比较,ET-1组ET灌流后LVSP、+dp/dt、-dp/dt急剧下降,灌流10 min后LVSP、+dp/dt、-dp/dt分别为(61.65±6.17)mmHg、(1138±48)mmHg·s-1和(818±57)mmHg·s-1。与ET-1组比较,Salusinβ+ET-1组给予ET-1 10 min后LVSP、+dp/dt、-dp/dt分别为(90.89±7.44)mmHg、(1573±89)mmHg·s-1和(1178±78)mmHg·s-1,均显著高于ET-1组(均P<0.05)。ET-1组KH灌流后LVSP、±dp/dt有所回升,但LVSP于30 min前、+dp/dt于35 min前、-dp/dt于15 min前仍明显低于salusinβ+ET-1组。各组LVEDP保持在6 mmHg左右,灌流后期略有上升,但差异均无统计学意义(均P>0.05)。见图2。
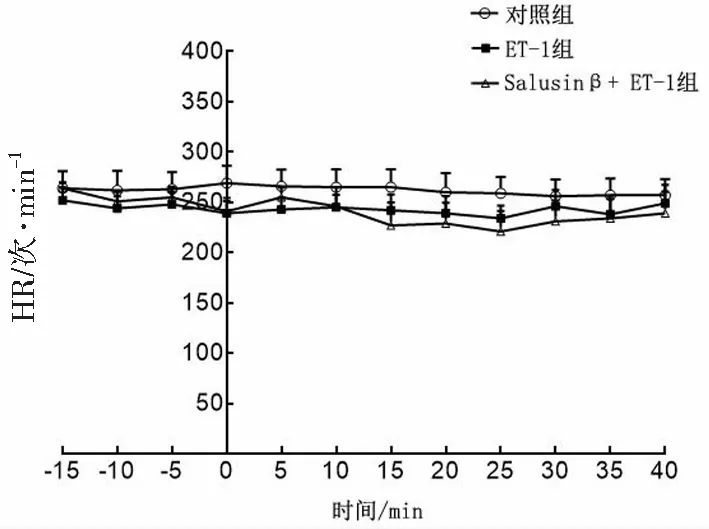
图1 3组离体灌流大鼠心脏HR变化
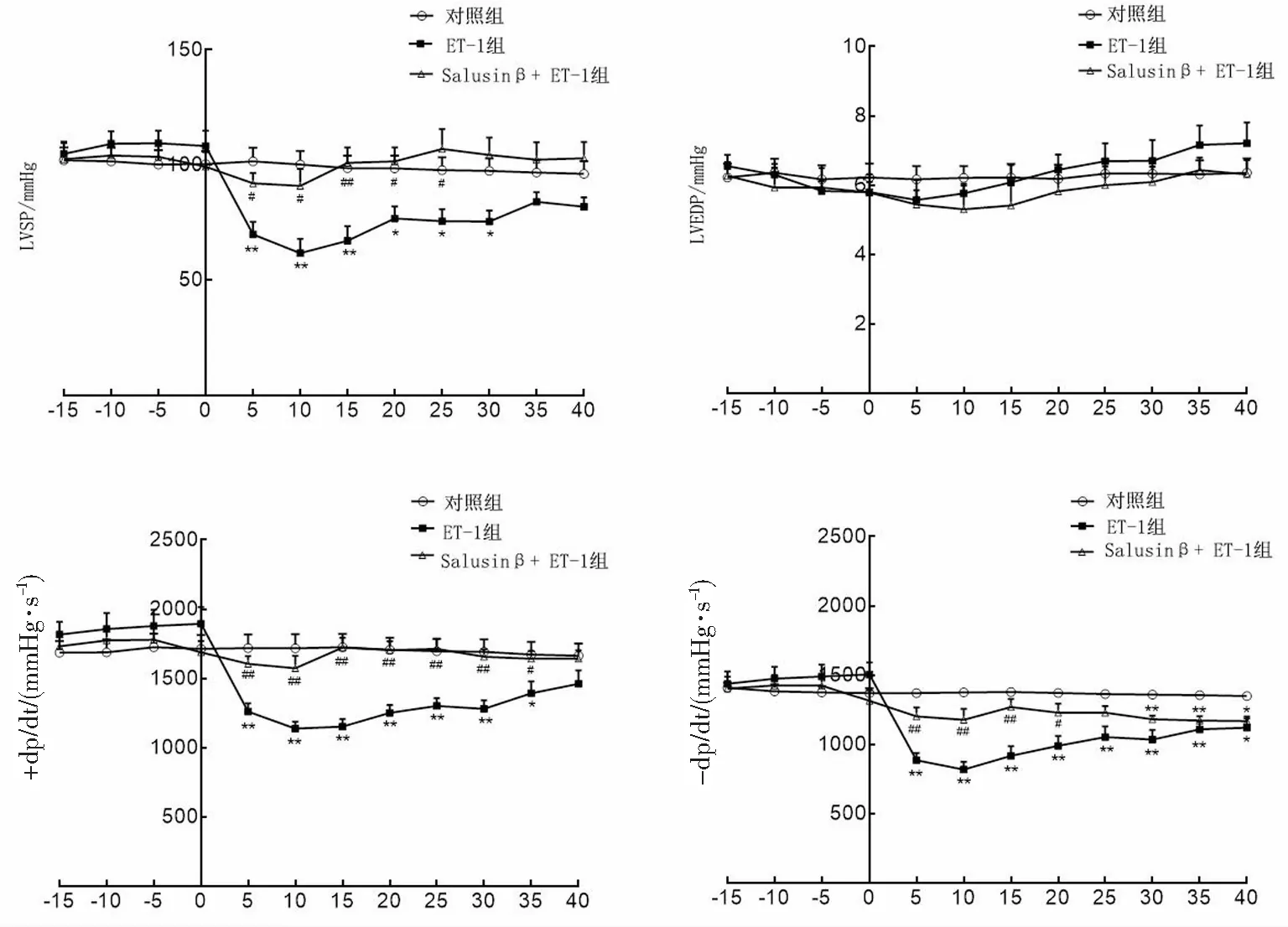
*P<0.05、**P<0.01与对照组比较;#P<0.05、##P<0.01与ET-1组比较。图2 各组离体灌流大鼠心脏心功能的变化
2.3 各组CF的变化
以ET-1开始灌流为时间轴的0点,灌流之前3组CF无显著变化。ET-1组灌流后CF急剧下降,ET-1灌流后5、10、15 min CF分别为(7.1±0.5)mL、(5.9±0.4)mL和(5.8±0.4)mL;KH液灌流后CF有所上升,但仍明显低于对照组(均P<0.01)。与对照组比较,Salusinβ+ET-1组灌流后CF均下降,但ET-1灌流后5、10、15 min CF分别为(10.1±0.3)mL、(9.1±0.4)mL、(9.4±0.5)mL,显著高于ET-1组(均P<0.01),而灌流20 min后ET-1组和salusinβ+ET-1组CF差异无统计学意义(均P>0.05)。见图3。
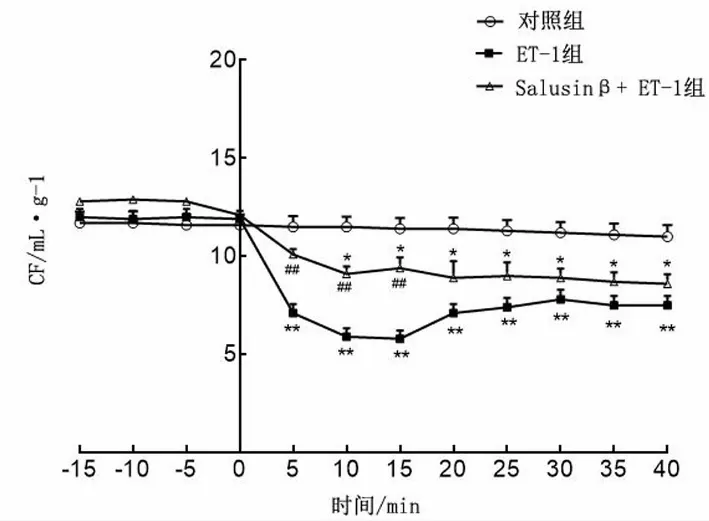
*P<0.05、**P<0.01与对照组比较;##P<0.01与ET-1组比较。
3 讨论
在本实验模型中,0.5 nmol·L-1ET-1灌流10 min 引起LVSP、±dp/dt等反映心功能的指标明显降低,而salusinβ预处理明显缩小ET-1灌流引起的这些指标的降低幅度,提示salusinβ可以拮抗ET-1对心功能的抑制。值的注意的是,本研究ET-1组心率并未见明显下降,提示0.5 nmol·L-1的ET-1对心率无明显影响。
有文献[16-22]报道ETA受体特异性拮抗剂BQ610和BQ123、ET受体非特异性拮抗剂bosentan和TAK044以及ET单克隆抗体均可减轻整体或离体动物缺血-再灌注损伤,表明内源性ET-1具有引起心肌缺血-再灌注损伤的作用。另有研究[23-24]显示,低剂量(1~30 pmol·L-1)ET-1对大鼠离体心脏具有正性肌力作用[23],而较大剂量ET-1(30~90 pmol·L-1)对豚鼠离体心脏首先表现为短暂的正性肌力作用,随后出现持续的负性肌力作用[24]。也有研究[25]报道较大剂量ET-1对离体心脏产生负性肌力作用。本研究采用0.5 nmol·L-1ET-1灌流离体心脏,观察到其可使大鼠离体心脏收缩和舒张功能下降。较大剂量ET-1引起离体灌流心脏负性心肌作用的机理较为复杂。一方面,ET具有较强的收缩冠状动脉血管的作用,故可导致心肌因缺血、缺氧而使心室舒张不全,充盈不足,进而产生负性肌力作用。另一方面,ET可不依赖于血管收缩,直接对心肌产生损伤作用和致心律失常作用[26]。
笔者前期工作[9]发现在结扎大鼠冠状动脉前降支引起心肌缺血导致的心肌梗死模型中,salusinβ预处理可显著减轻冠状动脉结扎引起的心肌梗死面积,其机制是减轻内质网应激。为进一步研究salusinβ改善缺血引起心功能降低的作用,本研究以离体灌流心脏为模型,利用ET-1灌流引起冠状动脉流量急剧下降而导致心肌缺血,发现salusinβ+ET-1组LVSP、±dp/dt等反映心功能的指标显著高于ET-1组,而且冠状动脉流量也显著高于ET-1组,说明salusinβ预处理显著减轻高剂量ET-1灌流引起的冠状动脉收缩,这可能是salusinβ减轻ET-1的心肌损伤作用的重要原因。CAKIR等[27]报道salusinβ具有减轻缺血-再灌注引起的肾脏损伤的作用,其机制是增强超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,降低丙二醛、肿瘤坏死因子α、白介素6的水平。Salusinβ对ET-1引起的心功能损伤的保护作用是否也存在类似的的机制,有待进一步探讨。此外,salusinβ的受体是G蛋白偶联受体[28],而ETA和ETB受体也均是G蛋白偶联受体。因此,ET与平滑肌细胞ETA和ETB结合可引起血管收缩,而salusinβ是否可能与平滑肌细胞ETA和ETB结合从而降低ET-1与ETA和ETB受体的结合能力,进而降低血管收缩程度,减轻心肌缺血,改善ET的心功能抑制作用,这值得进一步研究。
