六月雪对糖尿病肾病大鼠肾脏的保护作用研究
2023-01-12郑艳辉田海军
俞 燕,郑艳辉,田海军
(1.南京中医药大学,江苏 南京 210023;2.南京中医药大学附属南京中医院,江苏 南京 210001)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病(Diabetes mellitus,DM)的慢性微血管并发症之一,是一种慢性进行性肾脏疾病,最终将导致终末期肾损伤的发生[1]。在全球范围内,DM的患病率约为9.3%,我国DM患者约1.16亿,其中可能发展为DN的概率约为40%[2]。有研究[3]表明,我国DN的发病率逐年上升,现已成为慢性肾脏病(Chronic kidney disease,CKD)的最主要病因。现代医学方面,DN的治疗措施主要有控制血压及血糖、调节血脂、减少尿蛋白等[4],但临床疗效有限,且有一定的使用限制及不良反应,而中医药在肾脏疾病的治疗方面有更加广泛的应用范围,极有可能成为更有效的治疗手段,也是中医药治疗的优势。中草药六月雪[Serissa serissoides (DC.) Druce,SSD]在临床上可应用于多种肾脏病,包括慢性肾功能衰竭、慢性肾小球肾炎、糖尿病肾病、肾病综合征等。本研究以Sprague-Dawley(SD)大鼠建立DN模型,探讨六月雪对糖尿病肾病的作用和可能机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:雄性SD大鼠30只,SPF级,4~6周龄,购自南通大学[许可证号:SCXK(苏)2019-0001]。
1.1.2 实验药物:中药六月雪,购自南京市中医院中草药房,制成0.27 g/ml的药液后浓缩10倍。链脲佐菌素(STZ,美国Sigma公司)。
1.1.3 主要实验试剂与仪器:盐酸、过碘酸、二甲苯、醋酸钠、无水乙醇、中性树胶(国药集团化学试剂有限公司)。苏木素染液、0.5%伊红液、Schiff氏液、哈瑞苏木精(南京恩晶生物科技有限公司)。尿蛋白定量测试盒、肌酐(Scr)测试盒、尿素氮(BUN)测试盒(南京建成生物工程研究所)。HEA-230血糖仪、血糖试纸(日本OMRON公司)。5415R型离心机(德国 Eppendorf公司)。日立 OLYMPUS生化分析仪(南京三和公司)。Multiskan Mk酶标仪(美国Thermo公司)。生物组织自动脱水机(Leica ASP6025,上海三威医疗设备有限公司)。病理取材台(博科QCT-1500) 、烤片机(博科BH-1)(济南来宝医疗器械有限公司)。组织包埋机(LEICA Arcadia)、石蜡切片机(LEICA RM22235)、多功能染色机(Autostainer XL Leica)(徕卡显微系统(上海)贸易有限公司)。显微镜(ZEISS AX110,广州市高明生物技术有限公司)。
1.2 实验方法
1.2.1 大鼠分组与模型制备:将30只4~6周龄、雄性、健康SD大鼠随机分成三组,分别为正常组、模型组和六月雪组,每组10只。按55 mg/kg的剂量在大鼠左侧腹腔一次性注射1%STZ溶液,正常组大鼠则用等剂量的0.9%氯化钠溶液以同种方法进行腹腔注射。大鼠进行STZ注射后,连续测3 d随机血糖,血糖>16.7 mmol/L为 DM 模型制备成功。造模成功后的DM模型大鼠喂养1周,测随机血糖>16.7 mmol/L,尿量为正常组的1.5倍及以上,24 h尿蛋白定量(24 h-UP)为正常组的1.5倍及以上,则为DN模型制备成功。
1.2.2 给药方法:以灌胃的方式进行给药,给药体积为0.1 ml/10 g,每天给药1次,连续给药6周。给药期间,给予各组大鼠标准饮食,定期更换垫料及消毒笼具。
1.2.3 生化指标检测:药物干预6周后,检测各组大鼠的空腹血糖(FBG),收集24 h尿液,检测24 h尿蛋白(24 h-UP)含量。大鼠脱颈椎处死,腹主动脉取血,离心后收集血清,使用生化分析仪测定血清中BUN及Scr的水平。
1.2.4 肾脏病理组织观察:大鼠处死后,取两侧肾脏,去除被膜,0.9%氯化钠溶液灌洗肾脏血管,清除残留血液,滤纸干燥。取一半肾组织,经固定、脱水、包埋、切片等步骤制作组织切片,进行HE染色和PAS染色,光镜下观察肾组织病理,并进行病理评分[5],将分数累加,计算每组每只动物的均分。
1.2.5 大鼠肾脏组织TGF-β1、IL-6表达水平测定:取另一半肾组织,-20 ℃低温保存,采用ELISA法检测肾组织中转化生长因子-β1(Transforming growth factor β1,TGF-β1)及炎性细胞因子白介素-6 (Interleukin-6,IL-6)的水平。
1.3 统计学方法 采用SPSS 22.0统计学软件进行分析。实验数据以均数±标准差表示,符合正态分布和方差齐性的,采用方差分析,不符合正态分布和方差齐性则采用非参数秩和检验;P<0.05为差异有统计学意义。
2 结 果
2.1 六月雪对各组大鼠FBG及肾功能的影响 与正常组比较,模型组大鼠FBG、Scr、BUN及24 h-UP升高 (P<0.01);与模型组比较,六月雪组大鼠FBG、Scr、BUN及24 h-UP有所降低 (P<0.01),见表1。

表1 六月雪对各组大鼠FBG、肾功能及尿蛋白的影响
2.2 六月雪对各组大鼠肾脏病理组织形态的影响
2.2.1 HE染色结果:①正常组:肾小球内细胞数无增多,毛细血管无淤血,系膜基质无增生,球囊腔明显可见,肾小管上皮细胞无明显变性、坏死、管型,间质无炎细胞浸润,无结缔组织增生。②模型组:肾小球内细胞数增多,毛细血管扩张,系膜基质增生,球囊腔扩大,肾小管上皮细胞重度变性坏死,腔增大,腔内见大量透明管型,间质少量炎性细胞浸润,无纤维组织增生。③六月雪组:肾脏组织形态学改变基本同模型组,间质有少量单个核炎细胞浸润,病变程度轻于模型组。各组病理评分的比较:与正常组比较,模型组的病理评分显著升高(P<0.01);与模型组比较,六月雪组的病理评分显著降低(P<0.01)。见图1(表2)。

图1 各组大鼠肾组织病理形态学改变(HE染色,×400;PAS染色,×400)

表2 六月雪对各组大鼠肾脏组织病理评分的影响(分)
2.2.2 PAS染色结果:①正常组:肾小球毛细血管基底膜,系膜基质和肾小管基底膜着玫瑰红色,基底膜未见增厚,系膜基质未见增多。②模型组:肾小球毛细血管基底膜,系膜基质和肾小管基底膜着玫瑰红色,基底膜增厚,系膜基质增多。③六月雪组:肾小球毛细血管基底膜,系膜基质和肾小管基底膜着玫瑰红色,基底膜增厚,系膜基质增多。见图1。
综上,结合各组病理组织形态的差异和病理评分的变化,认为六月雪对糖尿病肾病大鼠的肾脏损伤具有一定保护和修复作用。
2.3 六月雪对糖尿病肾病大鼠TGF-β1及IL-6含量的影响 见表3。与正常组比较,模型组TGF-β1及IL-6水平均显著提高(P<0.01);与模型组比较,六月雪组TGF-β1及IL-6水平均有所降低(P<0.05)。
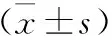
表3 六月雪对糖尿病肾病大鼠TGF-β1及IL-6表达水平的影响
3 讨 论
糖尿病肾病是糖尿病的一种慢性并发症,临床上常见且发病率逐年增高,与糖尿病相关的肾小球损伤和蛋白尿导致了肾小管间质病变,常见持续性蛋白尿、水肿、高血压、肾功能损害等症状,最终可发展为终末期肾病(End-stage renal disease,ESRD)[6],预后较差。早期DN的主要病理表现是以肾小球肥大、肾小球和肾小管基底膜增厚以及系膜区细胞外基质的进行性积聚为特征,后期则表现为肾小球及肾小管间质纤维化[7]。
DN的致病机制是复杂且多样的,涉及多种途径和介质,氧化应激是DN重要的发病机制之一。高血糖状态会导致活性氧(Reactive oxygen species,ROS)和氧化自由基的产生增加,而ROS 的增加又会引发炎症、血管内皮异常、TGF-β1表达增加,从而诱导肾纤维化的发生[8]。TGF-β1是一种多功能细胞因子,参与了DN的发病与发展[9]。TGF-β的表达上调可能是发生肾小球硬化及肾纤维化的重要因素[10-11],它主要是通过磷酸化和激活Smad2和Smad3,介导了肾小球和小管间质纤维化[12]。另外,TGF-β促进了肾细胞及成纤维细胞外基质蛋白分子的合成,细胞外基质池不断积聚,最终导致肾小球硬化[11]。江丹等[13]研究发现,减少TGF-β1的mRNA及蛋白表达,可改善DM大鼠的早期肾脏病理改变,减轻肾脏损害,保护肾功能。段颖等[14]通过动物实验得出,肾组织中TGF-β1蛋白表达的下调能够改善db/db小鼠糖尿病肾病的肾脏纤维化,从而达到保护肾脏的目的。
炎症反应在DN的疾病演变中起着至关重要的作用,炎症可改变组织稳态,刺激多种细胞炎症因子的释放,这些细胞因子更促进了炎症免疫反应的进展[15-16]。IL-6是机体的免疫炎症反应的重要环节,与肾脏损伤关系密切。相关研究[17]表明,肾小球基底膜增厚、肾小球系膜细胞增殖、肾小球上皮细胞通透性异常增高及间质纤维化均与IL-6有关。有临床研究发现,DN患者肾组织中有IL-6相关mRNA的表达,在系膜增生区和肾小管萎缩区最为明显,这证实了IL-6与DN的系膜增生和间质损伤程度有关[18]。高大红[19]对服用血府逐瘀胶囊的糖尿病肾病患者进行观察,发现治疗组IL-6、TGF-β1等炎症因子水平明显降低,患者的实验室指标有改善,临床症状也得到缓解。
根据DN的疾病特点,可将其归属于中医学的 “肾消” “消渴肾病”“水肿”“癃闭”“关格”等范畴。中医学认为,DN由消渴病发展而来,病性为本虚标实、虚实夹杂,大多以消渴之阴虚燥热为基础,随疾病进展,累及到脾肾,致使脾失健运,肾失气化,气血不足,湿浊内生,进而产生血瘀、浊毒、湿热等病理产物,并使病情进一步加重[20]。
六月雪是茜草科植物六月雪的干燥全草[21],有白马骨、满天星等别称,《本草拾遗》中记载:味苦、微甘,性凉,具有健脾除湿、清热解毒、消肿止痛、凉血活血等功效[22]。针对DN的病因病机,六月雪既可活血通络消癥,又可引导湿浊之邪从小便而解,清利湿热、化浊解毒。现代药理研究发现,六月雪有抗氧化、抗菌解热、抗肝炎、抗肿瘤、保护胃黏膜等作用[23]。孙响波等[24]通过总结后发现,六月雪有降低Scr、BUN、减少蛋白尿的作用。齐墩果酸是六月雪的有效成分,是一种五环三萜类化合物。有研究表明齐墩果酸可能通过调节TGF-β/Smad途径抑制了肾脏纤维化,达到保护肾脏的作用。另一种有效成分熊果酸,也被证明有保护肾功能、降低尿蛋白、减轻肾损害等作用[26]。但是六月雪对DN的作用及可能机制仍需进一步探索。
本研究以STZ诱导DN大鼠模型的建立,观察六月雪对DN大鼠的多项指标及肾脏组织的影响。采用STZ腹腔注射SD大鼠后,大鼠出现血糖升高、蛋白尿及肾功能异常,这些表现是DN的典型临床症状,光镜下观察肾脏病理切片示肾小球毛细血管基底膜增厚等病理变化,依据Mogensen标准,该病理表现符合DN早期诊断,表明造模成功,进行后续实验步骤。药物干预结束后,与模型组比较,六月雪组大鼠的FBG、Scr、BUN及24 h-UP均得到改善,肾组织病变程度也有所减轻,病理评分下降,肾脏组织中TGF-β1及IL-6的水平降低。因此,本实验证实了六月雪对DN的肾脏损伤有保护作用,并推测,六月雪可能通过抑制TGF-β1及IL-6的表达,减轻肾脏炎症反应及氧化应激,抑制肾脏的基底膜增厚、系膜增生及纤维化等病理改变,进而发挥对肾脏的保护作用,改善肾功能,减少蛋白尿,并在一定程度上可修复肾组织,延缓DN的持续发展。
本次实验结果为六月雪应用于肾脏病的临床治疗提供了一定依据,但也存在一些不足,一是在临床使用上,六月雪常与多种药物配伍成方,而本实验以六月雪单味药进行研究,较为局限。二是本次实验选用的指标有限,未对六月雪药理作用的信号通路进行更深入的研究。这些不足需要进一步的实验以弥补。
综上所述,六月雪对DN模型大鼠的肾脏有保护作用,能够改善肾功能、减少蛋白尿,减轻肾脏的病理改变,其作用机制可能与肾组织中TGF-β1、IL-6表达的降低相关,从而抑制了肾脏炎症反应及氧化应激,达到了保护肾脏的作用,延缓DN进展至ESRD。
