玉米ZmLEA34基因的分子特性、克隆和响应干旱胁迫的表达分析
2023-01-12张前进曹丽茹马晨晨庞芸芸叶飞宇鲁晓民
张前进,曹丽茹,马晨晨,庞芸芸,叶飞宇,鲁晓民
玉米基因的分子特性、克隆和响应干旱胁迫的表达分析
张前进,曹丽茹,马晨晨,庞芸芸,叶飞宇,鲁晓民*
河南省农业科学院粮食作物研究所, 河南 郑州 450002
胚胎发育晚期丰富蛋白是一类富集在种子胚发育后期的脱水保护蛋白,在抵御干旱、高盐等逆境胁迫中发挥着重要的作用。本文克隆了一个胚胎发育晚期丰富蛋白基因,该基因含有876 bp的开放阅读框,编码了291个氨基酸,属于亲水性蛋白。蛋白进化树分析,发现ZmLEA34蛋白与高粱的同源关系最近,且同一位置具有相同的保守基序;顺式作用元件分析,发现该基因含有多个响应逆境胁迫、植物激素信号转导、光信号等结合位点;qRT-PCR实验结果表明,基因属于组成型表达基因,在胚、根、叶中表达量较高,基因在根和叶中受干旱胁迫的诱导显著上调表达,且抗旱玉米自交系郑36中的表达量始终高于B73,推测该基因其表达量与材料的耐旱性呈显著正相关。研究结果为进一步揭示基因的作用机制奠定基础。
玉米; 组成型表达; 抗旱性
玉米(.L)是世界上主要的粮食作物之一,种植面积比较广泛,其产量居各粮食作物之首[1]。但随着自然灾害的频繁发生,对玉米产量造成了不小的损失,尤其是干旱胁迫[2]。我国是农业大国,玉米是我国十分重要的粮食作物、饲料作物和工业原料,但大部分玉米主产区存在水资源短缺严重、蒸发量较大等的问题,再加上极端干旱天气频发,导致玉米减问题日益突出。因此,对玉米抗旱机理的分子研究,来提高玉米的产量和保障粮食安全具有十分重要的现实意义。
植物胚胎发育晚期丰富蛋白(late embryogenesis abundant proteins,LEA)是一类庞大、多样化的蛋白,主要定位在细胞核、细胞质和线粒体中[3]。在棉花胚胎发育后期的子叶中LEA蛋白首次被发现,之后在玉米[4]、拟南芥[5]、水稻[6]、小麦[7]等植物中同样发现了LEA蛋白的存在,发现LEA蛋白在维持植物正常生长发育和响应非生物胁迫中发挥着十分重要作用。基因可被脱落酸和各种非生物胁迫等如干旱,渗透胁迫等的诱导表达。在玉米中ZmLEA3蛋白在渗透和氧化胁迫下通过保护蛋白质结构和结合金属来保护植物免受伤害[8];编码了一个LEA家族蛋白,是一种正向抗旱性的调控因子,的过表达增加了ABA的敏感性,增强了水稻耐旱性[9];过表达提高了转基因水稻的抗旱能力和耐盐性[10]。过表达OsLEA3-2蛋白能改善盐和干旱条件下转基因拟南芥和水稻的生长[11];在大豆中LEA蛋白基因积极响应盐和渗透胁迫,研究发现该基因在拟南芥中过表达增强了转基因植株对盐和渗透胁迫的耐受能力[12]。
植物在面临干旱胁迫时体内的生理生化指标会发生一定的变化,而抗氧化反应是干旱胁迫最终的反应之一,在干旱胁迫下作物体内会产生大量的活性氧(ROS),活性氧的积累使细胞受到严重的伤害,从而导致代谢功能紊乱[13]。目前,在干旱胁迫等逆境中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等酶活性的变化在植物中已经被广泛作为生理生化指标[14]。在相关研究中,发现水分胁迫下玉米的抗旱性与SOD、POD、CAT等保护酶的活性呈现显著正相关,且抗旱性强的品种中SOD、POD、CAT等保护酶的活性较高[15];干旱胁迫下小麦干物质积累量降低,抗氧化酶活性随着干旱程度的增强而增加[16];和的表达水平随着小麦干旱条件的变化而发生改变尤其在严重干旱时表达量显著增强[17]。
本文利用实验室前期转录组分析结果,发现基因在正常生长条件和干旱胁迫下相对表达量差异达到极显著的水平。对基因的生物信息学进行预测,并从玉米中克隆了基因的开放阅读框,对ATG前2 000 bp启动子元件进行分析,通过荧光定量PCR分析该基因在各组织中的表达情况以及非生物胁迫下的表达模式进行分析,发现该基因积极响应干旱胁迫。该研究结果为进一步对玉米的抗旱机制的探究奠定了分子基础,也为抗逆育种提供了新思路。
1 材料与方法
1.1 实验材料与处理
利用郑36和B73两个自交系作为实验材料,挑选出籽粒饱满的种子种植在营养土中,并用Hoagland's营养液浇灌,在培养箱中培养(光照培养30 ℃,16 h;黑暗培养26 ℃,8 h;相对湿度约35%~55%)。当玉米苗长至三叶一心时,开始对长势一致的玉米进行20% PEG-6 000胁迫处理,分别对胁迫0 h、4 h、8 h、12 h、24 h、48 h、72 h的玉米苗的根和叶随机进行取样,每3个样品等量混合作为1个重复,各取3个重复;对正常生长和20% PEG-6 000胁迫5 d的叶片进行取样,每5株为1个样品,取6个生物学重复,分别用于进行转录组测序分析和生理生化指标的测定,将样品迅速放入液氮中,并在-80 ℃超低温冰箱中保存。以及对郑36的根、茎、叶、雄穗、雌穗、胚、胚乳组织进行取样,对基因的不同组织进行特异性的表达分析。
1.2 ZmLEA34基因的克隆
利用NCBI网站BLAST基因()的CDS序列,设计特异性引物(ZmLEA34-F:CCAGCGGTGATCTGTAGTAGC;ZmLEA34-R:CTTCAGAGTCCAGGACACGC)对基因进行扩增,并将扩增的产物与T载进行连接,转化DH5α大肠杆菌感受态细胞,挑出阳性单克隆(不少于5个)送到华大测序公司进行测序,测序的结果与Maize GDB数据库进行序列比对。
1.3 ZmLEA34基因的生物信息分析
利用ExPASy ProtParam 软件在线分析ZmLEA34蛋白质的分子量、等电点、稳定性和疏水性等;利用TMHMM分析跨膜螺旋区;利用SOPMA进行蛋白质二级结构预测;利用NetPhoS在线预测蛋白磷酸化位点;利用BLASTP对ZmLEA34蛋白的其他物种同源序列进行搜索,DNAMAN进行序列比对,软件MEGA6.1构建系统进化树;利用MEME分析蛋白的保守基序进行,最大基序值设置为10;利用PlantCARE对启动子元件进行分析。
1.4 RNA的提取、反转录和qRT-PCR数据处理
利用RNA提取试剂盒(EasyPure RNA Purification Kit)抽提玉米的总RNA,用cDNA反转录试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)将RNA反转录成cDNA,并放在-20 ℃冰箱中储存备用。根据基因序列设计荧光定量引物(ZmLEA34-F:GAGACGAGGACAAGGCCAC;ZmLEA34-R:TCGTTCCTGTTGCGGTTCTC),并利用玉米18S(18S-F:CCTGCGGCTTAATTGACTC;18S-R:GTTAGCAGGCTGAGGTCTGG)作为内参,利用荧光定量试剂盒(SYBR Premix Ex Taq TM)上的实验操作在CFX96实时荧光定量 PCR仪进行qRT-PCR分析,每个样品3次重复,相对表达量利用2^-△△Ct法进行计算。
1.5 生理生化指标的测定方法
超氧化物歧化酶SOD活性利用氮蓝四唑法测定;过氧化物酶POD活性利用愈创木酚法测定;过氧化氢酶CAT的活性利用紫外吸收法测定。
2 结果与分析
2.1 干旱胁迫下不同玉米生理生化指标的测定
前人研究中,发现干旱胁迫下玉米的抗旱性与抗氧化酶的活性呈正相关。本研究利用郑36和B73两个自交系为实验材料,在苗期时进行干旱胁迫,对抗氧化酶活性进行测定。发现干旱胁迫后这两个材料的超氧化物歧化酶(SOD)活性、过氧化物歧化酶(POD)活性和过氧化氢酶(CAT)的活性均显著提高(图1),但郑36抗氧化酶活性提高幅度远高于B73,说明郑36抗旱能力比B73强。
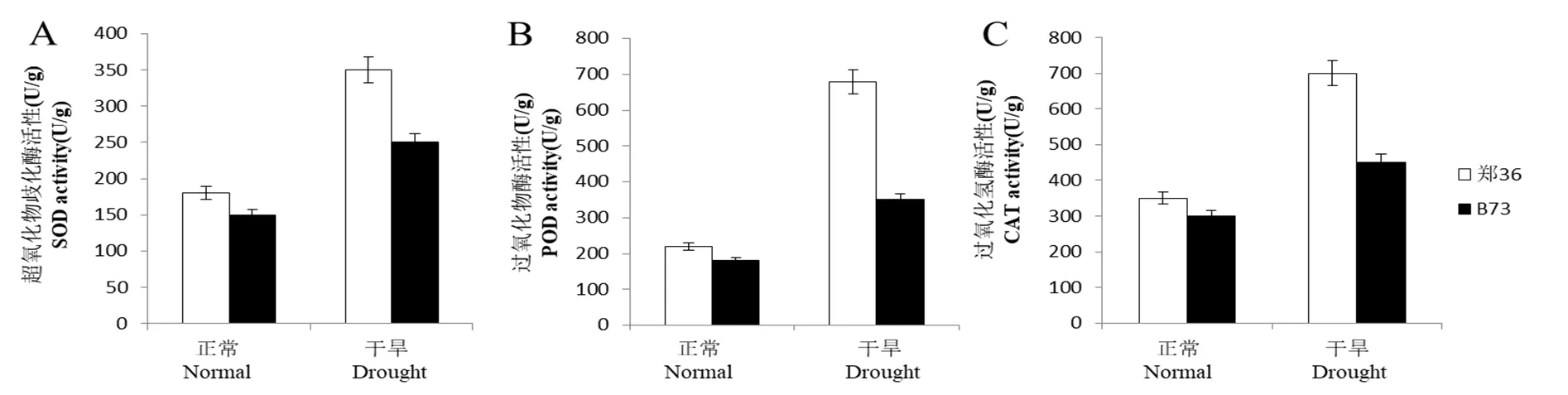
图1 干旱胁迫下ZmLEA34基因生理指标测定
2.2 ZmLEA34基因的鉴定
实验室前期对玉米三叶期幼苗进行干旱胁迫处理,取玉米叶片进行转录组测序,并分析基因的FPKM值和功能注释,发现基因在正常生长条件和干旱胁迫下差异达到极显著的水平。另对玉米叶片中基因进行qRT-PCR分析,发现该基因在干旱胁迫后相对表达量显著提高,这与转录组测序的结果是一致的(图2),因此表明了基因在玉米响应干旱胁迫过程中发挥着十分重要的作用。
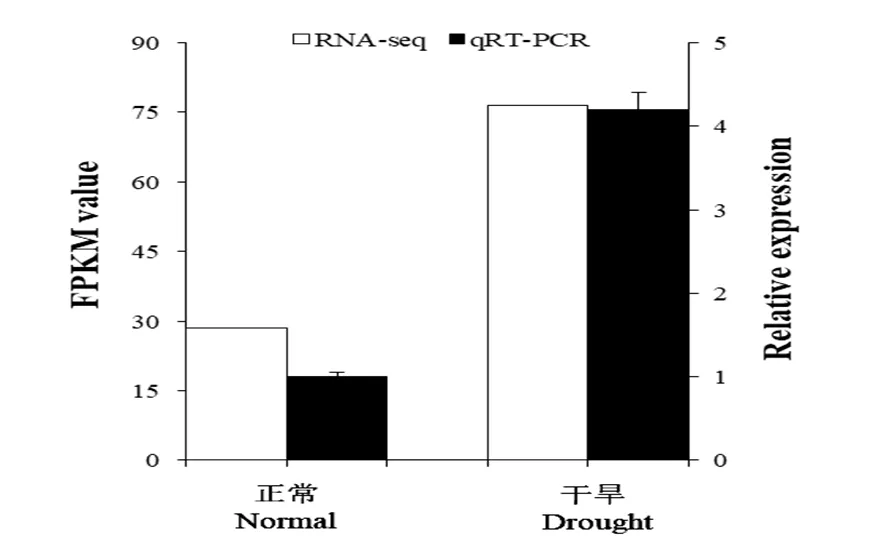
图2 ZmLEA34基因的qRT-PCR
RPKM:每百万个比对上的reads中比对到外显子的每1 000个碱基上的片段个数
RPKM: Number of fragments per 1 000 bases of an exon matched in reads per million alignments
2.3 ZmLEA34基因的克隆
利用RT-PCR实验技术对基因进行扩增,利用1%的琼脂糖凝胶电泳得到了一条大小约为900 bp的条带(图3)。通过条带回收和连接载体,并挑选出阳性的单克隆,将菌液送到测序公司进行测序。对测序结果进行分析,发现这个序列是一个完整的876 bp的开放阅读框,编码了291个氨基酸,这与B73的序列是一致的。
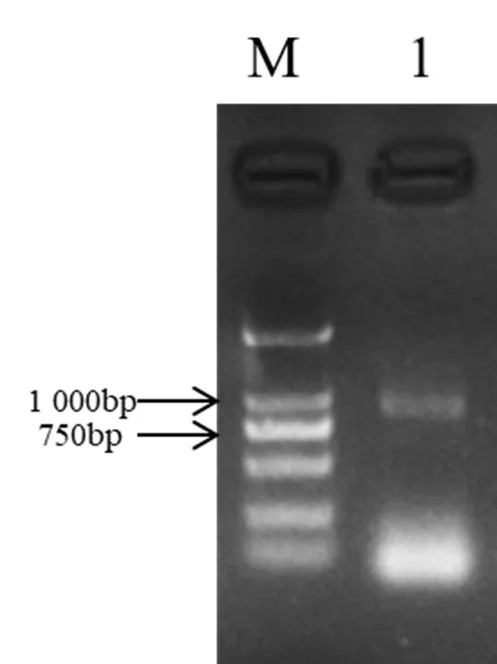
图3 ZmLEA34基因PCR扩增电泳结果
M. 2 000 bp DNA Marker; 1.
2.4 ZmLEA34基因的生物信息学分析
利用ExPASy ProtParam软件对蛋白结构进行分析,发现ZmLEA34的相对分子质量约为28.41kDa,理论等电点为4.51,分子式为C1 196H1 923N373O42S5;不稳定系数为32.77,属于稳定性蛋白;脂肪系数为70.76;利用ProtScale在线分析GRAVY值大小为-0.209,属于亲水性蛋白;通过对PHD跨膜螺旋区进行分析,发现该蛋白无跨膜结构域,不是跨膜蛋白;利用SOPMA对蛋白结构进行预测,显示该蛋白无规则卷曲占比45.02%,α螺旋占40.21%,β折叠占6.78%,主要以无规则卷曲为主(表1)。NetPhoS在线分析显示ZmLEA34蛋白包含5个丝氨酸和7个苏氨酸位点,表明该蛋白很有可能被丝氨酸和苏氨酸激酶激活,调控其响应基因,参与植物生长发育过程、逆境胁迫过程等。

表1 蛋白质结构分析
2.5 玉米ZmLEA34蛋白进化树分析
利用BLAST在线软件对ZmLEA34蛋白的同源序列进行搜索,选择同源性较高的其他物种的蛋白序列。利用MEGA软件构建系统进化树,发现玉米ZmLEA34蛋白与高粱的同源关系最近,同源度高达95%,其次是芒草、洋槐,与狗尾草和画眉草亲缘关系较远(图4)。为了进一步对ZmLEA34蛋白和同源蛋白的保守性进行分析,利用在线软件MEME对10个保守基序进行鉴定,发现玉米不仅与高粱的同源性高,而且在氨基酸相同位置含有相同的保守基序,说明了物种之间的同源性越高,保守基序就越相似,之间的关系也就越亲近。
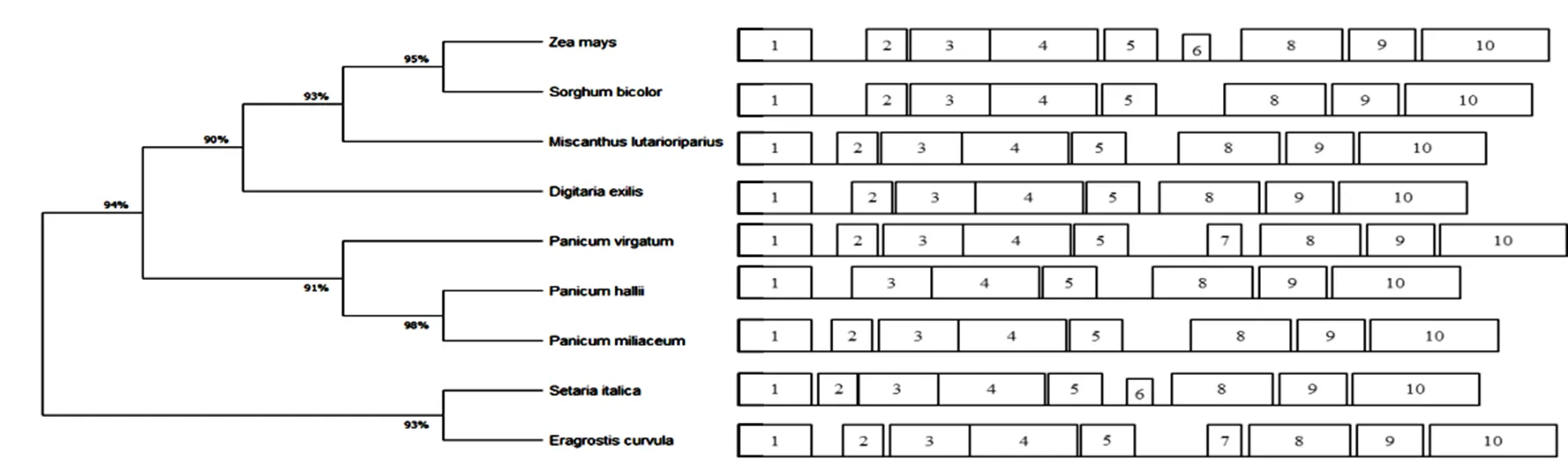
图4 ZmLEA34蛋白与其他物种同源蛋白的进化树及保守基序分析
2.6 ZmLEA34基因启动子元件分析
为了进一步探究基因潜在的调控机制,利用Plantcare分析基因启动子区域2 000 bp进行顺式元件调控分析(表2)。发现有多种启动子响应元件,有CAAT-box、TATA-box、A-box等启动子基本的元件,还含有G-Box、ACE、ABRE、CGTCA-motif、LTR等结合位点。ABRE参与脱落酸反应,在ABA信号传导途径中发挥作用,响应干旱胁迫;LTR是低温应激相关元件;CGTCA-motif、TGACG-motif等参与茉莉酸信号转导的途径;还有ACE、G-box、GA-motif等大量的光反应响应元件。因此推测基因除了应对非生物胁迫外,还参与调控植物开花和光合作用等。

表2 ZmLEA34基因启动子顺式元件分析
2.7 ZmLEA34基因在玉米不同组织中的表达分析
为了进一步了解基因的在玉米组织中的表达模式,对玉米的根、茎、叶、雄穗、雌穗、胚和胚乳进行qRT-PCR分析,发现基因在这些组织中均有所表达,但相对表达量有较大差异(图5)。其中在胚中的表达量最高,其次是叶和根,但在雌穗和胚乳中相对表达量极低。说明基因是组成型表达基因,在不同组织中相对表达量有显著差异,在玉米的生长发育过程中发挥着十分重要的作用。
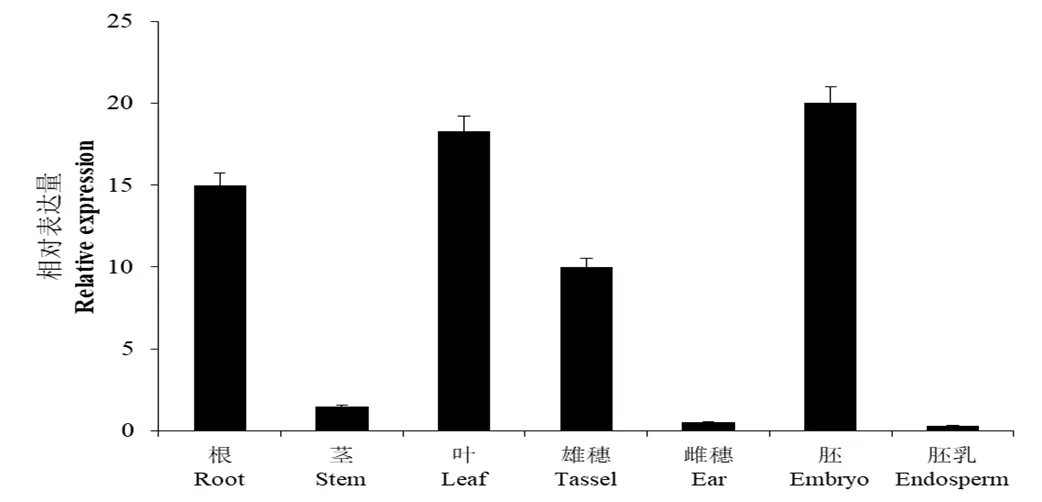
图5 ZmLEA34基因在不同组织中的相对表达量
2.8 ZmLEA34基因响应干旱胁迫的表达模式分析
为揭示基因在干旱胁迫下的表达模式,对玉米抗旱自交系郑36和旱敏感性自交系B73的根和叶的相对表达量进行分析,发现基因随着干旱时间增长,相对表达量逐步升高,且在干旱胁迫48 h时,在根和叶片中的表达量均达到了最大,郑36与B73中的表达量相差倍数分别为1.7倍和2.3倍(图6)。结果表明基因相对表达量的高低与材料的抗旱能力存在着密切联系,推测相对表达量越高,材料的抗旱性就越强。
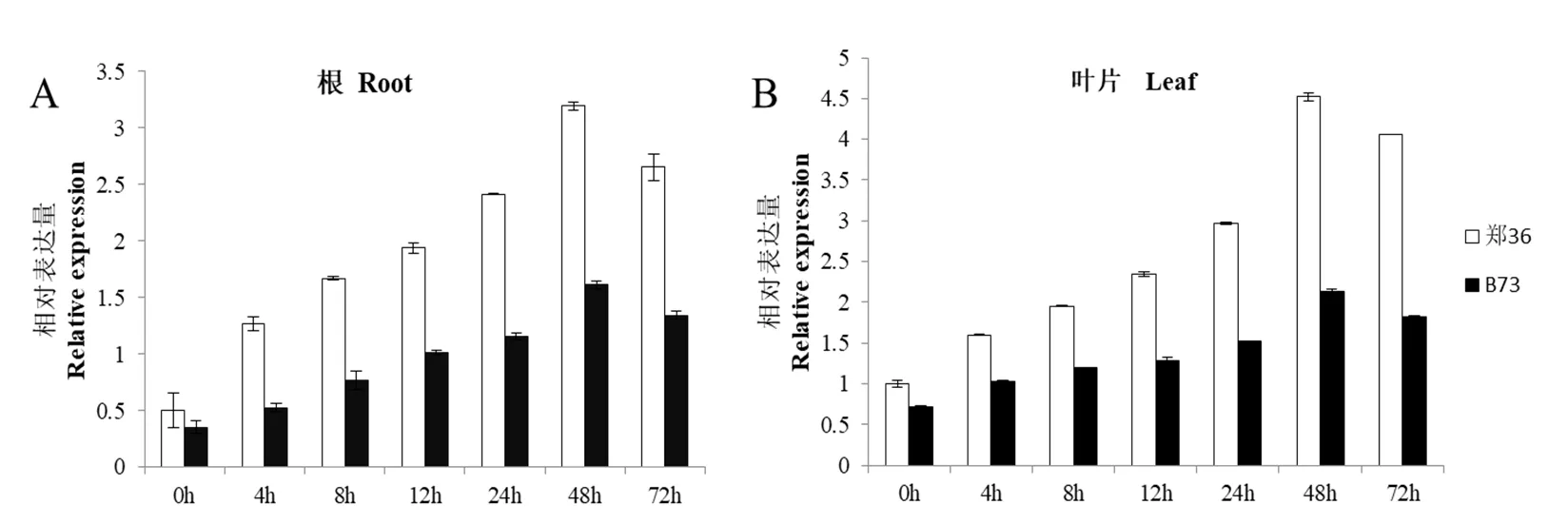
图6 ZmLEA34基因表达模式分析
2.9 ZmLEA34蛋白互作网络预测
为探究基因可能存在的网络机制,利用STRING在线预测ZmLEA34蛋白的互作蛋白。结果发现与ZmLEA34的互作蛋白主要有胚胎发育晚期丰富蛋白、3’,5’二磷酸核苷酸酶、腺嘌呤核苷酸α水解酶家族蛋白、tRNA鸟酰基转移酶1、质膜胆碱转运蛋白、RNA结合家族蛋白。这些结构域主要参与植物细胞的生长发育、次生代谢物的合成与降解、以及响应植物非生物胁迫等整个植物的生长过程。因此推测ZmLEA34蛋白与互作蛋白协同构建一张网络,来调控植物生长发育和逆境胁迫应答过程等。

表3 ZmLEA34基因的互作蛋白预测
3 讨论
玉米是世界上重要的粮食作物、饲料作物和加工原料,在我国的粮食安全和人民的增收中发挥着非常重要的作用。近年来,随着气候温度的升高,非生物胁迫发生的频率逐渐增多,已经严重威胁到全球粮食安全。干旱是主要影响农作物产量的因素之一,其造成的玉米减产成为迫切解决的问题。因此抗旱基因的挖掘,抗旱机制的解析,抗旱种质资源的筛选,从分子的层面来探究植物的抗旱能力,具有重要的现实意义。
本研究克隆了一个胚胎发育晚期丰富蛋白基因,对ZmLEA34蛋白进行分析,发现该蛋白结构主要以无规则卷曲和α螺旋为主,且属于亲水性蛋白,这与大多数LEA蛋白结构是一致[18,19];对该蛋白进行系统进化树和保守基序进行分析,发现ZmLEA34蛋白具有较高的保守性,且ZmLEA34蛋白与高粱的同源性最高,这与Nagaraju M的研究结果是一致的[20];对启动子区域顺式元件分析,得到了低温、脱落酸、茉莉酸响应等相关的顺式作用元件,有实验研究表明这些顺式元件在基因响应非生物胁迫中起着十分重要的作用。高粱、上游启动子区域含有与干旱和ABA 响应相关的顺式作用元件MYC、ABRE[21],但也并不能说明含有这些顺式作用元件一定能够响应非生物胁迫,这需要进行实验来验证。为进一步了解基因的表达模式,对玉米的各个组织进行实时荧光定量分析,发现是组成型表达基因,且在胚、叶和根中的表达量较高,这与前人研究只在胚中高表达是不一致的[22],该实验结果说明了我们所克隆到的基因与其他的 LEA基因有明显不同特点;LEA蛋白是一种功能蛋白,通过大量的实验研究表明,其主要的功能特征是基因能够响应低温、干旱等多种非生物胁迫[23]。基因在不同作物中的表达趋势不同,过表达基因可以增强农作物对逆境胁迫的耐受性。的过表达提高了转基因烟草()和酵母对干旱胁迫和低温胁迫的耐受能力[24]。可以在各种非生物胁迫中表达,在高盐、渗透胁迫和氧化胁迫中高表达,过表达能提高转基因烟草对渗透胁迫的抗性[8];过表达LEA基因能增强转基因玉米对水分胁迫的耐受能力[25]。干旱条件下,过表达的拟南芥的耐旱能力强于野生型,且严重缺水时,AtLEA4蛋白的积累比野生型更加敏感[26]。在盐和干旱生长条件下,过表达基因可以促进转基因拟南芥和水稻的生长[27];基因的诱导表达增强了小麦的的耐盐和耐旱性[28];基因在不同植物的组织中均有所表达,且该基因在拟南芥[29]和甘薯[30]中过表达提高了对盐的耐受力。本实验研究发现基因随着干旱胁迫时间增长,表达量逐渐增高,在48 h时达到高峰,并与玉米的抗旱性存在正相关性,自交系郑36的表达量始终高于B73,且增长幅度远高于B73,说明基因与材料的抗旱能力存在着密切联系,后续可以通过该基因的过表达研究其提高玉米耐旱性的作用机理,为抗逆玉米新品种的选育提供理论基础。
根据实验室前期转录组的分析结果,发现基因在正常和干旱胁迫下相对表达量达到极显著差异水平。本文对基因进行分析,发现该基因属于组成型表达的基因,在胚、根和叶中高表达;进化树分析,ZmLEA34蛋白与高粱的同源性最高,且保守基序相似度也高,进化关系最近;干旱胁迫下,基因在抗旱玉米自交系郑36中的表达量始终高于B73,推测其表达量与玉米的抗旱性存呈正相关;并通过蛋白互作网站预测,或许该基因与其他基因协同调控玉米干旱胁迫的过程。该研究结果为进一步确定基因在逆境胁迫中的作用机制奠定基础,同时也为抗逆育种提供了新思路。
[1] 陆伟婷,于欢,曹胜男,等.近20年黄淮海地区气候变暖对夏玉米生育进程及产量的影响[J].中国农业科学,2015,48(16):3132-3145
[2] 李瑞雪,周荣,苏雪强,等.干旱对植物的影响及植物干旱适应性反应研究进展——以桑树为例[J].广西蚕业,2021,58(4):29-37
[3] Candat A, Paszkiewicz G, Neveu M,. The ubiquitous distribution of late embryogenesis abundant proteins across cell compartments in Arabidopsis offers tailored protection against abiotic stress [J]. Plant Cell. 2014,26(7):3148-3166
[4] Amara I, Odena A, Oliveira E,. Insights into Maize LEA proteins: from proteomics to functional approaches [J]. Plant & cell physiology, 2012,53(2):312-329
[5] Hundertmark M, Hincha DK. LEA ( Late Embryogenesis Abundant ) proteins and their encoding genes in[J]. BMC Genom, 2008,9(1):118-120
[6] Wang XS, Zhu HB, Jin GL,. Genome-scale identification and analysis of LEA genes in rice (L.) [J]. Plant Science: An International Journal of Experimental Plant Biology, 2007,172(2):414-420
[7] Bhattacharya S, Dhar S, Banerjee A,. Structural, functional, and evolutionary analysis of late embryogenesis abundant proteins (LEA) in Triticum aestivum: A detailed molecular level biochemistry using in silico approach [J]. Computational Biology and Chemistry, 2019,82:9-24
[8] 刘洋.玉米LEA蛋白基因,和的分离与功能分析[D].泰安:山东农业大学,2014
[9] Yu J, Lai YM, Wu X,. Overexpression ofencoding a group I LEA protein confers enhanced drought tolerance in rice [J]. Biochemical and Biophysical Research Communications, 2016,478(2):703-709
[10] Huang LP, Zhang MY, Jia J,. An atypical late embryogenesis abundant proteinplays a positive role in ABA-induced antioxidant defense inL [J]. Plant & cell physiology, 2018,59(5):916-929
[11] Duan JL, Cai WM., an abiotic stress induced gene of rice plays a key role in salt and drought tolerance [J]. PLoS ONE, 2017,7(9):e45117
[12] Sun MZ, Shen Y, Yin KD,. A late embryogenesis abundant proteininteracts with a receptor like cytoplasmic kinase GsCBRLK and regulates environmental stress responses [J]. Plant Science, 2019,283:70-82
[13] Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, oxidative damage and oxygen deprivation stress:a review [J]. Annals of Botany (London), 2003,91:179-194
[14] 郑世英,商学芳,余晓帅,等.盐胁迫下不同盐敏感型玉米抗氧化酶活性的变化[J].山东农业大学学报(自然科学版),2011,42(1):1-5
[15] 李广敏,唐连顺,商振清,等.渗透胁迫对玉米幼苗保护酶系统的影响及其与抗旱性的关系[J].河北农业大学学报, 1994,17(2):1-5
[16] 袁蕊,李萍,胡晓雪,等.干旱胁迫对小麦生理特性及产量的影响[J].山西农业科学,2016,44(10):1446-1449,1466
[17] Luna CM, Pastori GM, Driscoll S,. Drought controls on H2O2accumulation, catalase (CAT) activity and CAT gene expression in wheat [J]. J Exp Bot. 2005,56(411):417-423
[18] Tunnacliffe A, Wise MJ. The continuing conundrum of the LEA proteins [J]. Die Naturwissenschaften, 2007,94(10):791-812
[19] Battaglia M, Olvera-Carrillo Y, Garciarrubio A,. The enigmatic LEA proteins and other Hydrophilins [J]. Plant Physiology, 2008,148(1):6-24
[20] Nagaraju M, Kumar SA, Reddy PS,. Genome-scale identification, classification, and tissue specific expression analysis of late embryogenesis abundant (LEA) genes under abiotic stress conditions inr L. [J]. PloS one, 2019,14(1):e0209980
[21] 王震,杜小云,刘文,等.高粱LEA基因家族的鉴定及表达分析[J].生物资源,2019,41(4):324-334
[22] Walley JW, Sartor RC, Shen Z,. Integration of omic networks in a developmental atlas of maize [J]. Science, 2016,353(6301):814-818
[23] Kosová K, Vítámvás P, Prášil IT. Wheat and barley dehydrins under cold, drought, and salinity--what can LEA-II proteins tell us about plant stress response? [J]. Frontiers in Plant Science, 2014,5:343
[24] Liu Y, Wang L, Jiang S,. Group 5 LEA protein,, enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast [J]. Plant Physiology Biochemisty, 2014,84:22-31
[25] Amara I, Capellades M, Ludevid MD,. Enhanced water stress tolerance of transgenic maize plants over-expressing LEAgene [J]. Journal of Plant Physiology, 2013,170(9):864-873
[26] Olvera-Carrillo Y, Campos F, Reyes JL,. Functional analysis of the group 4 late embryogenesis abundant proteins reveals their relevance in the adaptive response during water deficit in Arabidopsis [J]. Plant physiology, 2010,154(1):373-790
[27] Duan J, Cai W, Park S., an abiotic stress induced gene of rice plays a key role in salt and drought tolerance [J]. Plos One, 2012,7(9):e45117
[28] Habib I, Shahzad K, Rauf M,.Dehydrin responsivedriven inducible gene expression enhanced salt and drought tolerance in wheat [J]. Plant Physiology and Biochemistry, 2022,180:124-133
[29] Jia FJ, Qi SD, Li H,. Overexpression of Late Embryogenesis Abundant 14 enhancessalt stress tolerance [J]. Biochemical and Biophysical Research Communications, 2014,454(4):505-511
[30] Park SC, Kim YH, Jeong JC,. Sweetpotato late embryogenesis abundant 14 () gene influences lignification and increases osmotic- and salt stress-tolerance of transgenic calli [J]. Planta, 2011,233(3):621-634
Molecular Characteristics, Cloning and Expression Analysis ofGene in Maize in Response to Drought Stress
ZHANG Qian-jin, CAO Li-ru, MA Chen-chen, PANG Yun-yun, YE Fei-yu, LU Xiao-min*
450002,
Late embryogenesis abundant proteins is a kind of dehydrating protective protein enriched in late embryo development, which plays an important role in resistingdrought, high salt and other stresses. In this paper, we cloned a protein-rich genein late embryonic development. The gene contains an 876 bp open reading frame and codes 291 amino acids, which is a hydrophilic protein. The analysis of protein evolutionary tree showed that ZmLEA34 had the closest homology relationship with sorghum, and had the same conserved motif in the same location. Cis-acting element analysis showed that the gene contained multiple binding sites in response to stress, plant hormone signal transduction and light signal. The results of qRT-PCR showed thatwas a constitutive expression gene, with a high expression level in embryo, root and leaf. ZmLEA34 was significantly up-regulated in roots and leaves under drought stress, and the expression level of drought-resistant maize inbred line Zheng 36 was always higher than that in B73. It was speculated that the expression level of this gene was significantly and positively related to the drought tolerance of the materials. The results lay a foundation for further revealing the mechanism ofgene.
Maize; constitutive expression; drought tolerance
S513
A
1000-2324(2022)05-0665-08
2022-09-14
2022-12-10
河南省重大科技专项-子课题:玉米关键性状优异基因挖掘与新品种选育(221100110300);中央引导地方科技发展资金:玉米抗旱遗传机制解析与种质创制(Z20221343040)
张前进(1973-),男,硕士研究生,副研究员,主要从事玉米遗传育种研究. E-mail:zqjin@126.com
通讯作者:Author for correspondence. E-mail:luxiaomin2004@163.com
