低温异养硝化–好氧反硝化菌的分离及其除氮特性
2023-01-12陈思宇刘晶杨正黄元昊彭英杰舒志恒张俊豪兰时乐
陈思宇,刘晶,杨正,黄元昊,彭英杰,舒志恒,张俊豪,兰时乐
低温异养硝化–好氧反硝化菌的分离及其除氮特性
陈思宇,刘晶,杨正,黄元昊,彭英杰,舒志恒,张俊豪,兰时乐*
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
针对目前大部分除氮微生物遇冬季低温难以对污水进行有效脱氮的问题,从冬季水浸稻田土壤中分离到1株在10~15 ℃下具有高效异养硝化好氧反硝化能力的菌株D15。经鉴定,确定该菌株为嗜碱假单胞菌()。考察了氮源质量浓度(100、150、200、250、300、400、600、800 mg/L),碳源种类(柠檬酸三钠、丁二酸钠、乙酸钠、草酸钠、麦芽糖),摇床转速(130、150、170、190、210 r/min),培养温度(5、10、15、20、25、30、35 ℃)对菌株D15除氮效果的影响。结果表明,菌株D15在以柠檬酸三钠为碳源、初始氮源质量浓度150 mg/L、摇床转速190 r/min、15 ℃条件下培养,对氨氮、硝氮及亚硝氮的去除率均达到了100.0%。在猪粪废水中添加柠檬酸三钠、15 ℃下分别处理54 h和66 h后,对氨氮和总氮的去除率分别达到100.0%和88.8%。
低温异养硝化–好氧反硝化菌;嗜碱假单胞菌;猪粪废水脱氮;除氮率
水产养殖及畜牧业快速发展的同时,伴随着水体氮污染问题,对自然生态环境构成威胁。《2020年中国环境状况公报》指出,氮素污染仍然是现阶段海陆渔业水域的主要问题之一[1]。水体除氮主要采取物化法[2]和生物法[3]。物化法通过物理吸附、离子互换或向污水和废水中添加药剂来去除水中含氮类污染物,见效快,但容易造成水体环境的二次污染。生物脱氮则工艺流程简单、对环境友好,被认为是更加节能环保、经济高效的脱氮方式。传统生物脱氮分为硝化作用和反硝化作用两部分进行。由于2个过程的功能微生物生态位差别大,硝化和反硝化作用通常需要在2个独立的反应器中进行,这在很大程度上增加了生物脱氮的成本[4]。ROBERTSON 等[5]分离出1株异养硝化–好氧反硝化(HN–AD)细菌。这种细菌可从有机碳中摄取营养,兼具硝化与反硝化能力,且整个脱氮过程可在有氧环境下进行。相较于传统生物除氮技术,由HN–AD菌主导的新型脱氮技术更高效,成本更低廉。
有研究表明,低温会使反硝化关键酶基因表达延迟[6],抑制酶的活性,减缓微生物的生长,导致反硝化作用明显减弱[7],因此低温成为冬季生物脱氮的限制性因素[8–9]。大多数脱氮菌株最适温度为25~30 °C[10–11],但冬季室外水体温度通常低于20 ℃,常规的生物脱氮法受限于低温环境,致使冬季废水脱氮效果变差。已有研究者发现sp. M–11[12]、HITLi7T[13]、Y–9[14]、sp. HA2[15]等菌种,可在2~15 ℃条件下有效去除水体中的氨氮、硝态氮和亚硝氮,这为低温环境下的污水除氮提供了生物技术支持。笔者从冬季水浸稻田土壤中筛选分离出1株在低温条件下快速生长、除氮性能良好的HN–AD菌株,利用形态学和16S rDNA序列测定进行菌种鉴定,基于单因素试验法研究其除氮特性,并进行猪场养殖废水脱氮试验,以期为冬季养殖废水的除氮提供依据。
1 材料与方法
1.1 材料
2019年冬季,自湖南省农业科学院水稻田取土壤样品。
2021年8月,自湖南农业大学动物试验场取猪粪废水。废水原液初始氨氮含量为300.57 mg/L,硝态氮含量为37.59 mg/L,总氮含量为396.51 mg/L。
1.2 方法
1.2.1HN–AD菌株的筛选与鉴定
取土壤样品,参照肖思远等[16]方法,稍有修改,富集培养 72 h;连续富集2次后,利用BTB培养基分离出在平板上具有蓝色显色圈的菌株;再对分离的菌株进行摇瓶复筛,将菌株分别接入含有氨氮、硝氮和亚硝氮的培养基中振荡培养48 h,测定氨氮、硝氮和亚硝氮的含量,并计算其去除率。依据氮去除率高低筛选出除氮性能最佳的菌株。利用形态学方法[3]和16S rDNA序列分析对目的菌株进行鉴定,测序交由生工生物工程(上海)股份有限公司完成。
1.2.2HN–AD菌株除氮特性的测定
分别以硫酸铵、亚硝酸钠和硝酸钾为氮源,依次考察基础培养基中的氮源质量浓度(100、150、200、250、300、400、600、800 mg/L),碳源种类(柠檬酸三钠、丁二酸钠、乙酸钠、草酸钠、麦芽糖),摇床转速(130、150、170、190、210 r/min),培养温度(5、10、15、20、25、30、35 ℃)4个因素对HN–AD菌株除氮效果的影响。每个单因素试验都基于前一单因素试验结果来设计。单因素试验的初始培养条件为:培养基初始pH7.0、接种量5%、培养温度15 ℃、摇床转速170 r/min培养48 h。测定发酵上清液中氨氮、硝氮、亚硝氮及总氮含量[17],并计算除氮率。
1.2.3HN–AD菌株对猪粪废水除氮效应的测定
基于单因素试验结果,利用HN–AD菌对猪粪废水进行发酵,模拟废水除氮。以猪粪废水原液为对照组;处理1组在废水原液中添加经过适当培养的HN–AD菌种子液;处理2组在试验1组的基础上再添加1%的柠檬酸三钠作为碳源。处理组于15 ℃、190 r/min 振荡培养,定时取样,测定样液中氨氮、亚硝氮、硝氮和总氮含量,计算除氮率。
2 结果与分析
2.1 水稻土HN–AD菌种的筛选和鉴定结果
初筛共筛选到10株在分离培养基上具有蓝色显色圈的菌株,将这10株菌株纯化后接种至斜面培养基上4 ℃保存,分别编号为S1、S2、S3、W3、D1、D13、D15、D16、D17、D18。
10株菌株对氨氮、硝氮和亚硝氮的去除率列于表1。菌株D15对氨氮、亚硝氮和硝氮去除效果较佳,去除率分别达到了93.5%、99.9%和100.0%;因此,选用菌株D15作为后续试验菌株。

表 1 HN–AD菌株的除氮效果
同列不同字母表示菌株间差异有统计学意义(<0.05)。
菌株D15在BTB平板上形状规则,呈圆形,边缘整齐;菌落较小、表面光滑湿润、灰白色(图1–a)。扫描电镜结果显示,菌体形状为杆状,大小为(0.29~0.36) μm×(1.14~2.39) μm。

a 菌落形态;b 菌体电镜扫描结果(10 000倍)。
将D15菌株的16S rDNA基因序列(GenBank序列号为ON088982)与GenBank数据库中已有细菌16S rDNA进行比对,发现其与属菌株的16S rDNA序列同源性达99%以上,其中与JAB1(CP016162.1)同源性达100.00%。根据序列比对结果构建系统发育树,结果见图2。将菌株D15鉴定为嗜碱假单胞菌()。

图2 基于16S rDNA 基因序列同源性构建的系统发育树
2.2 HN–AD菌株的除氮特性
2.2.1初始氮质量浓度对菌株D15除氮效果的影响
培养基的初始氮质量浓度分别为100、150、200、250、300、400、600、800 mg/L时,菌株D15的除氮效果列于表2。当初始氨氮、亚硝氮和硝氮质量浓度均为150 mg/L时,菌株D15对氨氮、亚硝氮和硝氮去除率分别达到最大值96.2%、99.9%和100.0%。随着初始氮质量浓度的增加,菌株D15的氨氮、亚硝氮和硝氮和总氮去除率逐步降低,因此,选择培养基初始氮质量浓度为150 mg/L。

表2 初始氮质量浓度下菌株D15的除氮效果
同列不同字母表示处理间差异有统计学意义(<0.05)。
2.2.2碳源种类对菌株D15除氮效果的影响
培养基碳源分别为柠檬酸三钠、丁二酸钠、乙酸钠、草酸钠和麦芽糖时,菌种D15的除氮效果列于表3。不同碳源对菌株D15在不同氮源下的除氮效果差异显著(<0.05)。当分别以柠檬酸三钠、丁二酸钠为碳源时,菌株D15的氨氮、亚硝氮和硝氮去除率均达到了100.0%。但整体而言,柠檬酸三钠条件下的总氮去除率更高。综合考虑,选择以柠檬酸三钠为适宜碳源。
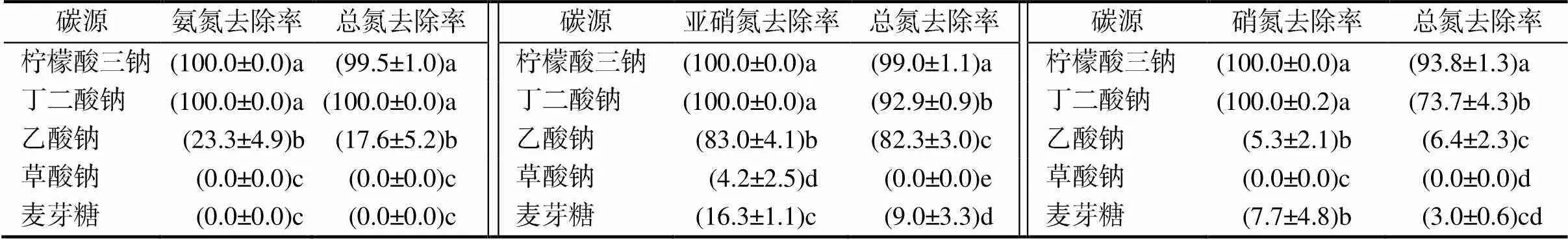
表3 不同碳源培养菌株D15的除氮效果
同列不同字母表示处理间差异有统计学意义(<0.05)。
2.2.3摇床转速对菌株D15除氮效果的影响
摇床转速分别为130、150、170、190和210 r/min时,菌株D15的除氮效果如表4所示。在转速为190 r/min时,菌株D15对氨氮、亚硝氮和硝氮去除率分别达到100.0%、99.9%和99.2%;继续增加转速,对氨氮、亚硝氮和硝氮去除率无明显变化,但总氮去除率明显降低。综合考虑,选择转速190 r/min为宜。

表4 不同摇床转速下菌株D15的除氮效果
同列不同字母表示处理间差异有统计学意义(<0.05)。
2.2.4培养温度对菌株D15除氮效果的影响
培养温度分别为5、10、15、20、25、30和35 ℃时,菌株D15的除氮效果列于表5。结果表明,当培养温度为5 ℃时,菌株D15除氮效果并不明显;当温度升至10 ℃时,菌株D15的除氮效果有了显著提升,氨氮去除率能达到98.2%,亚硝氮去除率也有54.3%;当温度为15 ℃时,菌株D15的氨氮、亚硝氮和硝氮去除率均达到100.0%,总氮去除率也超过95.0%;当温度超过20 ℃后,不同氮源条件下的总氮去除率逐渐降低;因此,选择培养温度15 ℃为宜。
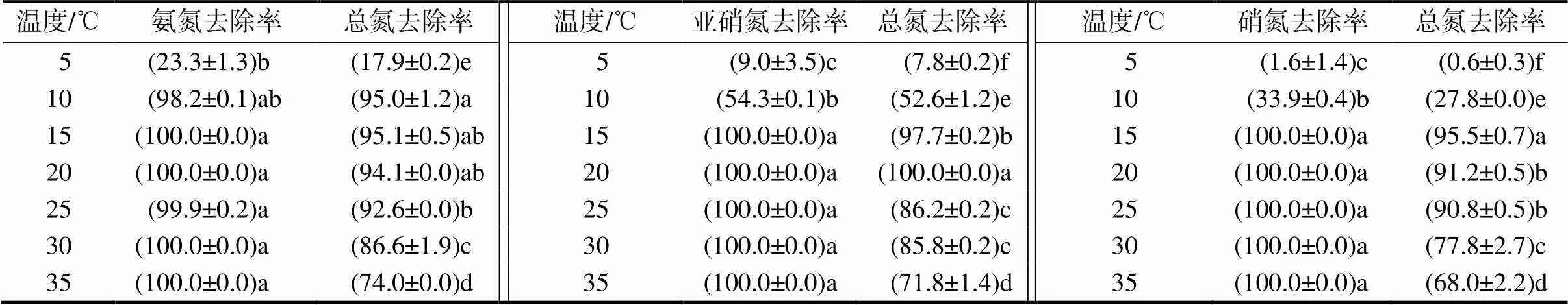
表5 不同培养温度下菌株D15的除氮效果
同列不同字母表示处理间差异有统计学意义(<0.05)。
2.3 菌株D15对猪粪废水的除氮效果
从表6结果可以看出,随着培养时间的延长,各处理组氨氮去除率均呈上升趋势。培养60 h,处理2的氨氮去除率达100.0%,显著高于对照组(52.6%)和处理1(54.8%)。说明外加适量碳源可提高菌株D15对猪粪废水中氨氮的去除率。
随着培养时间的延长,CK与处理1对硝氮的去除率也随之提高。当培养54 h时,两者硝氮去除率均达100.0%,但在培养54 h前,处理1对硝氮的去除率均高于对照组,说明接入菌株D15可加快硝氮的去除。而处理2在培养48 h前,培养液中硝氮含量增加,说明添加碳源有利于加快氨氮的转化。至培养66 h,硝氮去除率显著下降,推测可能是因为培养时间过长,菌体死亡裂解,细胞内硝氮物质外流所致。
各处理猪粪废水中总氮去除率也随着时间的延长而提高。培养至54 h,CK和处理1的总氮去除率达最高分别为55.4%和56.3%,培养时间延长,总氮去除率下降,且CK组在培养至12 h后才表现出对总氮有去除能力,可能是废水中自身的微生物利用其中氨氮或硝氮生长所致。处理2的总氮去除率随培养时间的延长而提高,培养至66 h,总氮去除率高达88.8%。

表6 菌株D15在猪粪废水中的除氮效果
3 结论与讨论
从冬季浸稻田土壤中分离到1株在低温下具有异养硝化–好氧反硝化能力的细菌D15,经形态学观察、16S rDNA序列分析鉴定,确定为嗜碱假单胞菌()。HN–AD菌D15分别以氨氮、硝氮和亚硝氮为氮源,柠檬酸三钠为碳源,15 ℃、初始氮质量浓度150 mg/L、摇床转速190 r/min培养时,对氨氮、硝氮和亚硝氮去除率均达到了100.0%。
D15对猪场废水的除氮试验结果表明,在添加柠檬酸三钠的条件下,发酵48 h时,对硝氮去除率可达98.3%;发酵66 h时,对氨氮、总氮去除率可分别达到100.0%和88.8%,脱氮效果较好。
从试验结果来看,菌株D15对高浓度的氨氮和硝氮有较强的耐受性。在初始氮质量浓度高达800 mg/L时,菌株D15对氨氮、硝氮去除率仍有50.6%和58.4%,而菌株N3[18]在硝酸盐质量浓度超过80.0 mg/L时,脱氮率显著下降;菌株YN3[19]在氨氮质量浓度达到200 mg/L时,氨氮去除率仅有2.0%,这表明菌株D15在处理高浓度含氮废水时将有较好的应用前景。
转速过低难以为发酵提供充足的溶解氧(DO)条件,从而抑制好氧微生物的生长和脱氮性能[20];而转速过高又可能抑制反硝化过程中酶的活性[21]。本试验中,当转速为130~190 r/min时,随着转速的增加,菌株D15的除氮率随之提高;当转速继续升至210 r/min时,菌株D15的氨氮、硝氮及亚硝氮去除率则相对稳定,总氮去除率略有下降。这与ZHAO等[21]、邰勇等[22]的研究结果相似,但不同菌株的最适宜溶氧量有所差异,在实际应用过程中还需控制适当的DO值,亦即保持适当的转速,以便菌株有效脱氮。
在15~35 ℃,菌株D15对氨氮、硝氮及亚硝氮的去除率几乎都保持在100.0%的高水平。当温度升至35 ℃时菌株D15在不同氮源条件下的总氮去除率降至70.0%左右,但仍高于相同温度下荧光假单胞菌L2[23]的总氮去除率。此外,当培养温度为10 ℃时,菌株D15的氨氮去除率高于此温度下sp. M–33[24]的氨氮去除率。与假单胞菌GK–01、施氏假单胞菌SC221–M、气单胞菌HN–02等[25–29]相比,菌株D15对温度的适应性更加宽泛。
在处理猪粪废水的试验中,添加柠檬酸三钠后,菌株D15的除氮效果显著提升,说明添加碳源可确保合适的C/N、提供硝化和反硝化作用电子供体和充足的能量,从而提升菌株在废水中的除氮竞争力。该研究结论与雷强等[30]一致。且菌株D15的废水除氮率高于菌株GNR[31],显示菌株D15在猪粪废水除氮上良好的应用潜能。
[1] 生态环境部.2020年中国生态环境状况公报(摘录)[J].环境保护,2021,49(11):47–68.
[2] 王琳,牟春霞,王丽.高氨氮含量废水的处理方法及研究现状[J].水处理技术,2021,47(5):1–5.
[3] 何磊.耐低温高效好氧反硝化细菌的筛选及其特性研究[D].石家庄:河北科技大学,2019.
[4] 冯亮,袁春燕,杨超,等.好氧反硝化生物脱氮技术的研究进展[J].微生物学通报,2020,47(10):3342–3354.
[5] ROBERTSON L A,KUENEN J G.Combined hetero- trophic nitrification and aerobic denitrification inand other bacteria[J].Antonie Van Leeuwenhoek,1990,57(3):139–152.
[6] SALEH-LAKHA S,SHANNON K E,HENDERSON S L,et al.Effect of pH and temperature on denitrification gene expression and activity in[J]. Applied and Environmental Microbiology,2009,75(12):3903–3911.
[7] YAO S,NI J R,MA T,et al.Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium,sp.HA2[J].Bioresource Technology,2013,139(1):80–86.
[8] ZHANG J B,WU P X,HAO B,et al.Heterotrophic nitrification and aerobic denitrification by the bacteriumYZN-001[J].Bioresource Techno- logy,2011,102(21):9866–9869.
[9] SONG Z F,AN J,FU G H,et al.Isolation and characterization of an aerobic denitrifyingsp. YX-6 from shrimp culture ponds[J].Aquaculture,2011,319(1/2):188–193.
[10] 陈均利,彭英湘,刘锋,等.异养硝化–好氧反硝化菌脱氮特性研究进展[J].环境科学与技术,2020,43(5):41–48.
[11] JI B,YANG K,ZHU L,et al.Aerobic denitrification:a review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering,2015,20(4):643–651.
[12] YANG M,LU D W,QIN B D,et al.Highly efficient nitrogen removal of a coldness-resistant and low nutrient needed bacterium,sp.M-11[J]. Biore- source Technology,2018,256:366–373.
[13] ZHENG Z J,ZHANG D Y,LI W G,et al.Substrates removal and growth kinetic characteristics of a heterotrophic nitrifying-aerobic denitrifying bacterium,HITLi7T at 2 °C[J].Bioresource Technology,2018,259:286–293.
[14] XU Y,HE T X,LI Z L,et al.Nitrogen removal characteristics ofY-9 capable of heterotrophic nitrification and aerobic denitrification at low temperature[J].BioMed Research International,2017,2017:1429018.
[15] YAO S,NI J R,CHEN Q,et al.Enrichment and characterization of a bacteria consortium capable of heterotrophic nitrification and aerobic denitrification at low temperature[J].Bioresource Technology,2013,127(1):151–157.
[16] 肖思远,朱文娟,陈思宇,等.反硝化细菌的筛选及菌藻共培养体系除氮特性[J].环境科学与技术,2021,44(8):154–162.
[17] 国家环保局编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[18] 路俊玲,陈慧萍,肖琳.低温反硝化菌:施氏假单胞菌N3的筛选及脱氮性能[J].环境科学,2018,39(12):5612–5619.
[19] 颜薇芝,张汉强,余从田,等.1株异养硝化好氧反硝化不动杆菌的分离及脱氮性能[J].环境工程学报,2017,11(7):4419–4428.
[20] 朱云,龚望宝,谢骏,等.好氧反硝化细菌的鉴定及其脱氮特性研究[J].水生生物学报,2020,44(4):895–903.
[21] ZHAO T T,CHEN P P,ZHANG L J,et al.Heterotrophic nitrification and aerobic denitrification by a novelsp.TAC-1 at low temperature and high ammonia nitrogen[J].Bioresource Technology,2021,339:125620.
[22] 邰勇,邓敬轩,任洪艳,等.一株sp.异养硝化菌的分离鉴定及其氨氧化性能[J].应用与环境生物学报,2020,26(2):325–331.
[23] 魏荷芬,韩保安,王田野,等.一株荧光假单胞杆菌的分离鉴定与反硝化特性[J].微生物学通报,2016,43(8):1679–1689.
[24] 杨墨,刘乾亮,吕东伟,等.低温异养硝化–好氧反硝化菌筛选及其脱氮特性[J].中国给水排水,2019,35(23):100–104.
[25] 白洁,郭晓旭,康兆颜,等.一株异养硝化–好氧反硝化菌sp.GK–01的筛选及脱氮能力研究[J].中国海洋大学学报(自然科学版),2019,49(S1):74–84.
[26] LEI Y,WANG Y Q,LIU H J,et al.A novel heterotrophic nitrifying and aerobic denitrifying bacterium,DN-7,can remove high-strength ammo- nium[J].Applied Microbiology and Biotechnology,2016,100(9):4219–4229.
[27] 连红民,邱忠平,何昆明,等.一株好氧反硝化–异养硝化菌的筛选及脱氮特性研究[J].生物技术通报,2015,31(6):138–143.
[28] 邓斌.施氏假单胞菌SC221–M的反硝化特性及其调节草鱼养殖水体水质的研究[D].杭州:浙江大学,2014.
[29] CHEN M X,WANG W C,FENG Y,et al.Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacteriumsp. HN-02[J].Bioresource Technology,2014,167:456–461.
[30] 雷强,张燕,孙燕,等.异养硝化–好氧反硝化菌YZ–12的脱氮性能及其对养殖废水的处理效果[J].环境工程学报,2022,16(1):301–310.
[31] 谭俊杰,李立君,李雪洁,等.异养硝化–好氧反硝化菌株GNR选育及对猪场废水脱氮实验[J].环境工程,2021,39(2):21–26.
Isolation and nitrogen removal characteristics of a low temperature heterotrophic nitrification-aerobic denitrification bacterium
CHEN Siyu,LIU Jing,YANG Zheng,HUANG Yuanhao,PENG Yingjie,SHU Zhiheng,ZHANG Junhao,LAN Shile*
(College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha, Hunan 410128, China)
In view of the problem that most nitrogen removal microorganisms are difficult to effectively remove nitrogen from sewage in winter at low temperature, a strain D15 with high efficiency of heterotrophic nitrification and aerobic denitrification(HN-AD) at 10-15℃ was isolated from the soil of flooded rice fields in winter. Strain D15 was identified as. The effects of nitrogen source concentration (100, 150, 200, 250, 300, 400, 600, 800 mg/L), carbon sources type (trisodium citrate, sodium succinate, sodium acetate, sodium oxalate, maltose), shaking table speed (130, 150, 170, 190, 210 r/min), and culture temperature (5, 10, 15, 20, 25, 30, 35 ℃) on nitrogen removal efficiency of strain D15 were investigated. The results showed that the removal rate of ammonia nitrogen, nitrate nitrogen and nitrite nitrogen of strain D15 reached 100.0% under the conditions of using trisodium citrate as carbon source, initial nitrogen source mass concentration of 150 mg/L, shaking table speed of 190 r/min with a culture temperature of 15 ℃. After adding trisodium citrate to pig manure wastewater, the wastewater was incubated with D15 strain at 15 ℃ for 54 h and 66 h respectively, the removal rates of ammonia nitrogen and total nitrogen from the wastewater by D15 strain reached 100.0% and 88.8% respectively.
low temperature heterotrophic nitrifying-aerobic denitrifying bacteria;; nitrogen removal from pig manure wastewater; nitrogen removal rate
X172
A
1007-1032(2022)06-0712-06
陈思宇,刘晶,杨正,黄元昊,彭英杰,舒志恒,张俊豪,兰时乐.低温异养硝化–好氧反硝化菌的分离及其除氮特性[J].湖南农业大学学报(自然科学版),2022,48(6):712–717.
CHEN S Y,LIU J,YANG Z,HUANG Y H,PENG Y J,SHU Z H,ZHANG J H,LAN S L.Isolation and nitrogen removal characteristics of a low temperature heterotrophic nitrification-aerobic denitrification bacterium[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(6):712–717.
http://xb.hunau.edu.cn

2022–03–15
2022–10–12
湖南省自然科学基金项目(2020JJ6058)
陈思宇(1997—),女,湖南衡阳人,硕士研究生,主要从事微生物资源开发利用研究,aclover@163.com;*通信作者,兰时乐,副教授,主要从事微生物资源开发利用研究,875540378@qq.com
10.13331/j.cnki.jhau.2022.06.013
责任编辑:罗慧敏
英文编辑:罗维
