海参粉微囊制备工艺
2023-01-12喻樊蔡蓉蔡伶丽
喻樊 *,蔡蓉,蔡伶丽
1.江苏省肿瘤靶向纳米诊疗材料工程研究中心,盐城师范学院盐城(盐城 224007);2.药学院盐城师范学院(盐城224051);3.江苏省滩涂生物资源与环境保护重点建设实验室(盐城 224002);4.南京工业大学(南京 210000)
海参,棘皮动物门海参纲物种,我国的海参种类有140余种,其中20余种可食用,而产于山东、辽宁的刺参最负盛名[1]。科学证明,海参中含有18种氨基酸与大量的酸性黏多糖、海参皂苷、胶原蛋白等活性物质,具有很高的营养价值和保健功能[2]。由于鲜活的海参不容易保存,这影响了海参的应用。
微囊是指固态或者液态药物被高分子的材料包封形成的微小的囊状粒子,直径一般在1~250 μm。将海参制成微囊,具有提高稳定性、掩盖不良口味及气味的优点。由于喷雾干燥法制备微囊具有可控性好、操作简便、产品分散等优点,是最具有工业化应用价值的制备微囊的方法[3],故试验研究采用喷雾干燥法制备海参微囊,对海参产品的开发具有较大意义。
1 材料与方法
1.1 仪器与设备
实验型喷雾干燥机(SP-1500,上海顺仪实验设备有限公司);三目生物显微镜(XSP-8C,上海严丰精密仪器有限公司);研磨机(TUBE-MILL,IKA);冷冻干燥机(FD-1D-80,北京博医康实验仪器有限公司);紫外/可见/近红外分光光度计(Lamb da950,美国PE公司);红外光谱仪(TENSOR Ⅱ,德国布鲁克光谱仪器公司);环境扫描电子显微镜(Quanta 200,荷兰FEI)。
1.2 材料与试剂
乳铁蛋白粉(批号20210262517,河南万邦实业有限公司);淡干海参(烟台瑞参堂水产有限公司)。
1.3 试验方法
1.3.1 海参粉的制备
(1)回软:在淡干海参中倒入0~5 ℃的纯净水,置于4 ℃冰箱中泡发24~48 h,每12 h换1次水。
(2)去沙嘴:用剪刀将海参开膛去沙嘴,去除海参的内脏。
(3)水煮:将海参放入锅中小火煮70~90 min。
(4)泡发:出锅后用凉水冲洗海参,将其用0~5 ℃纯净水泡发,置于4 ℃冰箱保存2~3 d,每12 h换1次水。
(5)冷冻保存:将上述泡发完成后的海参剪成厚度约2 cm小块装在培养皿中,冷冻保存24 h左右。
(6)冷冻干燥:将冷冻后的海参放入冷冻干燥机进行冷冻干燥。
(7)粉碎机粉碎:将干燥后的海参放入研磨机中进行粉碎,将粉碎后的海参粉放入干燥器中保存。
1.3.2 微囊的制备
(1)空白微囊的制备:取适量的乳铁蛋白粉溶于纯水中,静置20 min,搅拌均匀,进行喷雾干燥即得。
(2)海参粉微囊的制备:取适量的乳铁蛋白粉溶于纯水中,静置20 min,搅拌均匀,作为囊材溶液待用;取一定量的海参粉逐量加入到囊材溶液中,混合搅拌均匀后进行喷雾干燥,即得。
1.3.3 微囊制备工艺的优化
采用单因素试验法对微囊的制备工艺进行乳铁蛋白溶液浓度、进风温度、进料速度、风机频率等影响因素的考察。以微囊形态为指标判定微囊效果的好坏。
1.3.3.1 乳铁蛋白溶液浓度的选择
固定其他参数不变,考察3种囊材溶液浓度(2%,3%和5%)对微囊成型的影响。依据微囊形态的好坏对囊材溶液浓度进行筛选。
1.3.3.2 进风温度的选择
固定其他参数不变,考察3种进风温度(170,180和190 ℃)对微囊成型的影响。依据微囊形态的好坏对进风温度进行筛选。
1.3.3.3 进料速度的选择
固定其他参数不变,考察3种进料速度(0.4,0.5和0.6 L/h)对微囊成型的影响。依据微囊形态的好坏对进料速度进行筛选。
1.3.3.4 风机频率的选择
固定其他参数不变,考察3种风机频率(30,45和60 Hz)对微囊成型的影响。依据微囊形态的好坏对风机频率进行筛选。
1.3.4 微囊的形态观察及粒径分布
1.3.4.1 生物显微镜观察
取少许微囊粉末置于载玻片上,滴加少量的纯水,覆上盖玻片,放置在三目生物显微镜下观察微囊的形态[4]。
1.3.4.2 扫描电子显微镜(SEM)的测定
取海参粉、空白微囊、海参粉微囊作为样品,喷金15 s后,置于电镜测试仪器内,高压15.00 kV进行测定。
1.3.4.3 粒径分布测定
用生物显微镜观察微囊形态,并且用颗粒成像仪软件中的标尺测量100个微囊的粒径,统计粒径分布情况并作图说明。
1.3.5 固体紫外的测定
分别放入样品海参粉、乳铁蛋白粉、乳铁蛋白空白微囊、海参粉与乳铁蛋白粉的物理混合物及海参粉微囊,扫描测定,扫描条件为200~1 000 nm。
1.3.6 红外光谱的测定
采用KBr压片法来进行红外光谱的测定。打开红外光谱仪的电源,预热平衡,打开电脑,点击进入红外光谱分析软件,点击测定,使屏幕转到测定界面,初始化仪器。在制片前用丙酮擦拭研钵及其他压片工具,然后在红外灯光照下,制备溴化钾空白片和样品压片(样品五种,海参粉、乳铁蛋白粉、空白微囊、物理混合物、海参粉微囊),将压制好的溴化钾空白片放入红外光谱仪的样品架上,点击测定按钮下的背景按钮,输入光谱的名称,确认采集参比背景光谱。背景图谱采集完毕后将待测样品放入光谱仪内,进行红外扫描,扫描范围为4 00~4 000 cm-1,扫描完毕保存数据后,运用Origin软件绘图并分析谱图。
1.3.7 X射线衍射法(XRD)分析
将海参粉、乳铁蛋白粉、空白微囊、乳铁蛋白粉和海参粉的物理混合物、海参粉微囊等样品分别进行X射线衍射测定。取干燥后的样品研磨,压片后置于X射线粉末衍射仪中扫描,设置衍射参数(10°~80°,10°/min),检测条件:Cu靶,K线;扫描方式采用定性,步进扫描;管压40 kV,管压30 mA,扫描步长0.02°,扫描范围10°~80°,扫描速度2°/min[14]。
2 结果与分析
2.1 微囊制备工艺考察结果分析
乳铁蛋白溶液浓度2%和3%时制得的微囊形态不好,大小不均一。而5%浓度下所制得的微囊圆整光滑、成型效果好。因此应选择5%浓度的囊材溶液制备微囊。进口温度180 ℃和190 ℃下的微囊由于温度较高,形态比较干瘪,成型性差。170 ℃下的微囊形态可看出是光滑圆整的球形,成型性好。因此,选用进口温度170 ℃制备空白微囊最适合。在喷雾干燥过程中,随着进料速度的增加,粘壁现象变得严重,这可能是由于进料速度过大导致喷雾干燥不及,使得喷出的液滴在未曾达到表面干燥之前就和塔壁接触因而粘在热壁上[5]。因此物料流量0.4 L/h制得的微囊效果最好。45 Hz风机频率条件下制得的空白微囊形状圆整,分散相对比较均匀,无粘连现象,效果较好;30和60 Hz条件下的空白微囊成型性较差,粘连也相对严重,效果差。因为应该选择45 Hz的风机频率。
因此,乳铁蛋白粉空白微囊的最佳制备工艺是乳铁蛋白溶液度5%、进风温度170 ℃、进料速度0.4 L/h、风机频率45 Hz。
2.2 微囊形态的观察及粒径分布
2.2.1 显微镜观察
根据制备工艺优化的结果,制备海参粉微囊,如图1所示。微囊形态圆整,表面光洁,粒径分布比较均匀,几乎无粘连现象,表明该制备工艺下的微囊效果较好。

图1 显微镜图
2.2.2 扫描电子显微镜(SEM)观察
利用扫描电子显微镜观察海参粉、空白微囊、海参粉微囊的形态,如图2所示。
图2(A)与(C)比较,可以明显看出海参粉制备成微囊前后的形态差别。图2(B)与(C)的微囊图片中大部分微囊有干瘪现象,这可能是由于乳铁蛋白粉硬度较低和拍电镜图前需要抽真空所导致;但可以看出微囊大致呈现较为规则的球形形态且表面光滑,粘连较少。从图2(C)中可以看出海参粉微囊周围并无游离的海参粉药物,可以说明海参粉被全部包进微囊中[6]。

图2 扫描电子显微镜图片
2.2.3 微囊粒径分布
将计数结果做成柱状图,如图3所示。微囊粒径有67%分布在4~6 μm之间,粒径分布较均匀,效果较好。
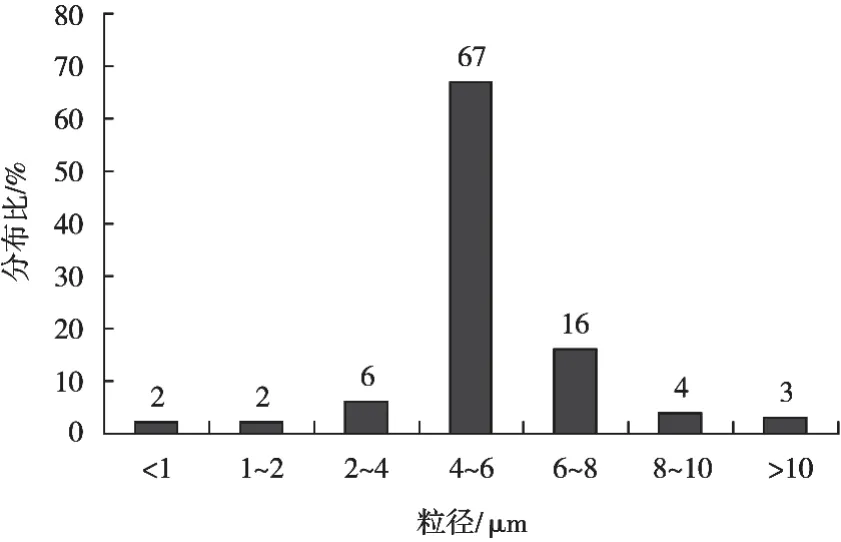
图3 微囊粒径分布图
2.3 固体紫外分析
由图4可知:在230 nm处海参粉有1个吸收峰,可能是羟基或氨基的吸收峰;在280 nm左右处有1个弱吸收峰,可能是生色基团羰基;在380 nm处有1个吸收峰,说明存在1个非常大的共轭体系。乳铁蛋白粉在230 nm处有1个极弱的吸收峰,说明存在羟基或者是氨基;340 nm处有1个吸收峰,说明存在几个共轭体系;蛋白空囊在220 nm左右处有1个吸收峰,是由于肽键引起的,在280 nm左右处有1个吸收峰,是由于含酪氨酸残基和色氨酸残基引起。图谱D没有明显的吸收峰,这可能是由于海参粉与乳铁蛋白粉相互作用导致的。曲线E与曲线C相比,吸收峰大致相同,但是曲线E的吸收峰强度减弱,海参粉的特征吸收峰不存在,说明海参粉成功包覆于微囊中。

图4 5种样品的固体紫外光谱图
2.4 红外光谱分析
如图5所示:曲线A为海参粉样品的红外吸收光谱,海参粉属于蛋白类物质所以含有大量氨基酸,曲线A在3 732 cm-1处有1个吸收峰,可以归属为—OH伸缩振动吸收峰,可能是—OH形成分子内氢键;3 315 cm-1处有1个吸收峰,可以归属为—NH2中的-NH伸缩振动特征吸收峰;2 921 cm-1处有1个吸收峰,可以归属为CH2中的—CH伸缩振动吸收峰;1 647 cm-1处有1个吸收峰,可以归属为C=O伸缩振动特征吸收峰;1 542 cm-1处有1个吸收峰,可归属为苯环中的C=C伸缩振动吸收峰;1 233 cm-1处有1个吸收峰,可以归属为C—C伸缩振动吸收峰;1 045 cm-1处有1个吸收峰,可以归属为C—O伸缩振动吸收峰。曲线B为乳铁蛋白粉样品的红外吸收光谱,在3 422 cm-1处有一个特征吸收峰,可归属为酰胺基中的N—H伸缩振动吸收峰;在2 927 cm-1处有1个吸收峰,可归属为C—H伸缩振动吸收峰;1 647 cm-1处有1个吸收峰,可以归属为—C=O伸缩振动吸收峰;1 537 cm-1处有1个吸收峰,可以归属为苯环的C=C振动吸收峰;1 394 cm-1处有1个吸收峰,可归属为C—N伸缩振动吸收峰;1 238 cm-1处有1个吸收峰,可以归属为C—C伸缩振动吸收峰;1 076 cm-1处有1个吸收峰,可以归属为C—O伸缩振动吸收峰。曲线C为空白微囊样品的红外吸收光谱,与曲线B相比,它们具有相同特征峰,说明乳铁蛋白制备成微囊后结构没有发生太大的变化。曲线D为海参粉和乳铁蛋白粉的物理混合物样品的红外吸收光谱,曲线D具有曲线A和B的特征峰。曲线E为海参粉微囊样品的红外吸收光谱,在3 372 cm-1处的特征峰消失;在3 294 cm-1处有1个吸收峰,可以归属为O—H或N—H伸缩振动吸收峰;在2 961 cm-1处有1个吸收峰,可以归属为C—H伸缩振动吸收峰;在1 654 cm-1处有1个吸收峰,可以归属为C=O伸缩振动吸收峰;1 239 cm-1处有1个吸收峰,可以归属为C—C伸缩振动吸收峰;1 077 cm-1处有1个吸收峰,可以归属为C—O伸缩振动吸收峰。由分析可知,海参粉样品中海参粉的特征峰消失或减弱,说明海参粉被包进微囊中,海参粉微囊制备成功[7-10]。

图5 5种样品的红外吸收光谱图
2.5 X射线衍射法(XRD)分析
由图6可知:曲线A说明海参粉在19.5°处存在明显的衍射峰;曲线B说明乳铁蛋白粉在19°处有衍射峰;曲线C与曲线B有一样的特征衍射峰;曲线D为海参粉与乳铁蛋白粉的物理混合样品,可以看出海参粉和乳铁蛋白粉的晶体衍射峰仍存在,但是衍射峰的强度减弱,这是可能是因为海参粉与乳铁蛋白粉相互作用所导致;图谱E为海参粉微囊,在19°处存在乳铁蛋白粉的特征衍射峰,海参粉的特征衍射峰消失,说明海参粉被成功包覆于微囊中。
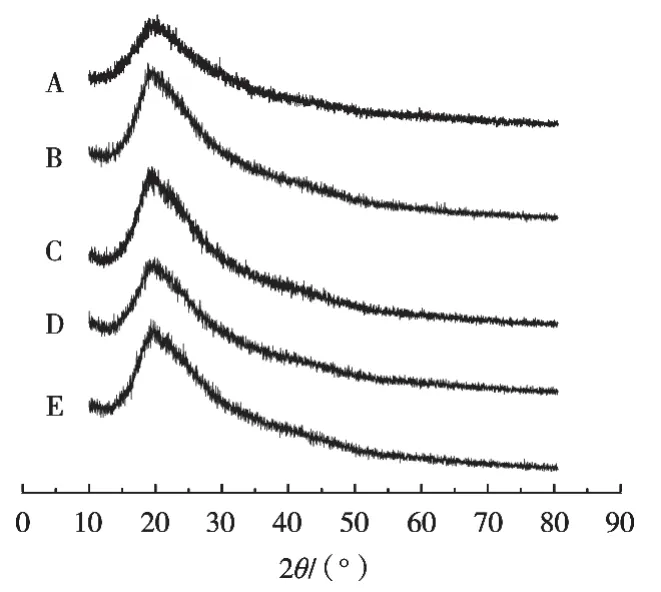
图6 5种样品的XRD分析图
3 讨论与结论
试验从囊材溶液浓度、进口温度、物料流量、风机频率等方面对微囊制备工艺进行研究考察,以微囊的形态为指标以确定最佳制备工艺。利用扫描电子显微镜拍摄微囊图片观察微囊形态并且分析海参粉有没有被包进微囊内。通过固体紫外、红外光谱、差示扫描量热法(DSC)、X射线衍射法(XRD)对微囊进行表征。
通过单因素试验法确定微囊的最佳制备工艺:乳铁蛋白溶液浓度5%、进风温度170 ℃、进料速度0.4 L/h、风机频率45 Hz。在生物显微镜下观察到,在此工艺下所制得的微囊圆整光滑、大小均一、无粘连现象,效果较好。粒径测定结果显示有67%分布在4~6 μm,粒径分布较均匀,效果较好。
利用扫描电镜拍摄海参粉、空白微囊、海参粉微囊3种样品,通过观察和比较可知,海参粉被成功制备成微囊,并且海参粉被完全包进微囊中。同时还观察到微囊的形态表面虽然光滑圆整,但大多数都有干瘪的现象,对此现象可能是因为壁材乳铁蛋白粉硬度较低、喷雾干燥时温度过高、电镜扫描时需要抽真空,这还需要进一步的研究证明。
除此之外,试验还将海参粉、乳铁蛋白粉、空白微囊、海参粉与乳铁蛋白粉的物理混合物、海参粉微囊5种样品一起进行固体紫外分析、红外光谱分析、X射线衍射法(XRD)分析。分析结果显示海参粉被成功包进微囊中[11-12]。
试验采用喷雾干燥法制备海参微囊,可以提高海参的稳定性,还可以掩盖海参的腥臭味,具有广阔应用前景。
