Corin基因多态性与血压钠钾反应性的相关性分析
2023-01-11牛泽家馨郭艳杰刘乃溶姚艳妮杨贝贝王佳馨刘盼盼杨长娥杜鸣飞胡桂霖张晓玉廖月圆王科科郭统帅高卫华牟建军
王 兰,牛泽家馨,郭艳杰,刘乃溶,姚艳妮,杨贝贝,王佳馨,李 闯,刘盼盼,杨长娥,杜鸣飞,胡桂霖,张 玺,王 丹,张晓玉,褚 超,廖月圆,马 琼,王科科,贾 昊,孙 月,郭统帅,高卫华,牟建军,汪 洋,5
(1.西安国际医学中心医院心内科,陕西西安 710100;2.西安交通大学第一附属医院心内科,陕西西安 710061;3.西北妇女儿童医院心内科,陕西西安 710003;4.西安市第一医院心内科,陕西西安 710002;5.西安交通大学全球健康研究院,陕西西安 710061)
高血压可导致心脑血管、肾脏和周围血管等重要靶器官的不可逆性损伤,已成为世界范围内最重要的单一死亡原因[1]。人体血压受复杂生理系统调节,同时受遗传和环境因素的共同作用[2]。在环境因素中,饮食高盐摄入似乎对血压的影响是最重要的。研究表明,个体血压变化与钠盐摄入量呈正相关,高盐引起血压升高,低盐会引起血压下降,称为血压的盐敏感性[3-4]。此外,血压与膳食钾摄入量呈现明显的负相关性,且不同个体的血压反应性不尽相同[5-6]。人群研究提示,血压对钠钾摄入量反应的异质性可能取决于个体等位基因变异[7-8]。因此,遗传变异与盐敏感性相关的识别将增强我们对生物血压调节机制的认识。
Corin是胰蛋白酶超家族的跨膜丝氨酸蛋白酶,它可以将心房利钠肽前体(pro-ANP)转化为具有生物活性的心房利钠肽(ANP),主要在心肌细胞中表达,参与高血压、心脏肥大的病理生理过程[9]。高血压和先兆子痫患者的家庭中也发现了Corin基因活性降低的突变[10]。然而,既往研究未能充分考虑该基因-环境对血压的影响,特别是关于饮食钠钾摄入的影响,因此可能忽视了该基因与环境的相互作用对血压变异的遗传贡献。有实验证据表明,Corin与盐敏感性高血压的发病机制有关[11]。WANG 等[12-13]发现Corin基因敲除小鼠表现出钠排泄减少和ANP合成受阻,这可能是盐敏感性高血压的一个重要机制。因此,本研究通过对既往建立的高血压队列进行慢性盐负荷及补钾干预实验,旨在探讨Corin基因的遗传变异与血压钠钾反应性的关系。
1 对象与方法
1.1 研究对象
本研究通过对陕西省宝鸡眉县地区18~60岁的成年人进行社区血压筛查,确定潜在先证者及其家系,纳入收缩压在130~160 mm Hg之间和/或舒张压在85~100 mm Hg之间且未使用降压药物的先证者及其兄弟姐妹、配偶和后代参与本研究。排除标准:继发性高血压,高血压2级及以上,心血管病史或糖尿病史,使用降压药物,怀孕,酗酒,正在低钠饮食或无法签署知情同意书者。最终纳入来自124个家庭的514名受试者,建立“盐敏感性高血压研究队列”并行基线调查,对其中的333名非父母者进行钠钾饮食干预研究。
1.2 饮食干预
慢性钠盐负荷及补钾干预方案参照本课题组既往研究[14-15]。首先为3 d基线调查,包括问卷调查、身高、体质量、血压、血尿生化参数等。此后依次为7 d低盐饮食(3 g氯化钠或51.3 mmol钠/d)、7 d高盐饮食(18 g氯化钠或307.8 mmol钠/d)和7 d高盐补钾饮食(高盐饮食基础上再加60 mmol/4.5 g氯化钾/d)。所有食物均为不加盐烹饪,此后由研究人员将预先分装好的钠盐及钾添加到每个受试者食物中。在整个研究期间,其他膳食营养摄入量保持不变。为了确保受试者对干预计划的依从性,其三餐(早餐、午餐和晚餐)被要求在指定餐厅进行,避免食用研究以外的食物。
1.3 24 h尿钠钾排泄量的测定
为保证受试者对饮食干预的依从性,在基线期的第3天及每个干预期的第7天收集24 h尿液标本,使用火焰光度计测定尿液中钠和钾的浓度。将所测得的钠、钾浓度乘以个体24 h尿液总容积,计算每个受试者的24 h尿钠、钾排泄量。
1.4 血压测量
受试者进行血压测量之前禁止吸烟、饮酒、进食刺激性食物及剧烈活动,静坐休息30 min,由专业人员按照korotkoff听音法测量右上臂坐位血压。于基线期每天和每阶段饮食干预期的第5、6、7天测量血压,每天测量3 次,每次间隔1 min,最终将各阶段9次血压的平均值纳入研究。具体血压测量方法参照本课题组既往研究[14-15]。平均动脉压、脉压计算公式为:平均动脉压=舒张压+1/3(收缩压-舒张压);脉压差=收缩压-舒张压。将血压的钠钾反应性视为连续变量,计算如下:低盐期血压反应性=低盐期血压-基线期血压;高盐期血压反应性=高盐期血压-低盐期血压;补钾期血压反应性=高盐补钾期血压-高盐期血压。
1.5 单核苷酸多态性(SNP)位点选择和基因分型
通过对美国国家生物技术信息中心数据库(http://www.ncbi.nlm.nih,gov/projects/SNP)和基因组变异服务器数据库(http://gvs.gs.washington.edu/GVS147)进行检索,采用HaploView 4.2 软件(Broad Institute,Cambridge,MA,USA)在中国北京汉族(CHB)和亚洲人群数据库中筛选Corin基因中的标签SNP位点,具体筛选标准:该标签位点SNP 频率分布符合Hardy-Weinberg平衡定律(P≥0.05),次要等位基因频率(minor allele frequency,MAF)P≥0.05,且连锁不平衡系数r2≥0.8。最终纳入15个Corin基因相关的SNP位点进行后续分析,分别为rs12641823、rs2271037、rs6834933、rs2271036、rs78911825、rs2351783、rs10049713、rs10517195、rs17654278、rs3749584、rs4695253、rs36090894、rs6823184、rs12509275、rs73814824。
采集全部受试者外周静脉血,应用Gold Mag-Mini纯化试剂盒(Gold Mag有限公司,中国)提取外周血脱氧核糖核酸(deoxyribonucleic acid,DNA)。通过Mass ARRAY 检测平台对15个Corin基因有关的SNP位点进行分型。基因分型实验均由北京博奥晶典生物技术有限公司完成。
1.6 统计学分析
统计分析采用SPSS 22.0软件进行。连续变量以均数±标准差()表示,分类变量以n/%表示。采用独立样本t检验进行两组之间的比较,采用方差分析进行多组间比较。使用PLINK软件(version 1.9)通过精确检验法对选取父母受试者的基因型进行平衡检验和孟德尔一致性检验,计算各基因型的MAF。利用PLINK 软件在不同遗传模型(加性模型、显性模型和隐性模型)下构建混合线性回归模型。将年龄、性别和体质量指数作为固定效应,家系相关性作为随机效应在模型中进行校正。P<0.05为差异有统计学意义。
2 结果
2.1 受试者基线特征及血压的钠钾反应性
受试者基线特征及钠钾饮食干预的血压反应如表1所示。基线期先证者组的舒张压及平均动脉压在各组中最高,而收缩压低于其父母组。在钠钾饮食干预过程中,各阶段血压均发生了变化,低盐期呈下降趋势,高盐期呈上升趋势,高盐补钾后的血压则再次下降。
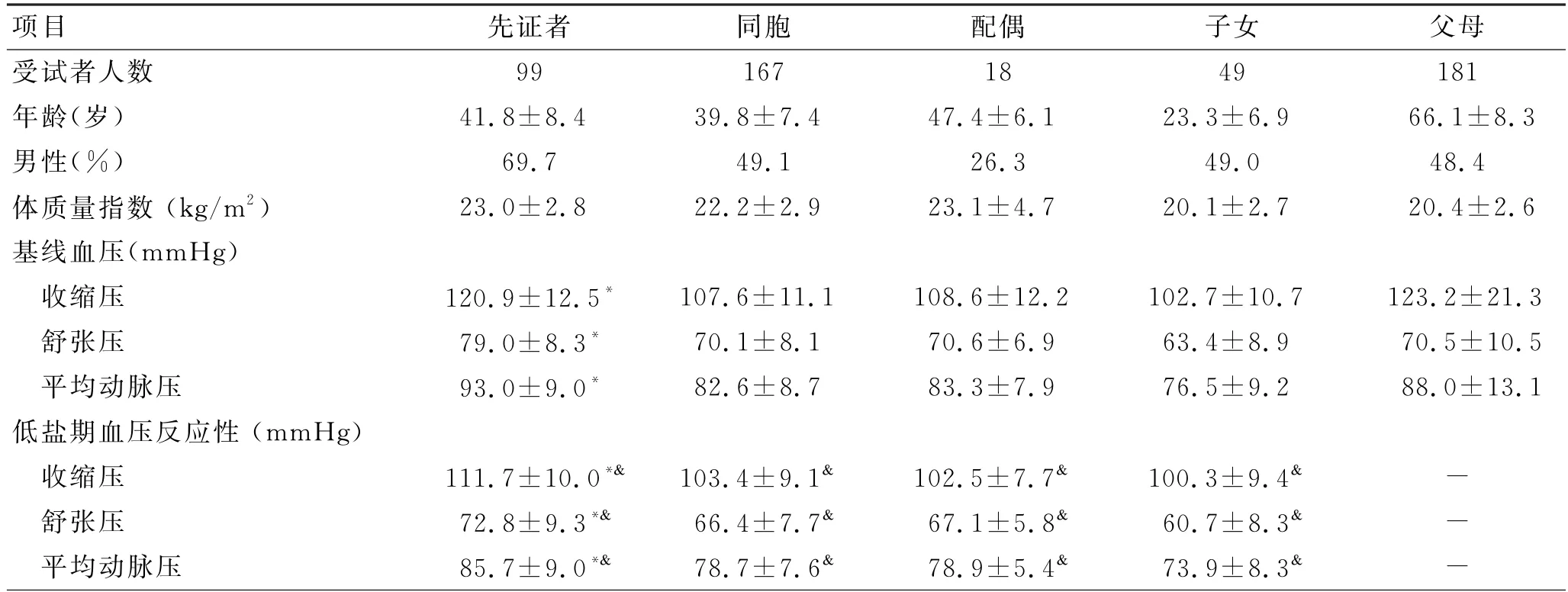
表1 受试者基线特征及饮食干预的血压反应Tab.1 Baseline characteristics and BP responses to dietary intervention

续表1
2.2 钠钾干预对受试者24 h尿钠和钾排泄的影响
各干预期受试者尿钠、钾排泄情况如表2所示,其与膳食钠钾摄入量的趋势类似。24 h尿钠排泄量在低盐期明显低于基线期,而在高盐负荷后则显著增加;此外,补钾可显著升高24 h尿钾排泄量(均P<0.05)。以上结果说明受试者对饮食干预的依从性良好。
表2 各干预期受试者尿钠、钾排泄情况Tab.2 Urinary excretions of sodium and potassium in subjects during the intervention periods (,mmol)

表2 各干预期受试者尿钠、钾排泄情况Tab.2 Urinary excretions of sodium and potassium in subjects during the intervention periods (,mmol)
与基线期比较,*P<0.05;与低盐期比较,#P<0.05;与高盐期比较,§P<0.05。
2.3 Corin基因SNP位点信息
符合纳入排除标准的15个Corin基因SNP 位点的基本信息如表3所示,包括基因型、位点位置、等位基因、次要等位基因频率、Hardy-Weinberg检验和功能预测。各SNP 位点基因型分布频率均符合Hardy-Weinberg平衡定律,说明受试人群具有群体代表性。

表3 Corin基因SNPs基本信息Tab.3 Information on SNPs of Corin gene
2.4 Corin基因SNPs与血压钠钾反应性的关联分析
如表4所示,在低盐期,rs12509275位点与舒张压反应性显著相关,而rs3749584与脉压反应性显著相关。在高盐期,rs3749584、rs10517195与脉压反应性显著相关。在高盐补钾期,rs17654278 与收缩压反应性显著相关,rs2271037与舒张压反应性显著相关,rs4695253、rs12509275、rs2351783、rs36090894与脉压差反应性显著相关。

表4 Corin基因SNP位点与血压钠钾反应性的关系Tab.4 Associations of Corin SNPs with blood pressure response to dietary intervention

续表4
3 讨 论
Corin基因由22 个外显子组成,在4 号染色体上,长度约为200 kb[16]。此前有研究表明Corin 基因变异与非裔美国人高血压发生相关[17-20]。CHAN等[11]发现,与野生型小鼠相比,Corin基因敲除小鼠的血压升高。他们进一步发现在Corin基因敲除小鼠中,ANP前体转化为ANP 受阻,导致高血压和心肌肥大[11]。此外,在不同人群中也报道了Corin 基因变异与高血压的相关性。有研究发现在中国汉族人群中,Corin SNP 位点rs2271037、rs3749585与高血压风险增加相关[21]。DRIES等[18]发现在三个不同的队列中(达拉斯心脏研究、动脉粥样硬化多民族研究、芝加哥高血压遗传学研究),次要Corin T555I/Q568P等位基因与高血压风险增加独立相关。此外,ZHANG等[10]也发现Corin基因的插入突变c.102_103insA更易出现在中国的高血压患者中。WANG[13]等研究发现,重组Corin变异T555I/Q568P的ANP活性受损,Corin基因的遗传变异可能降低体内Corin活性,导致黑人高血压。以上研究提示,Corin基因变异与高血压易感性之间的关联是由异常的ANP活性所致。
本研究首次探索Corin多态性与血压对盐的反应性的关系,结果发现Corin SNP 位点rs12509275位点与舒张压反应性显著相关,而rs3749584与脉压反应性显著相关。此外,在高盐期,rs3749584、rs10517195与脉压反应性显著相关。本研究提示Corin基因变异可能参与血压盐敏感性的形成。既往动物实验也证实了这一发现。在表达Corin基因T555I/Q568P变异的转基因小鼠中,心肌中的ANP前体水平显著升高,并更易出现盐敏感性高血压和心脏肥大[18]。WANG 等[12-13]研究表明,高盐饮食能够显著升高Corin基因敲除小鼠的血压水平,而在野生型小鼠中没有观察到这种变化。然而,Corin如何通过调节ANP系统影响盐敏感性的具体机制尚不清楚。ANP通路通过抑制水通道蛋白2(AQP2)和β-上皮钠通道(β-ENaC)在血压调节方面发挥重要作用。POLZIN 等[22]研究显示,在Corin 基因敲除小鼠中肾脏ENaC表达增加,提示Corin可能下调肾脏ENaC表达和活性。ZHAO 等[23]认为,ANP 介导的远端肾单位钠重吸收抑制对促进尿钠排泄至关重要。此外,高盐摄入导致细胞外液增加。由于心输出量增加和容量依赖性因素,血压可能会增加[24]。随着细胞外液的增加,Corin可能会被激活。因此,Corin可能通过这些途径影响血压的钠离子稳态、细胞外液和盐敏感性。有关Corin与血压盐敏感性的关系有待于更多的功能研究来阐明。
流行病学研究表明,饮食钾干预量与血压呈负相关,且个体血压对钾摄入量的反应存在差异性[25-27]。内皮素1(EDN1)、一氧化氮合酶3(NOS3)及E 选择素(SELE)基因多态性与补钾的降压反应均密切相关[7]。此外,GenSalt研究发现,APLN 和ACE2基因SNP 位点与饮食钾补充后的血压反应显著相关[28]。GU 等[29]提出,膳食钾补充引起的血压反应在中国人群中存在中等遗传力。本课题组既往队列研究发现,抗衰老因子KLOTHO、脂肪素AdipoQ及蛋白激酶SGK1基因多态性与补钾的血压反应性显著相关[15,30-31]。这些研究表明,遗传因素可能导致了血压对钾摄入量反应的变化。本研究首次讨论了Corin基因多态性与补钾干预的血压反应性之间的关系,发现在高盐补钾期,rs17654278与收缩压反应性相关,rs2271037 与舒张压反应性显著相关,rs4695253、rs12509275、rs2351783、rs36090894 与 脉压差反应性相关,提示Corin遗传变异可能参与了血压钾敏感性的形成。
综上,本研究首次发现Corin基因多态性与血压对饮食钠钾干预的反应显著相关,这有助于从遗传学角度进一步理解钠钾敏感性血压形成机制并为高血压的防治工作提供思路。考虑到本研究存在样本量相对较小且受试者局限于中国北方人口等不足之处,因此,膳食钠钾盐的摄入与Corin基因多态性的关系及其在高血压发生发展中的作用等方面的临床意义还有待大规模前瞻性研究予以证实。
