不同茶树品种鲜叶多糖的理化性质和抗氧化活性比较研究
2023-01-11陈薛左欣欣徐安安徐平王岳飞
陈薛,左欣欣,徐安安,徐平,王岳飞
浙江大学茶叶研究所,浙江 杭州 310058
多糖是一类由单糖分子通过糖苷键结合而成的大分子化合物,广泛存在于植物、动物和微生物中[1]。多糖不仅是构成细胞的重要物质,为机体提供必要能量,还具有调节免疫[2-3]、抗氧化[4-5]、抗肿瘤[6]、降血糖[7-8]、调节肠道菌群[9]等广泛的生物活性。多糖由于具有来源广泛和毒副作用低等优点[10],被认为是一类具有广泛应用潜力的天然活性物质。
茶多糖(Tea polysaccharides,TPS)是从茶叶中提取出来的一种结构复杂的大分子物质。在自然状态下,茶多糖主要以糖共轭物的形式存在,即各种不同的单糖聚合后,又与多酚、蛋白质、糖醛酸等结合形成大型的复合物质[11]。体内外试验表明,茶多糖具有抗氧化、抗肿瘤、抗菌、抗皮肤老化、降血糖、增强免疫力等作用[12-15]。已有的茶多糖相关研究主要关注不同成品茶中的多糖,但由于不同茶类在原料来源和加工工艺上的差异,导致茶多糖在性质和功能上存在区别,使得对茶多糖的研究缺乏一致性结论[16],限制了茶多糖资源的开发利用。因此,本研究以同一茶园具有代表性的黄金桂、铁观音、祁门种、六堡茶、大红袍、槠叶齐、龙井 43、白叶1号、中黄1号和福鼎大白茶10个茶树品种鲜叶为原料,直接进行微波干燥固样,然后通过水提、醇沉、脱蛋白、透析、浓缩和冷冻干燥等程序制备10个不同茶树品种的多糖,分别命名为 HTPS、TTPS、QTPS、LTPS、DTPS、ZTPS、LJTPS、BYTPS、ZHTPS、FDTPS。比较研究不同茶树品种来源的茶多糖在理化性质和体外抗氧化方面的差异,以期从品种角度为茶多糖在加工过程中的衍变提供基础,为今后基于茶多糖的特异性茶树品种筛选提供参考。
1 材料与方法
1.1 材料与试剂
于2021年5月至6月在杭州市农业科学研究院茶叶研究所基地(120°09′E,30°16′N)采收黄金桂、铁观音、祁门种、六堡茶、大红袍、槠叶齐、龙井43、白叶1号、中黄 1号和福鼎大白茶等10个茶树品种鲜叶,鲜叶采摘标准均为一芽三叶,分别进行标记和编号后及时微波干燥固样,然后置于 60℃烘箱中烘干。
无水乙醇、丙酮、乙醚、氯仿、正丁醇、福林酚、碳酸钠、磷酸、蒽酮、硫酸、过硫酸钾、无水乙酸钠、乙酸、盐酸、硫酸亚铁、三氯化铁、氢氧化钠均购于国药集团化学试剂有限公司,无水葡萄糖、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、三氟乙酸、1-苯基-3-甲基-5-吡唑啉酮(PMP)均购于上海麦克林生化科技有限公司,没食子酸、考马斯亮蓝G250、牛血清蛋白、咔唑、2,6-二叔丁基对甲酚(BHT)、2,4,6-三吡啶基三嗪(TPTZ)均购于上海阿拉丁生化科技股份有限公司,1,1-二苯基-2-苦肼基(DPPH)购自美国Sigma-Aldrich公司,鼠李糖(Rha)、半乳糖(Gal)、岩藻糖(Fuc)、葡萄糖(Glc)、甘露糖(Man)、阿拉伯糖(Ara)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)均购于上海源叶生物科技有限公司,平均分子量分别为667、413、76.9、43.5、10.5、5 kDa 的葡聚糖购于美国Sigma公司。
1.2 仪器与设备
Infinite M200 PRO酶标仪,上海帝肯贸易有限公司;SCIENTZ-12N冷冻干燥机,宁波新芝生物科技股份有限公司;ND100-1氮气吹扫仪,杭州瑞诚仪器有限公司;ST16高速离心机,赛默飞世尔科技有限公司;WH-861旋涡混合器,太仓华利达实验设备有限公司;XL-130多功能粉碎机,永康市小宝电器有限公司;LBAO-80A精密鼓风干燥箱,上海施都凯仪器设备有限公司;1200 Series高效液相色谱仪,安捷伦科技有限公司;Waters 1525凝胶色谱仪,美国Waters公司;NICOLET iS50傅立叶红外分光光度计,赛默飞世尔科技有限公司;SU8010扫描电镜,日本日立公司;Zetasizer3000HSA纳米粒度电位分析仪,英国Malvern公司。
1.3 试验方法
1.3.1 茶多糖的提取
参照邵淑宏[17]的方法,干燥后的茶样经研磨过80目筛后以料液比1∶10(m∶V)加入80%乙醇,静置24 h以去除大部分多酚、单糖和脂溶性成分,随后进行抽滤,收集残渣并置于空气中干燥,用预热至 70℃的蒸馏水以料液比 1∶10(m∶V)于 70℃的水浴锅中搅拌浸提 1 h,重复提取两次,合并萃取液。萃取液在 50℃左右用旋转蒸发器浓缩,然后加入4倍体积的95%乙醇,并于4℃条件下放置24 h,过滤后以 6 000 r·min-1的速度离心 10 min,收集沉淀。用乙醇、丙酮、乙醚交替洗涤沉淀物3次。再将沉淀物溶于70℃热水,用Sevag法脱蛋白,在蒸馏水中透析48 h(透析膜,7 000 Da),将截留物浓缩后再加入4倍体积的95%乙醇,放置24 h,使多糖沉淀。离心后,将沉淀物用60℃的水溶解,旋转蒸发去除酒精残留,置于-16℃冰冻,然后转至冷冻干燥机脱水干燥。按以下公式计算茶多糖得率:
式中,m1表示干燥后的多糖质量,m表示茶样干质量
1.3.2 茶多糖的基本组成测定
采用 GB/T 8313—2018[18]方法进行茶多糖中多酚含量的测定;采用考马斯亮蓝法进行茶多糖中蛋白质含量的测定[19];采用蒽酮硫酸法进行茶多糖中中性糖含量的测定[20];采用咔唑法进行茶多糖中糖醛酸含量的测定[21]。
1.3.3 单糖组分测定
参照邵淑宏[17]的方法,色谱条件:色谱柱为 TC-C18(4.6 mm×250 mm,5μm,Agilent Technologies Inc,USA),柱温为35℃,检测波长为 250 nm,流速为 1 mL·min-1,进样量10 μL。流动相 A为纯乙腈,B为 0.05 mol·L-1磷酸盐缓冲液(pH=6.8)。梯度洗脱,0~10 min B相85%;10~30 min,B相85%~79%;30~40 min,B相79%;40~45 min,B相79%~85%;45~50 min,B相85%。
这种玩法让陈小华不能理解,他坦承虽然当时58到家对高额补贴的后果看得不像今天这么透,但是这个模式肯定到不了58到家要的彼岸,所以一定是错误的。
单糖标准品制备:配制2 mmol·L-1标准单糖溶液和2 mmol·L-1混合标准品溶液,溶液过0.22 μm滤膜后摇匀。
多糖酸解:称取10 mg多糖于密封瓶中,加入 2 mL三氟乙酸(3 mol·L-1)溶解,置于110℃烘箱中烘5 h,冷却至室温后,用NaOH(3 mol·L-1)调节 pH 至 7.0,于 50℃下进行氮吹,冷冻干燥,加1 mL蒸馏水溶解备用。
PMP衍生化:取茶多糖样品及单糖标准品溶液各 400 μL,依次加入 450 μL的 NaOH溶液(0.3 mol·L-1)和 450 μL 的 PMP 甲醇溶液(0.5 mol·L-1)。混合均匀后在 70℃水浴中反应30 min,冷却至室温,用450 μL HCL溶液(0.3 mol·L-1)中和。加入 1.0 mL 氯仿萃取,涡旋 1 min,8 000 r·min-1离心 5 min,弃去下层氯仿层,收集上层液,重复3次。取上层液用0.22 μm滤膜过滤于液相瓶中待测。
1.3.4 结构对比分析
分子量测定:采用凝胶色谱仪测定样品的分子量。色谱条件:TOSOH BIOSEP G4000SWXL(7.8 mm×300 mm)色谱柱,流动相为 0.1 mol·L-1硝酸钠溶液,检测器为Waters 2414示差折光检测器,柱温40℃,进样量为 50 μL。
Z-average粒径和Zeta电位测定:配制浓度为 1 mg·mL-1的茶多糖水溶液,并用 0.22 μm滤膜过滤待测。采用纳米粒度电位分析仪进行测定。
红外光谱(IR)测定:将1 mg干燥的样品粉末与100 mg KBr固体粉末在玛瑙研钵中研磨均匀,用压片机压成薄片,用傅立叶红外分光光度计在 4 000~400 cm-1范围内进行扫描,观察峰谱情况。
扫描电子显微镜(SEM)测定:取适量的茶多糖样品粘着于实验台的导电胶上,表面喷金处理后在扫描电镜下观察,选择适当的放大倍数及代表性的视野照相记录。
1.3.5 体外抗氧化能力测定[22]
DPPH自由基清除能力:将各待测样品配制成不同质量浓度的水溶液(200~2 000 μg·mL-1)。吸取1 mL样品溶液与3 mL DPPH乙醇溶液混合,室温避光放置30 min,于517 nm处测吸光度值A样品。1 mL样品溶液与3 mL无水乙醇溶液混合为空白对照A空白,DPPH乙醇溶液为对照A对照,以BHT溶液为阳性对照。DPPH自由基清除能力计算公式如下:
ABTS自由基清除能力:将各待测样品配制成不同质量浓度的水溶液(100~2 000 μg·mL-1)。吸取100 μL样品溶液并加入3 mL ABTS工作液,充分混匀,室温下避光反应6 min,于734 nm处测吸光度值A样品(10 min内吸光度保持稳定)。以蒸馏水为空白对照A空白,以 BHT溶液为阳性对照。ABTS自由基清除能力计算公式如下:

铁离子还原能力的测定:分别吸取0.5 mL不同浓度的 FeSO4溶液(25~1 500 μmol·L-1)与 0.5 mL TPTZ 的 HCL 溶液(10 mmol·L-1)和 5 mL 醋酸-醋酸钠缓冲液(300 mmol·L-1,pH=3.6)混合,593 nm测定吸光度。以FeSO4溶液的浓度为纵坐标,吸光度为横坐标绘制标准曲线,测定FRAP工作液在593 nm的吸光度A反应前,作为对照。将各待测样品配制成不同质量浓度的水溶液(400~2 800 μg·mL-1),吸取0.6 mL样品溶液并加入4.5 mL FRAP工作液,充分混匀,室温下避光放置8 min,于593 nm 处测吸光值A反应后。以(A反应前-A反应后)的差值在标准曲线上获得抗氧化物质相应的FeSO4的浓度,定义为 FRAP值。以 BHT溶液为阳性对照。
1.4 数据统计与分析
每个茶多糖样品进行3次测定重复,最终结果以“平均值±标准差”表示;采用SPSS 26.0软件对数据进行整理、差异显著性检验(P<0.05)、描述统计及Pearson相关性分析,使用R语言进行主成分分析(Principal component analysis,PCA);使用 Prism 8.0和 Origin 2019b软件作图。
2 结果与分析
2.1 茶树品种间多糖基本组成分析
2.1.1 茶树品种间多糖得率比较
不同茶树品种多糖的得率测定结果如图1-A所示,10个不同茶树品种多糖得率的差异较大。多糖得率较高的茶树品种为龙井43和福鼎大白茶,分别为2.31%和2.02%;铁观音的多糖得率最低,仅为0.67%;其余7个品种的多糖得率在 1%~2%。不同茶树品种之间多糖得率最大相差约 3.45倍,表明不同茶树品种的多糖含量有明显差异。

图1 10个茶树品种鲜叶及其多糖得率与多糖组成成分Fig. 1 Extraction rate and main polysaccharide components in the fresh leaves of 10 tea cultivars
2.1.2 茶树品种间多糖的化学组成比较
10个茶树品种多糖中的多酚、蛋白质、中性糖和糖醛酸含量如图1-B所示,不同茶树品种间多糖的中性糖、糖醛酸、蛋白质和多酚含量均存在显著差异。10个茶多糖的中性糖含量在14.14%~24.85%,其中六堡茶多糖的中性糖含量最高,达24.85%;而白叶1号多糖的中性糖含量最低,仅为 14.14%;黄金桂、铁观音和祁门种多糖的中性糖含量较接近,约为22%;大红袍、槠叶齐、中黄1号和福鼎大白茶多糖约为 17%。10个茶多糖的糖醛酸含量在 38.82%~64.14%,其中铁观音多糖(64.14%)和祁门种多糖(60.32%)的糖醛酸含量达60%以上;而白叶1号多糖的糖醛酸含量最低,仅为 38.82%;黄金桂、六堡茶、大红袍和槠叶齐多糖的糖醛酸含量较接近,约为45%,表明茶多糖是一类酸性多糖。
由图1-B可知,各茶树品种的多糖中仍含有微量的蛋白质和多酚,这表明即使在去除杂质和脱蛋白之后,多糖中的某些蛋白质或多酚也可能存在。10个茶树品种多糖的蛋白质含量在 2.21%~4.15%,白叶 1号最高,龙井 43最低;祁门种和六堡茶多糖的蛋白质含量也较高,均在4%以上。10个茶树品种多糖结合的多酚含量总体不高(1.01%~2.98%),但其存在显著差异。其中白叶1号多糖的多酚含量最高,达2.98%,与中性糖、糖醛酸测定结果相反;龙井43多糖的多酚含量最低,仅为1.01%,与蛋白质含量测定结果一致。
2.1.3 茶树品种间多糖的单糖组分比较
如表1所示,不同茶树品种的多糖主要由半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,这 4个单糖组分占比达 80%以上。其中,10个不同茶树品种多糖的半乳糖醛酸含量差异较大,最高的龙井43多糖可达38.76%,最低的六堡茶多糖仅为17.04%。黄金桂、六堡茶、福鼎大白茶 3个品种多糖的葡萄糖含量高达20%以上,其余7个品种多糖则具有更高的半乳糖和阿拉伯糖含量。值得注意的是,白叶1号多糖的甘露糖含量最高,为1.75%;福鼎大白茶多糖的鼠李糖含量最低,仅为0.42%。
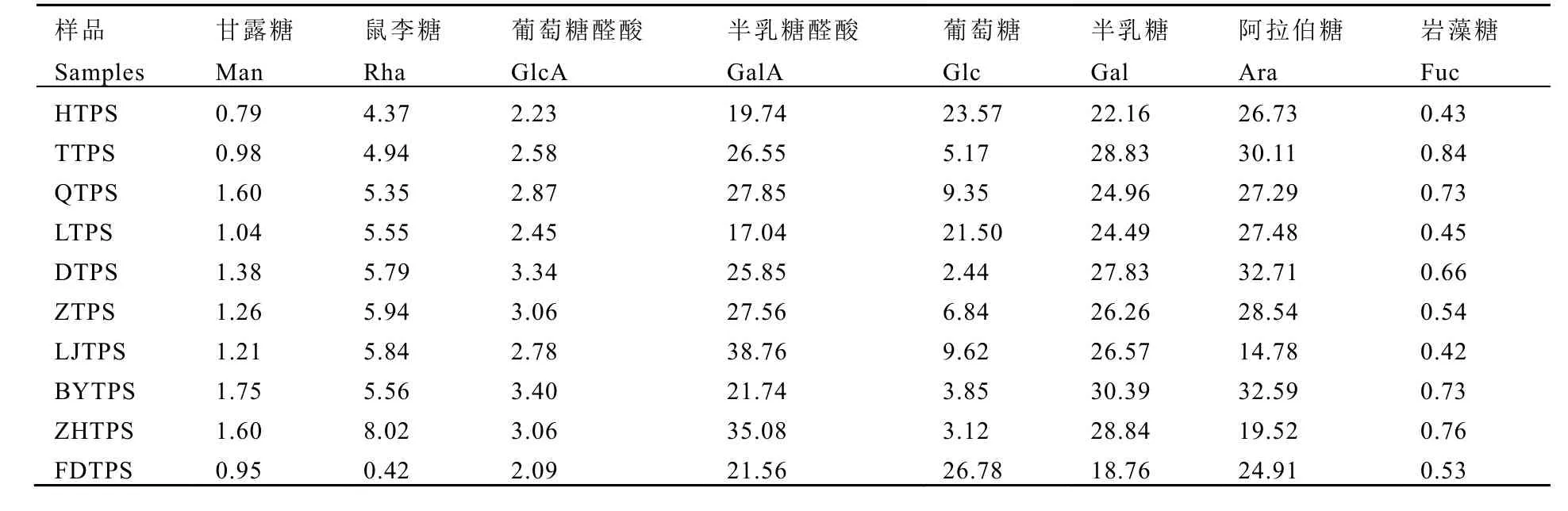
表1 10个茶树品种多糖的单糖组分表Table 1 Monosaccharide components of TPS in the fresh leaves of 10 tea cultivars%
2.2 茶树品种间多糖基本组成主成分分析
将10个不同茶树品种多糖的化学组成及其单糖组分进行主成分分析(PCA),结果如图2所示。主成分1和主成分2分别解释了总方差的42.4%和26.0%,揭示了白叶1号多糖和龙井43多糖与其他8个茶树品种茶多糖之间的显著差异。PCA将10个不同茶树品种多糖分隔开来,其中福鼎大白茶和黄金桂多糖距离较近,这可能是由于其蛋白质和多酚含量相差较小。白叶1号多糖和龙井43多糖与其他茶树品种多糖距离较远,表明白叶1号多糖和龙井43多糖在基本组成上存在明显差异。

图2 10个茶树品种多糖的基本组成PCA图Fig. 2 Principal component analysis (PCA) of TPS in the fresh leaves of 10 tea cultivars
2.3 茶树品种间多糖结构分析
2.3.1 分子量分析
由表2可知,10个不同茶树品种多糖的分子量分布大多具有2个峰,总体而言,其分子量的数量级在 103~106,与蛋白类物质的分子量接近,这与生化成分分析、红外结果分析相同,再次说明这10个茶多糖是一种与蛋白类物质相结合的多糖复合物。10个茶多糖的分子量分布有较大差异。由于峰1在每个品种多糖中占较大比例(60%),故以此部分进行分析。10个不同茶树品种多糖中龙井43多糖的分子量最低,仅为7.10×105Da。

表2 10个茶树品种多糖的分子量分布Table 2 Distributions of molecular weight (Mw) of TPS in the fresh leaves of 10 tea cultivars
2.3.2 Z-average粒径和Zeta电位分析
多糖粒径的分布对其分子相互作用、空间结构、相关物理性质和生物活性有重要影响。如表3所示,10个茶树品种多糖的粒径分布范围为238.02~633.37 nm,相对较大,推测可能是由于多糖的不稳定性,在分散液体系中,多糖聚集形成较大颗粒尺寸的粒子。Zeta电位是测量溶液中大分子或颗粒物中吸引力和排斥力强度的关键指标,反映了多糖溶液的稳定性。电位值的绝对值越大,其粒子间产生的静电作用强度越大,溶液越趋于稳定。10个茶树品种多糖溶液的 Zeta电位值为-27.27~-7.08 mV,均为负数,表明茶多糖的多糖链中存在阴离子基团,具有提供电子的能力,进一步证明了 TPS是酸性多糖复合物。黄金桂、六堡茶、白叶1号和福鼎大白茶多糖的绝对Zeta电位值较高(P<0.05),这可能是由于其葡萄糖含量较高导致其导电性较好。槠叶齐和龙井43多糖的绝对Zeta电位值较低,表明其稳定性较差;其余8个茶树品种多糖的绝对Zeta电位值较高(P<0.05),说明它们具有较高的分子间斥力,其溶液更稳定(P<0.05)。

表3 10个茶树品种多糖的粒径和电位分布表Table 3 The Z-average particle size and the Zeta potential distribution of TPS in the fresh leaves of 10 tea cultivars
2.3.3 红外光谱分析
10个茶树品种多糖的红外分析图谱如图3所示。各茶树品种多糖存在类似的特征吸收峰,3 420 cm-1左右的宽峰是O-H和N-H的伸缩振动峰[23],表明存在分子间和分子内的氢键;在3 000~2 900 cm-1的峰是C-H的伸缩振动峰,1 440 cm-1左右的峰是由C-H变角振动引起,均是糖类的特殊峰[24],由这两组峰可初步判断该化合物为糖类化合物;1 740 cm-1左右的峰为-COOH的C=O伸缩振动吸收峰,与糖醛酸密切相关;1 651~1 636 cm-1处的吸收峰是 N-H的变角振动引起的,是蛋白质的特征峰,能够进一步证实茶多糖为含有蛋白质的糖共轭物;1 140 cm-1的强吸收峰是吡喃环的醚键(C-O-C)和羟基的变角振动吸收峰[25],1 100 cm-1和 1 020 cm-1处的小尖峰是 C-O的伸缩振动峰,916 cm-1左右是呋喃环的对称伸缩振动吸收峰,由此推测各茶树品种多糖为同时含有吡喃环和呋喃环的糖蛋白共轭物。10个茶树品种多糖的主要吸收峰虽然差异不大,但可以发现铁观音和祁门种多糖在1 740 cm-1处特征吸收峰最为明显,证明糖醛酸含量高;而白叶1号多糖在1 740 cm-1处特征吸收峰小且不明显,表明糖醛酸含量低,这些结果均与生化分析结果一致。

图3 10个茶树品种多糖的红外光谱图Fig. 3 IR spectra of TPS in the fresh leaves of 10 tea cultivars
2.3.4 扫描电镜(SEM)分析
图4为10个茶树品种多糖的表面形貌图。由图4可看出,除福鼎大白茶多糖外,其余茶树品种多糖在低倍镜(200×)下为表面多孔的片状结构(图4-A);而在高倍镜(30 000×)下,这9个不同茶树品种多糖具有由海绵状颗粒组成的粗糙、不平坦的表面(图4-B);其中大部分茶树品种多糖含有球状嵌合体,这可能是蛋白结合物。福鼎大白茶多糖在低倍镜下为许多片状的碎片聚集体,规则性不强,表明福鼎大白茶多糖主要为无定型结构;在高倍镜下,福鼎大白茶多糖为无规则颗粒状组成的聚集体,说明福鼎大白茶多糖无晶体结构,是一种无定型结构的固体物质,这可能是由于糖醛酸和蛋白类大分子含量少,颗粒之间的相互作用点较少,作用力较小,从而聚集程度低。

图4 10个茶树品种多糖的SEM图像Fig. 4 SEM image of TPS in the fresh leaves of 10 tea cultivars
2.4 茶树品种间多糖体外抗氧化能力分析
通过DPPH自由基清除能力、ABTS自由基清除能力和铁离子还原能力评价不同茶树品种多糖的抗氧化能力。如图5所示,不同品种来源的茶多糖抗氧化活性存在显著差异。其中,白叶1号多糖对DPPH自由基、ABTS自由基的清除能力最强,龙井 43多糖对 DPPH自由基、ABTS自由基的清除能力最弱。且10个茶树品种多糖对两种自由基的清除能力表现出相对一致性。此外,六堡茶多糖的铁离子还原能力最强,其次是白叶 1号多糖,龙井43多糖铁离子还原能力最弱。

图5 10个茶树品种多糖的体外抗氧化能力Fig. 5 In vitro antioxidant activity of TPS in the fresh leaves of 10 tea cultivars
2.5 茶树品种间多糖抗氧化活性与理化性质相关性分析
为探讨不同茶树品种多糖的抗氧化活性与理化性质之间的关系,本研究采用皮尔逊相关系数进行分析。由图6可知,不同茶树品种多糖清除 DPPH自由基的半抑制浓度与其所含的多酚含量呈极显著负相关(P<0.01),与蛋白质含量呈显著负相关(P<0.05);清除ABTS自由基的半抑制浓度与多酚含量和蛋白质含量呈极显著负相关(P<0.01);在FRAP体系中,当多糖样品浓度为最高浓度(2.8 mg·mL-1)条件时,铁离子还原能力与多酚含量和蛋白质含量呈极显著正相关(P<0.01)。多糖清除ABTS自由基能力与清除 DPPH自由基的能力之间呈现极显著的正相关(P<0.01),进一步说明多糖清除ABTS自由基和清除DPPH自由基的作用机理在某些方面是相似的。不同茶树品种多糖的多酚含量与其所含的甘露糖含量具有显著正相关关系(P<0.05)。不同茶树品种多糖的分子量与其所含的半乳糖醛酸含量呈显著负相关(P<0.05)。多糖清除DPPH自由基、ABTS自由基和铁离子还原能力与多糖中的中性糖、糖醛酸含量没有显著相关性,这说明茶多糖清除自由基的能力与多糖的主要生化成分无明显的量效关系,由此可以推测茶多糖与多酚、蛋白质等结合所形成的特有的结构特征对其生物活性可能有更显著的影响。

图6 10个品种茶多糖的理化性质与抗氧化活性的皮尔逊相关性分析热图Fig. 6 Pearson correlation analysis of the physical and chemical properties and antioxidant activity of TPS in the fresh leaves of 10 tea cultivars
3 讨论与结论
本研究结果表明,10个茶树品种多糖的中性糖、糖醛酸、蛋白质、多酚含量存在显著差异。白叶 1号多糖的多酚和蛋白质含量最高,中性糖和糖醛酸含量最低;龙井43多糖的多酚和蛋白质含量最低。茶多糖是一种容易结合多酚和蛋白质的大分子复合物,主要由中性糖、糖醛酸构成,洗脱之后多糖中仍含有少量的多酚和蛋白质,表明有部分多酚和蛋白质可能是通过共价键相互链接。茶叶中的多酚类物质是重要的天然抗氧化剂之一[26]。研究表明,茶多糖中残留的多酚是茶多糖发挥抗氧化性的主要物质基础,纯化会降低茶多糖的抗氧化活性[27]。因此,茶多糖中的多酚结合量高低也为后续研究茶多糖抗氧化活性提供了思路。白叶1号作为高氨基酸的茶树品种,与其他品种相比,多酚含量较低[28];但本研究表明,白叶1号多糖的多酚含量是10个茶树品种多糖中最高的,表明白叶1号多糖对多酚的亲和度较好,这可能与茶树品种本身多酚的组分不同有关,酚类物质在自然界中可能与多糖发生结合[29-31]。不同茶树品种多糖的单糖组分主要由半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,但其摩尔比存在显著差异。PCA分析进一步表明,白叶1号和龙井43与其他茶树品种在多糖的基本组成上具有较大差异,这种差异的特异性值得进一步深入研究。
红外光谱测定结果显示,白叶1号多糖在1 740 cm-1处特征吸收峰小且不明显,表明糖醛酸含量低,这可能与其多酚含量较高有关。龙井43多糖的分子量、粒径和绝对Zeta电位值最低。一般分子量较低的多糖结构可能表现出更高的生物活性[32-33],因为多糖是极性大分子物质,多糖链上存在大量羟基之间的分子内或分子间氢键作用,引发各种构象,溶液粘度高,传质较困难,其生物活性易受到影响;而分子量较低的多糖可以自由地通过生物膜以逃避免疫系统的压力[34],表现出较好的生物活性。
体外抗氧化活性结果表明,10个茶树品种多糖均具有清除DPPH自由基和ABTS自由基的能力,其中多酚和蛋白质含量最高的白叶1号多糖抗氧化活性最高,多酚和蛋白质含量最低的龙井43多糖抗氧化活性最低。皮尔逊相关性分析显示,不同茶树品种多糖的抗氧化能力差异与其所含多酚和蛋白质含量有关。不同茶树品种多糖清除 DPPH自由基和 ABTS自由基的半抑制浓度与其所含的多酚、蛋白质含量呈显著负相关(P<0.05);并且茶多糖样品的铁离子还原能力与其多酚、蛋白质含量呈极显著正相关(P<0.01);不同茶树品种多糖的分子量与其所含半乳糖醛酸含量呈显著负相关(P<0.05)。
综上,本研究借助HPLC、凝胶色谱层析、傅立叶红外光谱等技术手段初步探明了我国具有代表性的10个茶树品种多糖的理化性质差异,比较了不同茶树品种多糖体外抗氧化活性差异,明确了不同茶树品种多糖中多酚及蛋白质含量与其抗氧化活性的关系,从茶多糖角度为特异性茶树品种的筛选提供了参考依据。
